Эпидемиология метастазов в головной мозг
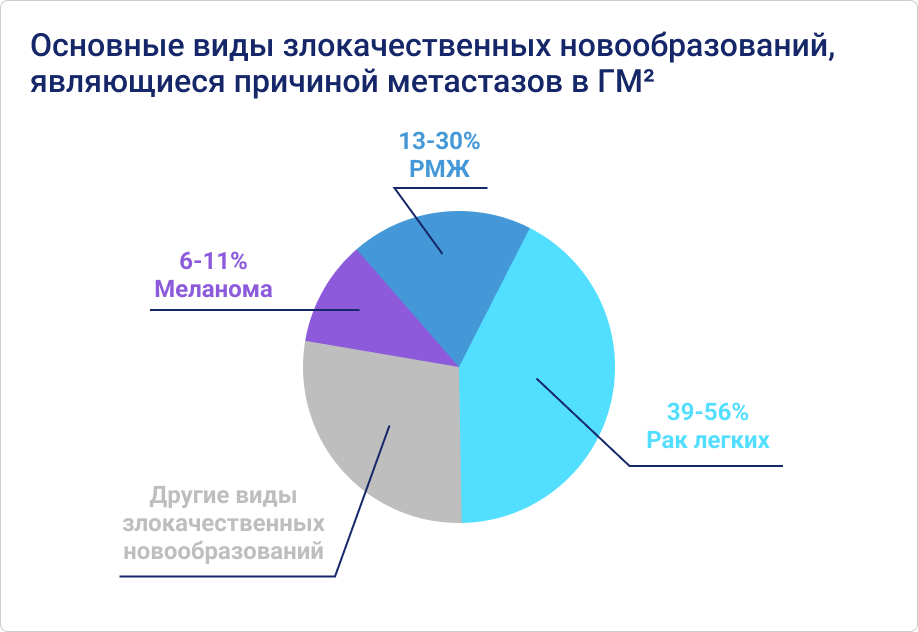
Меланома характеризуется достаточно низкой распространённостью. Так, в России доля меланомы составляет менее 2% от всех видов злокачественных новообразований (ЗНО)1. При этом меланома, наряду с раком молочной железы и раком лёгкого, имеет наибольшую склонность к метастазированию в головной мозг (ГМ). Частота развития метастазов в ГМ при меланоме достигает 73–75%2,3. На долю меланомы приходится 6–11% всех метастатических поражений ГМ, что выводит опухоль на третье место по данному показателю1,2.
Прогноз заболевания у пациентов с метастазами меланомы в головной мозг
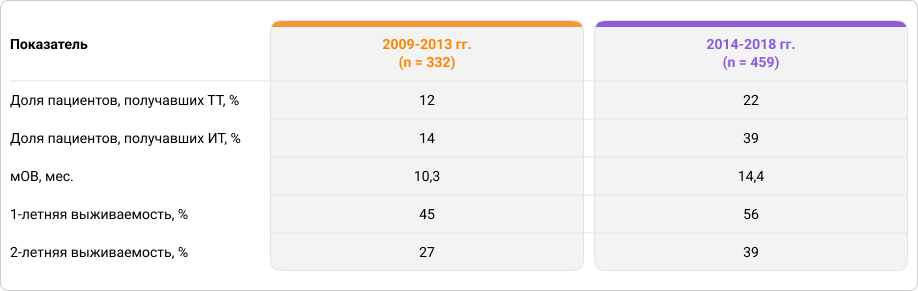
Развитие метастазов меланомы в ГМ связано с плохим прогнозом: медиана общей выживаемости (ОВ) таких пациентов до внедрения в практику современных методов терапии составляла примерно 4–5 месяцев3–5. С началом применения и развитием таргетной (ТТ) и иммуноонкологической терапии (ИТ) эффективность лечения данной когорты пациентов существенно возросла. Это доказывают результаты исследования Hasanov M. и соавт., которые сравнили выживаемость пациентов с диагностированными метастазами в ГМ(n = 791), находящихся на лечении в одном исследовательском центре, за два пятилетних периода — 2009–2013 гг. (n = 332) и 2014–2018 гг. (n = 459).
Во втором периоде пациенты чаще проходили лечение ТТ (22%) и ИТ (39%), чем в первом: 12% и 14% соответственно. При этом медиана ОВ (мОВ) во втором периоде выросла до 14,4 месяца по сравнению с 10,3 месяца в первом. 1-летняя и 2-летняя выживаемость также были выше во втором периоде: 56% и 39% против 45% и 27% в первом периоде соответственно5.
Таблица 1. Сравнительный анализ выживаемости пациентов с метастазами в ГМ за 2 пятилетних периода5
Симптомные и бессимптомные метастазы в головной мозг
Метастазы в ГМ могут сопровождаться развитием общемозговой или очаговой неврологической симптоматики или оставаться бессимптомными6,7.
Самой тяжёлой группой пациентов с меланомой являются пациенты с симптомными метастазами в головной мозг из-за склонности к быстрому ухудшению состояния и частой необходимости применения глюкокортикостероидов (ГКС) для контроля неврологических симптомов6. Наиболее частыми общемозговыми симптомами метастазов в ГМ являются головная боль, тошнота, рвота, головокружение, двоение в глазах. Специфические проявления очаговой неврологической симптоматики связаны с локализацией метастатических очагов в различных структурах ГМ и могут включать нарушения чувствительности, памяти, зрения и слуха, различные двигательные нарушения и эпилептические припадки7,8.
Проблема критериев симптомности метастазов в ГМ
Наличие симптомов при метастазах опухоли в головной мозг оказывает влияние на прогноз заболевания и тактику лечения пациентов4,6. Однако наличие симптомов метастазов в ГМ и степень их выраженности может трактоваться по‑разному. Так, в клиническом исследовании TRICOTEL авторам пришлось произвести переоценку результатов применения комбинации атезолизумаб + вемурафениб + кобиметиниб у пациентов с симптомными метастазами меланомы в ГМ в связи с неверной интерпретацией проявлений симптомности. Первично опубликованные результаты исследования были отозваны авторами, критерии симптомности метастазов в ГМ были пересмотрены, как и оценка эффективности применения комбинации. К сожалению, опубликованные повторно результаты продемонстрировали более низкую эффективность триплета атезолизумаб + вемурафениб + кобиметиниб при симптомных метастазах в ГМ9,10,11. Подробнее об этом исследовании и его результатах в статье «Сравнение основных опций лечения пациентов с симптомными метастазами меланомы кожи в головной мозг».
Выработка единых критериев симптомности метастазов является важной задачей, решение которой позволит проводить более объективное сравнение эффективности разных видов лечения для пациентов с метастазами в ГМ.
Лечение пациентов с метастазами в головной мозг
Для лечения пациентов с метастазами в ГМ применяют локальные и системные методы8.
Локальные методы лечения:
- нейрохирургическое лечение
- дистанционная лучевая терапия
- облучение всего головного мозга
- стереотаксическая радиотерапия (в режиме радиохирургии или гипофракционирования)
Системные методы лечения:
- химиотерапия
- таргетная терапия
- иммуноонкологическая терапия
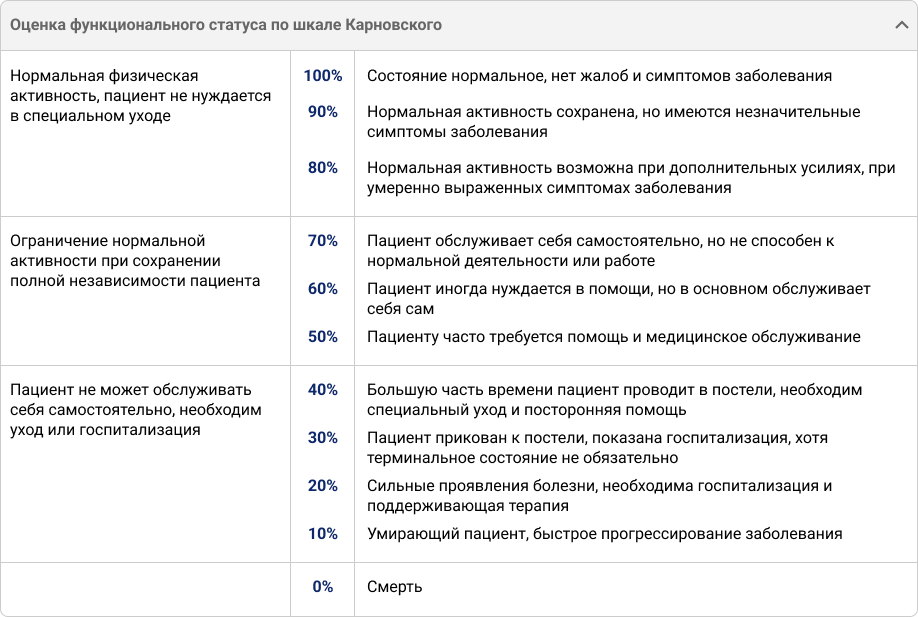
При планировании лечения врачу необходимо оценить размеры метастатических очагов, их количество и локализацию в ГМ8. Не менее важен функциональный статус пациента с бальной оценкой по шкале Карновского или ECOG8.
Нейрохирургическое лечение
У пациентов с метастазами в ГМ нейрохирургическое лечение проводится в случае одиночных крупных метастатических очагов (максимальный диаметр очага более 2,5 см в диаметре или объём более 10 см3), у пациентов с интракраниальными рецидивами метастазов в ГМ, стабилизацией экстракраниальной болезни и высоким функциональным статусом7. В этом случае хирургическое удаление метастазов может способствовать уменьшению неврологической симптоматики, сохранению функционального статуса, улучшению качества жизни и увеличению ОВ, а также в ряде случаев позволяет достичь локального контроля интракраниальных метастазов7. Вместе с тем реальная возможность хирургического удаления метастазов с описанными характеристиками также зависит от навыков и опыта нейрохирурга и от расположения метастазов по отношению к структурам мозга.
Применение нейрохирургического лечения при множественных метастазах в ГМ в отдельных случаях может привести к улучшению качества жизни, но не к увеличению ОВ12.
Облучение всего головного мозга
В настоящее время облучение всего головного мозга (ОВГМ) редко применяют в режиме монотерапии у пациентов с метастазами в ГМ. Большинство исследований показывают, что ОВГМ не увеличивает выживаемость у данной когорты пациентов7, но может быть использовано в ситуациях, когда проведение нейрохирургического лечения или стереотаксической радиотерапии не представляется возможным или целесообразным13. В частности, ОВГМ в самостоятельном режиме рекомендовано для пациентов с наличием от 11 и более метастатических очагов в ГМ и хорошим прогнозом общей выживаемости8.
Кроме низкой эффективности, к недостаткам ОВГМ можно отнести неблагоприятный профиль безопасности: ОВГМ ухудшает качество жизни, увеличивает риск нейрокогнитивных расстройств, а также может быть причиной развития лейкоэнцефалопатии и социальной дезадаптации пациента. При этом риск развития лейкоэнцефалопатии возрастёт с увеличением разовой дозы радиации и возрастом пациента7,14.
Стереотаксическая радиотерапия
В клинических исследованиях показано увеличение ОВ при применении стереотаксической радиотерапии у пациентов с одиночными метастазами в ГМ по сравнению с использованием ОВГМ15.
Стереотаксическая радиотерапия может быть проведена в режиме радиохирургии и в режиме гипофракционирования8.
Радиохирургия метастазов в ГМ позволяет достичь высоких показателей локального контроля7, особенно у больных с ограниченным метастатическим поражением ГМ и максимальным диаметром очагов менее 2,5–3 см16. Вместе с тем радиохирургия не снижает риск развития новых (дистантных) метастазов в ГМ7.
Наиболее часто встречающимся осложнением стереотаксической радиотерапии является радиационный некроз, который, как правило, сопровождается отёком окружающих тканей. Частота развития некроза напрямую зависит от объёма облучённой ткани, величины подведённой дозы и вида системной терапии (вероятность развития радиационного некроза выше при применении ингибиторов контрольных точек по сравнению с ТТ)7,9,17. В случае крупных метастатических очагов (больше 2,5 см в диаметре) при необходимости подведения большей дозы излучения целесообразнее применять стереотаксическую радиотерапию в режиме гипофракционирования7. Это позволяет уменьшить разовую дозу излучения и снизить риск развития радиационного некроза и неврологической токсичности.
В отношении очагов небольшого размера среди исследователей нет единого мнения о преимуществах режима гипофракционирования: имеются данные и об улучшении локального контроля18, и об отсутствии преимуществ режима гипофракционирования15.
Системные методы лечения
Системные методы лечения у пациентов с метастазами в ГМ включают проведение химиотерапии, ТТ и ИТ. В самостоятельном варианте лечения системную противоопухолевую терапию целесообразно проводить у пациентов с небольшими по размеру, бессимптомными метастазами в ГМ8.
Подробнее о применении ТТ, ИТ и их комбинации у пациентов с метастазами меланомы кожи в ГМ можно прочитать в статьях «Сравнение основных опций лечения пациентов с симптомными метастазами меланомы кожи в головной мозг» и «Опции системного лечения пациентов с бессимптомными метастазами меланомы кожи в головной мозг: так ли все очевидно?».
Сопутствующая терапия
Для снижения степени выраженности симптомов, вызванных повышением внутричерепного давления из-за отёка ГМ, пациенту с метастазами в ГМ может быть назначена терапия глюкокортикостероидами (ГКС)8. При назначении основного лечения следует учитывать сопутствующий приём ГКС, поскольку последние могут оказывать негативное влияние на эффективность, особенно ИТ19,20. Подробнее об этом можно прочитать в статье «Сравнение основных опций лечения пациентов с симптомными метастазами меланомы кожи в головной мозг».
В случае неэффективности ГКС при стойком или нарастающем отёке и/или радиационном некрозе рекомендована терапия бевацизумабом8.
В качестве сопутствующей терапии также возможно назначение противосудорожных препаратов8.
Сочетание разных методов лечения
У пациентов с метастазами в ГМ допустимо сочетание различных методов лечения в зависимости от размеров метастатических очагов, их количества и локализации в ГМ, а также от функционального статуса пациента8.
Так, для снижения риска локального рецидива после нейрохирургического лечения целесообразно проводить его в комбинации со стереотаксической радиотерапией (предоперационная радиохирургия или послеоперационная стереотаксическая радиотерапия ложа удалённого метастатического очага)8.
У пациентов с симптомными метастазами в ГМ противоопухолевую лекарственную терапию рекомендовано проводить в комбинации с локальным лечением метастазов в ГМ8. В то же время и у пациентов с бессимптомными метастазами наилучшие результаты показывает сочетанное применение системной лекарственной терапии и локальных методов лечения. Так, очень хороших результатов позволяет достичь использование ТТ комбинацией дабрафениб + траметиниб у пациентов с бессимптомными метастазами меланомы кожи в ГМ с предшествующей локальной терапией — в исследовании COMBI–MB медиана ОВ у данной группы пациентов составила 24,3 месяца4.
Ключевые выводы
Для лечения пациентов с метастазами в ГМ применяют локальные и системные методы8.
Проведение нейрохирургического лечения у пациентов с одиночными метастазами в ГМ может повысить ОВ7.
Облучение всего головного мозга характеризуется неблагоприятным профилем безопасности и не увеличивает ОВ у пациентов с метастазами в ГМ7.
Проведение только системной противоопухолевой терапии целесообразно у пациентов с небольшими по размеру, бессимптомными метастазами в ГМ8.
Комбинация различных вариантов локальной и системной терапии позволяют повысить эффективность лечения у пациентов с метастазами в ГМ.
Сокращения
ЗНО — злокачественные новообразования
ГКС — глюкокортикостероиды
ГМ — головной мозг
ИТ — иммуноонкологическая терапия
ОВ — общая выживаемость
ОВГМ — облучение всего головного мозга
ТТ — таргетная терапия
Список литературы
- Nayak, L., Lee, E. Q., Wen, P. Y. (2012). Epidemiology of brain metastases. Current oncology reports, 14(1), 48-54.
- Davies, M. A. et al. (2011). Prognostic factors for survival in melanoma patients with brain metastases. Cancer, 117(8), 1687-1696.
- Davies, M. A. et al. (2017). Dabrafenib plus trametinib in patients with BRAFV600-mutant melanoma brain metastases (COMBI-MB): a multicentre, multicohort, open-label, phase 2 trial. The Lancet Oncology, 18(7), 863-873.
- Hasanov, M. et al. (2023). Changes in outcomes and factors associated with survival in melanoma patients with brain metastases. Neuro-oncology, 25(7), 1310-1320.
- Tawbi, H. A. et al. (2021). Safety and efficacy of the combination of nivolumab plus ipilimumab in patients with melanoma and asymptomatic or symptomatic brain metastases (CheckMate 204). Neuro-oncology, 23(11), 1961-1973.
- Bанов, С. М. и др. (2018). Метастатическое поражение головного мозга: современные клинические рекомендации. Онкологический журнал: лучевая диагностика, лучевая терапия, 1(3), 75-84.
- Flickinger, J. C., Lunsford, L. D., Kondziolka, D. D. (1991). Dose-volume considerations in radiosurgery //stereotactic and Functional neurosurgery. 57(1-2), 99-105.
- Dummer, R. et al. (2023). Atezolizumab, vemurafenib, and cobimetinib in patients with melanoma with CNS metastases (TRICOTEL): a multicentre, open-label, single-arm, phase 2 study. The Lancet Oncology, 24(14), 1470-2035.
- Dummer, R., Tawbi, H. (2023). Retraction and republication—TRICOTEL: defining symptomatic brain metastases in clinical trials. The Lancet Oncology, 24(8), S327.
- Patel, T. R., Knisely, J. P., Sahgal, A. A. (2012). Management of brain metastases: surgery, radiation, or both? Hematology/oncology clinics of North America, 26(4), 933-947.
- Gaspar, L. et al. (1997). Recursive partitioning analysis (RPA) of prognostic factors in three Radiation Therapy Oncology Group (RTOG) brain metastases trials. International journal of radiation oncology, biology, physics, 37(4), 745-751.
- Ebi, J. et al. (2013). Incidence of leukoencephalopathy after whole-brain radiation therapy for brain metastases. International Journal of Radiation Oncology* Biology* Physics, 85(5), 1212-1217.
- Inoue, H. K. et al. (2014). Optimal hypofractionated conformal radiotherapy for large brain metastases in patients with high risk factors: a single-institutional prospective study. Radiation Oncology, 9(1), 1-9.
- Tsao, M., Xu, W., Sahgal, A. A. (2012). A mult‐analysis evaluating stereotactic radiosurgery, whole‐brain radiotherapy, or both for patients presenting with a limited number of brain metastases. Cancer, 118(9), 2486-2493.
- Kotecha, R. et al. (2017). Melanoma brain metastasis: the impact of stereotactic radiosurgery, BRAF mutational status, and targeted and/or immune-based therapies on treatment outcome. Journal of Neurosurgery, 129(1), 50-59.
- Marchetti, M. et al. (2011). Hypofractionated stereotactic radiotherapy for oligometastases in the brain: a single-institution experience. neurological sciences, 32(3), 393-399.
- Tawbi, H. A. et al. (2021). Safety and efficacy of the combination of nivolumab plus ipilimumab in patients with melanoma and asymptomatic or symptomatic brain metastases (CheckMate 204). Neuro-oncology, 23(11), 1961-1973.
- Long, G. V. et al. (2018). Combination nivolumab and ipilimumab or nivolumab alone in melanoma brain metastases: a multicentre randomised phase 2 study. The Lancet Oncology, 19(5), 672-681.
11338313/ONCO/DIG/12.24/0