Лечение пациентов с симптомными метастазами меланомы кожи в головной мозг (ГМ) связано со значительными сложностями. Данная группа пациентов хуже реагирует на лечение из-за склонности к быстрому прогрессированию заболевания и частой необходимости применения для контроля неврологических симптомов глюкокортикостероидов (ГКС). Применение последних у пациентов с меланомой кожи исследователи связывают со снижением эффективности системного лечения, в первую очередь иммуноонкологической терапии (ИТ)1,2,3,4.
Мы обсудим роль и перспективы применения таргетной терапии (ТТ), ИТ и их комбинации в лечении пациентов с симптомными метастазами меланомы кожи в ГМ.
Подробнее об эпидемиологии метастазов в ГМ и о критериях, по которым метастазы в ГМ можно отнести к симптомным, можно узнать в статье.
О лечении пациентов с бессимптомными метастазами можно прочитать в статье.
Исследования эффективности ТТ, ИТ и их комбинации у пациентов с симптомными метастазами меланомы кожи в ГМ
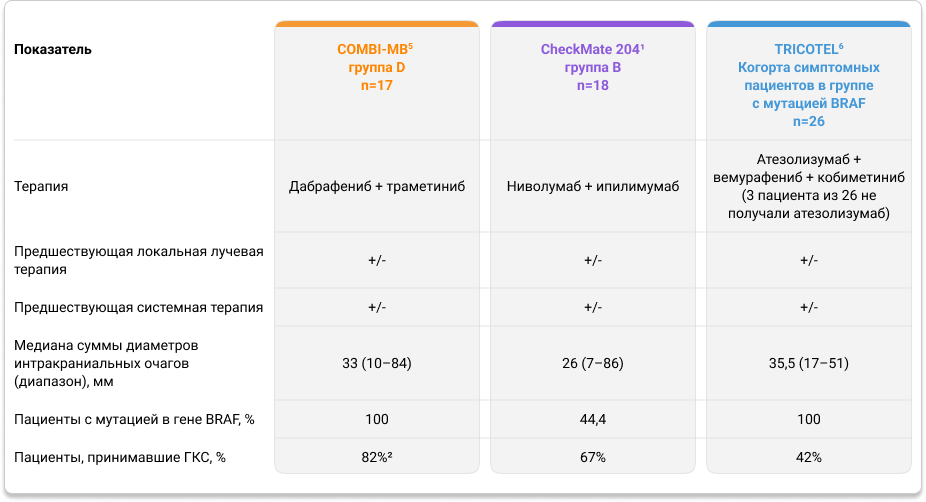
Нами проведено непрямое сравнение трех наиболее крупных и показавших обнадеживающие результаты исследований эффективности ИТ и ТТ, в которых участвовали пациенты с симптомными метастазами меланомы в ГМ: COMBI-MB, CheckMate 204 и TRICOTEL. Характеристика пациентов, принимавших участие в этих исследованиях, представлена в таблице 1.
Таблица 1. Характеристика пациентов с симптомными метастазами меланомы кожи в ГМ в исследованиях COMBI-MB, CheckMate 204 и TRICOTEL
Непрямое сравнение результатов COMBI-MB и TRICOTEL в отношении пациентов с симптомными метастазами меланомы кожи в ГМ
Первые исследования иммунотерапии у пациентов с метастазами меланомы кожи в ГМ показали неэффективность использования только одного ниволумаба7. Иммунотерапия с применением двойной комбинации (ниволумаб + ипилимумаб) продемонстрировала достаточную эффективность у пациентов с бессимптомными метастазами, однако у пациентов с симптомными метастазами меланомы кожи в ГМ, по данным исследования CheckMate 204, эффективность была низкая: интракраниальная ЧОО составила всего 17%8.
Поэтому дальнейшее непрямое сравнение мы проводили только между исследованиями COMBI-MB (группа D: симптомные пациенты с мутацией в гене BRAF V600D/E/K/R) и TRICOTEL (когорта симптомных пациентов в группе пациентов с мутацией в гене BRAF).
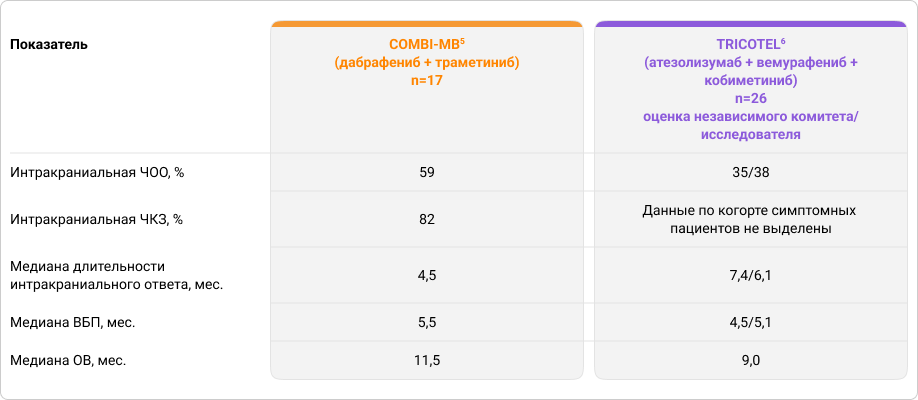
Таблица 2. Эффективность лечения пациентов с симптомными метастазами меланомы кожи в головной мозг в исследованиях COMBI-MB и TRICOTEL
Опубликованные в 2022 году результаты исследования TRICOTEL у когорты пациентов с симптомными метастазами меланомы кожи в ГМ были весьма обнадеживающими. Однако спустя несколько месяцев публикация была отозвана авторами, а сами результаты были переоценены9. Пересмотр результатов был связан с исходно нечетко определенными критериями, по которым метастазы меланомы кожи в ГМ можно отнести к симптомным или бессимптомным. В опубликованном опровержении авторы формулируют основные характеристики, по которым метастазы в ГМ можно считать симптомными:
Использование сопутствующих кортикостероидов (>2 мг в день дексаметазона и/или эквивалента) и/или противосудорожных препаратов и/или наличие тошноты или рвоты, головных болей, судорог, дисфункции двигательных навыков, потери чувствительности или нарушения зрения или слуха9.
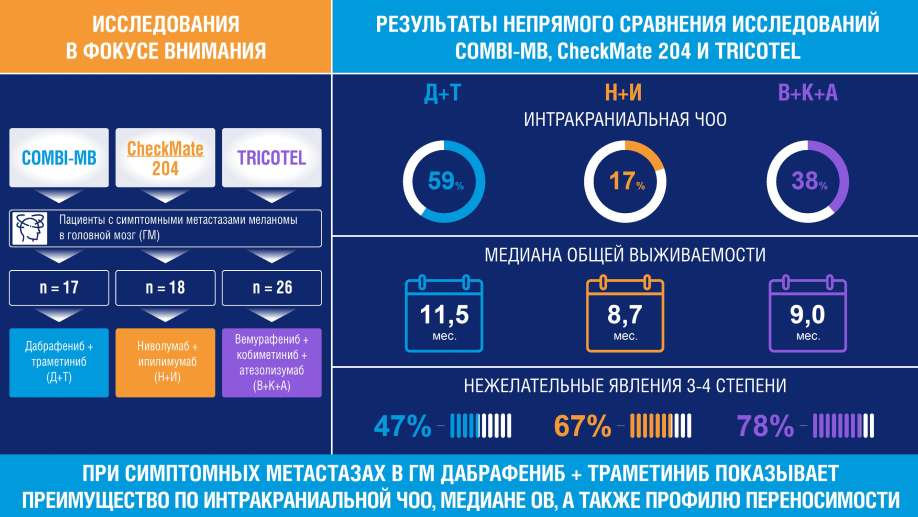
Пересмотренные результаты исследования TRICOTEL оказались ниже изначально опубликованных, и в сравнении с результатами исследования COMBI-MB уже не кажутся такими обнадеживающими. Так, интракраниальная ЧОО при применении комбинации дабрафениб + траметиниб была выше почти в 1,5 раза, чем при применении тройной комбинации атезолизумаб + вемурафениб + кобиметиниб5,6. Медиана ОВ (11,5 месяцев) и медиана ВБП (5,5 месяцев) при применении комбинации дабрафениб + траметиниб также были выше, чем при применении тройной комбинации (медиана ОВ 9,0 месяца, медиана ВБП 4,5–5,1 месяца)5,6. Двойная комбинация уступала триплету только по длительности интракраниального ответа — 4,5 месяца и 6,1–7,4 месяца соответственно5,6.
Профиль безопасности комбинаций дабрафениб + траметиниб и атезолизумаб + вемурафениб + кобиметиниб
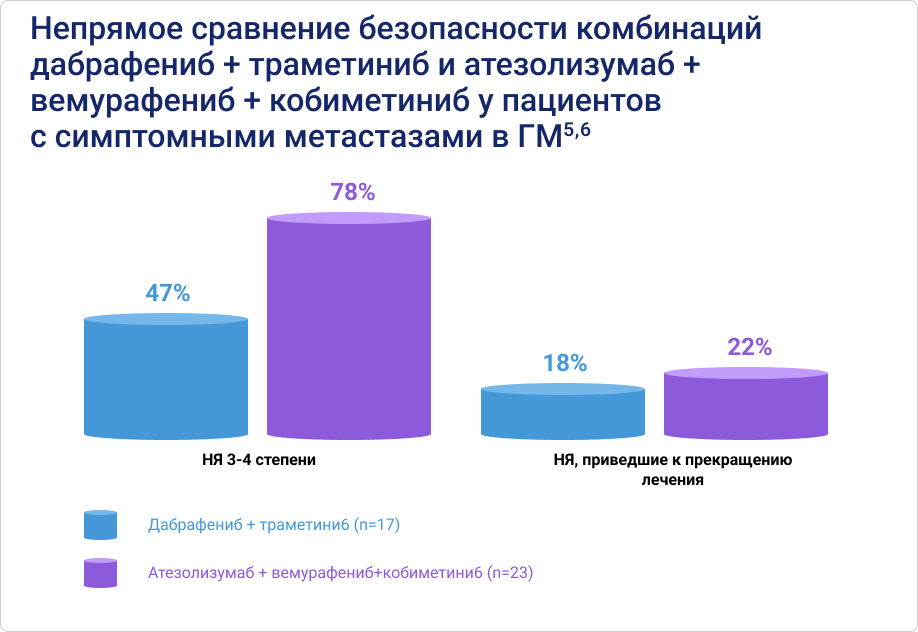
По профилю безопасности у пациентов с симптомными метастазами меланомы в ГМ комбинация дабрафениб + траметиниб значительно превосходит триплет атезолизумаб + вемурафениб + кобиметиниб5,6.
В клинических исследованиях с НЯ 3-4 степени тяжести столкнулись 8 из 10 пациентов, получавших терапию тройной комбинацией, и только 5 из 10 пациентов, принимавших дабрафениб + траметиниб. Кроме того, при применении тройной комбинации несколько чаще происходило прерывание лечения в связи с непереносимостью терапии: 22% против 18% при применении комбинации дабрафениб + траметиниб5,6. Также важно помнить, что в состав триплета входит ингибитор контрольных точек атезолизумаб, а препараты этой группы способны вызывать иммуноопосредованные НЯ, которые могут переходить в хроническую форму и требовать длительной терапии ГКС10.
Влияние приема ГКС на эффективность терапии симптомных метастазов меланомы кожи в ГМ
Прием ГКС негативно сказывается на выживаемости онкологических пациентов и эффективности ИТ у пациентов с метастазами меланомы в ГМ. Последние исследования убедительно доказывают эту связь1,3. Возможное объяснение связано с тем, что ГКС повышают уровень ингибитора цистеиновой протеазы цистатина С, который, предположительно, обладает иммуносупрессорными свойствами. Высокие уровни цистатина С связывают со снижением выживаемости при всех видах рака и отсутствием ответа на ИТ4.
Однако оказалось, что прием ГКС влияет на эффективность не только ИТ, но и других видов системного лечения у пациентов с меланомой кожи. В 2023 году были опубликованы новые данные исследования COMBI-MB, показавшие, что при применении ТТ у пациентов с метастазами меланомы кожи в ГМ, принимавших ГКС, показатели интракраниальной ЧОО, медианы ВБП и медианы ОВ были существенно ниже2. Авторы оценивали влияние на данные показатели не только приема ГКС, но и более 10 других факторов (в том числе, уровня ЛДГ, предшествующего лечения, размера метастазов и др.). Только связь между приемом ГКС и эффективностью лечения была подтверждена одномерным и многомерным анализом.
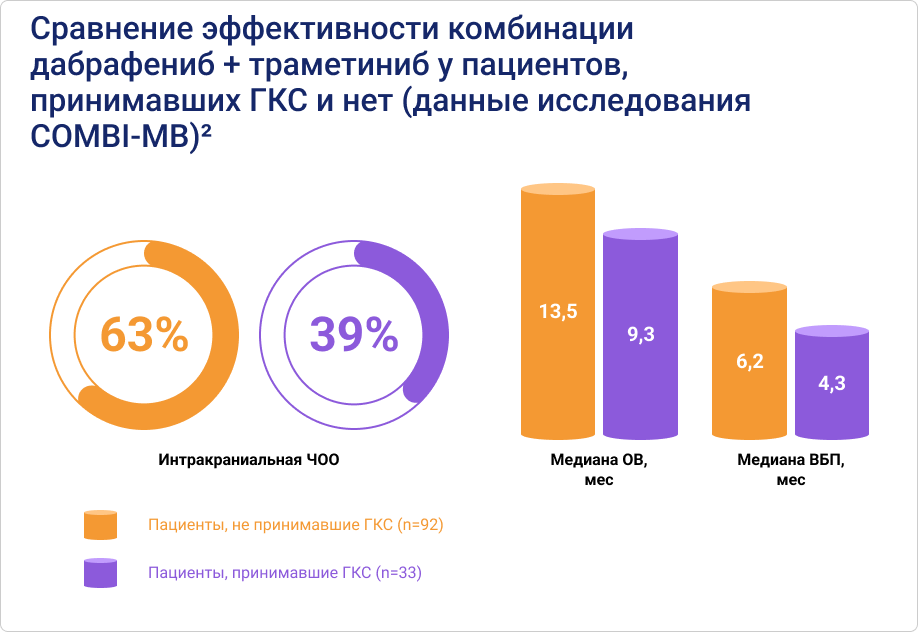
По мнению авторов исследования, влияние приема ГКС на эффективность терапии (как ИТ, так и ТТ) настолько велико, что должно учитываться, как ключевой фактор при интерпретации результатов клинических исследований2.
С учетом этих данных интересно еще раз вернуться к результатам исследований COMBI-MB и TRICOTEL у пациентов с симптомными метастазами меланомы в ГМ. Учитывая, что в исследовании COMBI-MB доля симптомных пациентов, принимавших ГКС, была почти в 2 раза выше, чем в исследовании TRICOTEL (82%5 против 42%6), мы могли бы ожидать более низкой эффективности комбинации дабрафениб + траметиниб по сравнению с триплетом. Что же видим мы? При применении комбинации дабрафениб + траметиниб в исследовании COMBI-MB получены лучшие результаты (ЧОО, медиана ОВ), чем у менее тяжелых пациентов (реже принимавших ГКС) при применении тройной комбинации в исследовании TRICOTEL5,6.
Ключевые выводы
- Среди пациентов с меланомой кожи наиболее тяжелой для лечения группой являются пациенты с симптомными метастазами в ГМ1,2.
- Пациентам с симптомными метастазами меланомы в ГМ часто требуется прием ГКС, которые могут снижать ответ опухоли на любую лекарственную терапию, особенно на ИТ1,2,3.
- Эффективность ИТ у пациентов с симптомными метастазами меланомы в ГМ была достаточно низкой8.
- При непрямом сравнении у пациентов с симптомными метастазами меланомы кожи в ГМ комбинация дабрафениб + траметиниб превосходила триплет атезолизумаб + вемурафениб + кобиметиниб и по эффективности, и по безопасности5,6:
- интракраниальная ЧОО 59% vs 35/38%;
- медиана ОВ 11,5 месяцев vs 9 месяцев;
- НЯ 3-4 степени тяжести 47% vs 78%.
Сокращения
ВБП — выживаемость без прогрессирования
ГКС — глюкокортикостероиды
ГМ — головной мозг
ИТ — иммуноонкологическая терапия
ЛДГ — лактатдегидрогеназа
ОВ — общая выживаемость
ТТ — таргетная терапия
ЧКЗ — частота контроля заболевания
ЧОО — частота объективного ответа
Список литературы
- Tawbi H. A. et al. Safety and efficacy of the combination of nivolumab plus ipilimumab in patients with melanoma and asymptomaticor symptomatic brain metastases (CheckMate 204) //Neuro-oncology. – 2021. – Т. 23. – №. 11. – С. 1961-1973.
- Wilmott J. S. et al. Clinical features associated with outcomes and biomarker analysis of dabrafenib plus trametinib treatment in patients with BRAF-mutant melanoma brain metastases //Clinical Cancer Research. – 2023. – Т. 29. – №. 3. – С. 521-531.
- Long G. V. et al. Combination nivolumab and ipilimumab or nivolumab alone in melanoma brain metastases: a multicentre randomised phase 2 study //The Lancet Oncology. – 2018. – Т. 19. – №. 5. – С. 672-681.
- Kleeman S. O. et al. Cystatin C is glucocorticoid responsive, directs recruitment of Trem2+ macrophages, and predicts failure of cancer immunotherapy //Cell Genomics. – 2023.
- Davies M. A. et al. Dabrafenib plus trametinib in patients with BRAFV600-mutant melanoma brain metastases (COMBI-MB): a multicentre, multicohort, open-label, phase 2 trial //The Lancet Oncology. – 2017. – Т. 18. – №. 7. – С. 863-873.
- Dummer R. et al. Atezolizumab, vemurafenib, and cobimetinib in patients with melanoma with CNS metastases (TRICOTEL): a multicentre, open-label, single-arm, phase 2 study // The Lancet Oncology. – 2023. – Т. 24. – №. 14. – С. 1470-2035.
- Long G. V. et al. Combination nivolumab and ipilimumab or nivolumab alone in melanoma brain metastases: a multicentre randomised phase 2 study //The Lancet Oncology. – 2018. – Т. 19. – №. 5. – С. 672-681.
- Tawbi H. A. et al. Long-term outcomes of patients with active melanoma brain metastases treated with combination nivolumab plus ipilimumab (CheckMate 204): final results of an open-label, multicentre, phase 2 study //The lancet oncology. – 2021. – Т. 22. – №. 12. – С. 1692-1704.
- Dummer R., Tawbi H. Retraction and republication — TRICOTEL: defining symptomatic brain metastases in clinical trials //The Lancet Oncology. – 2023. – Т. 24. – №. 8. – С. e327.
- Patrinely J. R. et al. Chronic immune-related adverse events following adjuvant anti–PD-1 therapy for high-risk resected melanoma //JAMA oncology. – 2021. – Т. 7. – №. 5. – С. 744-748.
11338311/ONCO/DIG/12.24/0