Несмотря на успехи в раннем выявлении и лечении меланомы кожи, прогноз выживаемости пациентов, особенно пациентов с метастатической меланомой, оставляет желать лучшего. Так, этот вид новообразований составляет 4–7% от вновь выявленных случаев злокачественных опухолей и 1,9% среди всех причин смерти от онкологических заболеваний в мире1. В России в 2019 году было зарегистрировано 11792 пациентов с меланомой кожи: на I стадии — 38,9%, на II стадии — 41,9%, на III стадии — 10,2%, на IV стадии — 7,5%, стадия не установлена у 1,4%2 Таким образом к моменту выявления заболевания почти у каждого пятого пациента уже регистрируют регионарные или отдаленные метастазы3.
Самой частой локализацией метастазов меланомы является кожа. Кожные и/или подкожные метастазы регистрируются примерно в 2–18% случаев меланомы4. Кроме этого, меланома кожи склонна к метастазированию в слизистые оболочки, легкие, мочеполовой тракт, реже органы желудочно-кишечного тракта (рис. 1)5. В литературе описаны единичные случаи метастазов редкой локализации — например, метастазирования меланомы кожи в желчный пузырь6.
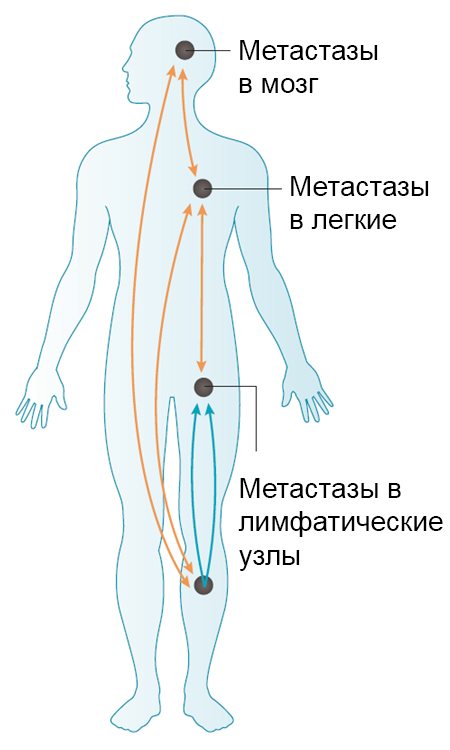
Рисунок 1 — Схематическое изображение основных локализаций метастазов меланомы
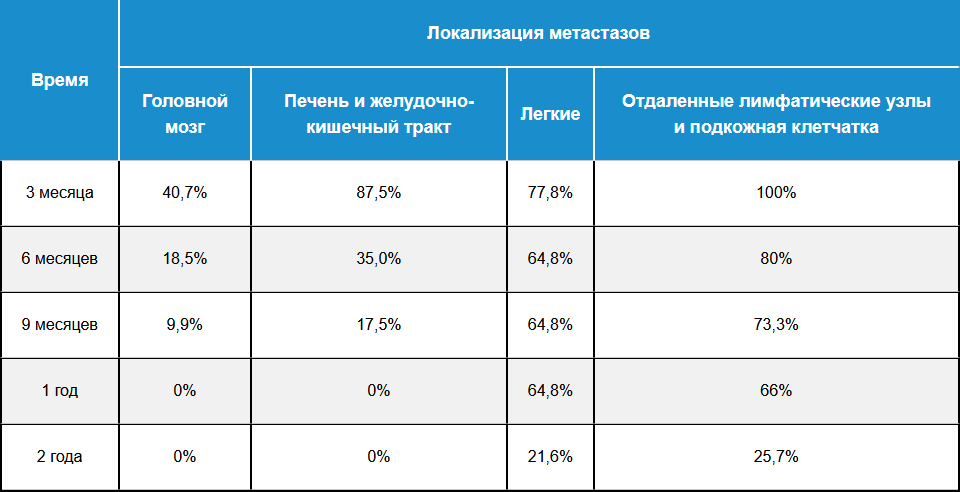
Наличие метастазов меланомы является неблагоприятным прогностическим фактором. Если меланома кожи I–II часто может быть излечена хирургически, то в случае диссеминированной меланомы вероятность стойкого излечения после операции не превышает 25% — вероятно, из‑за наличия микрометастазов в отдаленных от первичного очага тканях и внутренних органах7. При этом было показано, что при различной локализации метастазов наблюдаются статистически достоверные различия по риску смерти8. Так, вероятность летального исхода у пациентов с метастазами в головной мозг вдвое выше, чем у пациентов с метастазами в кишку, в 7 раз выше, чем у пациентов с метастазами в легкие, и в 12 раз выше по сравнению с пациентами с метастазами в экстрарегионарные лимфатические узлы или подкожную жировую клетчатку (табл. 1).
Таблица 1 — Выживаемость при меланоме кожи IV стадии в зависимости от первичной локализации метастазов (адаптировано из Sandru et al., 2014)8
Метастазирование в головной мозг является серьезной проблемой в лечении меланомы. Формирование метастазов обусловлено многими причинами, среди которых взаимодействие метастатических клеток с гематоэнцефалическим барьером (ГЭБ), экстрацеллюлярным матриксом (ЭЦМ) и естественным тропизмом клеток меланомы к структурам головного мозга. Инвазия и рост опухолевых клеток в паренхиме мозга является результатом взаимодействия метастатических клеток с эндотелиальными клетками ГЭБ и компонентами ЭЦМ9.
Метастазирование — это многоэтапный процесс, на первом этапе которого клетки первичной опухоли попадают в кровоток, затем связываются с эндотелиальными клетками микрососудов мозга и проникают через ГЭБ в паренхиму мозга (рис. 2). На следующем этапе происходит взаимодействие опухолевых клеток с микроокружением, что ведет к их пролиферации. Исходя из свойств опухолевых клеток, они могут расти или за счет формирования новых сосудов (неоангиогенез), или за счет роста вдоль существующих сосудов9.
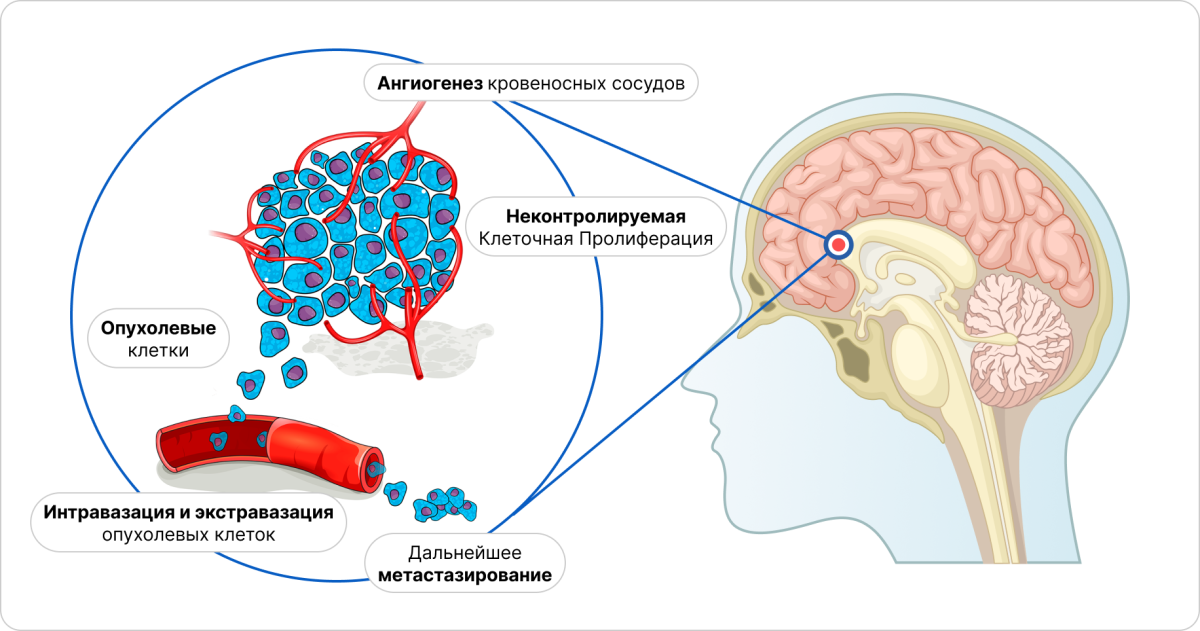
Рисунок 2 — Механизм метастазирования меланомы кожи в головной мозг
Резистентность к терапии является одной из самых больших проблем при лечении метастазов в головном мозге10. Это связано в первую очередь с низкой степенью проникновения лекарственных средств и их метаболитов через ГЭБ. В настоящее время достаточно мало сведений о путях регуляции проницаемости ГЭБ как у здоровых людей, так и у больных меланомой кожи с метастазами в головной мозг11. Тем не менее в литературе описано, что, например, снижение активности гена-супрессора PTEN, активирующее путь PI3K-AKT, коррелирует с достоверным увеличением риска формирования метастазов в головном мозге12. К тому же сами метастатические клетки могут регулировать различные внеклеточные протеазы, такие как катепсин, что, вероятно, также приводит к метастатическому поражению головного мозга у больных с меланомой кожи13. Помимо таких прогностических факторов, как возраст, течение болезни, локализация опухоли, важное значение имеет наличие неврологических симптомов и лептоменингеальных метастазов (рис. 3).
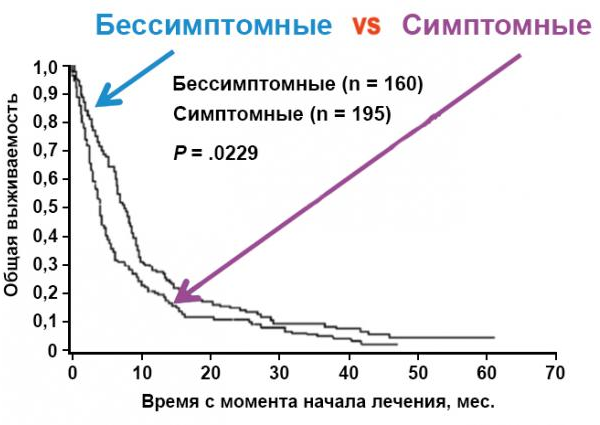

Рисунок 3 — Зависимость общей выживаемости от наличия неврологических симптомов и лептоменингеальных метастазов
В 5% случаев метастазы выявляются в оболочках мозга, субарахноидальном пространстве и цереброспинальной жидкости. Пациенты с лептоменингеальными метастазами имеют наихудший прогноз и отличаются быстрым прогрессированием болезни (средняя выживаемость 8–10 недель)14.
Список источников:
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2019. CA Cancer J. Clin. 2019;69:7–34.
- Каприн А.Д., Старинский В.В., Петрова Г.В. (eds.): Состояние онкологической помощи населению России в 2019 году. М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России; 2020.
- Tilgen W. Malignant melanoma current therapeutic concepts. // Oncologie.– 2000.– Vol. 18.– Р. 534–547.
- Savoia P., Fava P., Nardт T. et al. Skin metastases of malignant melanoma: a clinical and prognostic survey // Melanoma Res.– 2009.– Vol. 19.– № 5.– P. 321–326.
- Schadendorf D., van Akkooi A.C.J., Berking C. et al. Melanoma. Lancet. 2018;392:971–984.
- Hess G.F., Glatz K., Rothschild S.I. et al. Malignant melanoma metastasis in the gallbladder. A case report of an unusual metastatic site. Int J Surg Case Rep. 2020;75:372-375.
- Wornom I.L., Smith J.W., Soong S.-J. et al. Surgery as palliative treatment for distant metastases of melanoma. Ann Surg 204:181, 1986.
- Sandru A., Voinea S., Panaitescu E., Blidaru A. Survival rates of patients with metastatic malignant melanoma. J Med Life. 2014;7(4):572-576.
- Fidler I.J., Schackert G., Zhang R.D., Radinsky R., Fujimaki T. The biology of melanoma brain metastasis. Cancer Metastasis Rev. 1999;18(3):387-400.
- Fidler I.J. The Biology of Brain Metastasis: Challenges for Therapy. Cancer J. 2015 Jul-Aug;21(4):284-93.
- Tumors Disrupt the Blood-Brain Barrier and Alter Lipid Metabolism by Inhibiting Expression of the Endothelial Cell Fatty Acid Transporter Mfsd2a. Sci Rep 8, 8267 (2018).
- Bucheit A.D. et al. Complete loss of PTEN protein expression correlates with shorter time to brain metastasis and survival in stage IIIB/C melanoma patients with BRAFV600 mutations. Clin Cancer Res 20, 5527–5536.
- Zhang L. et al. Microenvironment-induced PTEN loss by exosomal microRNA primes brain metastasis outgrowth. Nature 527, 100–104.
- Smalley K.S., Fedorenko I.V., Kenchappa R.S., Sahebjam S., Forsyth P.A. Managing leptomeningeal melanoma metastases in the era of immune and targeted therapy. Int J Cancer. 2016 Sep 15;139(6):1195-1201.
11338335/ONCO/DIG/12.24/0
