В настоящее время возрастная макулярная дегенерация (ВМД) — одно из самых распространенных офтальмологических заболеваний. На территории Европы от ВМД страдают около 67 миллионов человек, и, по прогнозам, к 2050 году ожидается увеличение их количества на 15%1, а в отношении поздней ВМД — 57% (от 400 тыс. до 700 тыс. новых случаев в год)1.
Несмотря на статистику, нельзя не отметить невероятный прогресс в лечении этого заболевания. Так, до 1980 года не существовало методик лечения ВМД, и пациентам грозила постепенная потеря зрения. Затем с 1980-х до первой половины 2000-х использовалось лазерное и фотодинамическое лечение, суть которых заключалась в попытке остановить или замедлить прогрессирование заболевания2.
С появлением анти-VEGF-терапии в 2005 году стали возможными не только остановка прогрессирования заболевания, но и достижение оптимальной остроты зрения (ОЗ) у пациентов с ВМД. С тех пор ведется работа по оптимизации схем лечения для получения максимального эффекта3.
Особенности строения молекулы ранибизумаба
В первую очередь важно строение молекулы препарата: выявлено, что полноразмерные антитела не проникают во все слои сетчатки, поэтому для более глубокого проникновения была разработана молекула ранибизумаба, которая представляет собой антигенсвязывающего фермента антитела. Такое строение молекулы значительно снижает риск комплемент-опосредованной или клеточной цитотоксичности и минимизирует системное воздействие за счет уменьшения периода полувыведения4,5. Помимо этого, ранибизумаб обладает высокой связывающей способностью при низком молекулярном весе, что позволяет достичь оптимальной биологической активности.
Ранибизумаб за счет строения молекулы способен проходить между клетками пигментного эпителия сетчатки (ПЭС) и оказывать таргетное воздействие на структуры, непосредственно участвующие в патогенезе ВМД (рис. 1). При этом препарат не вызывает гибели и гипертрофии клеток ПЭС, что играет важную роль в снижении риска развития географической атрофии. Кроме того, ранибизумаб в доклиническом исследовании не вызвал выраженного гемолиза, что указывает на низкую токсичность препарата6.
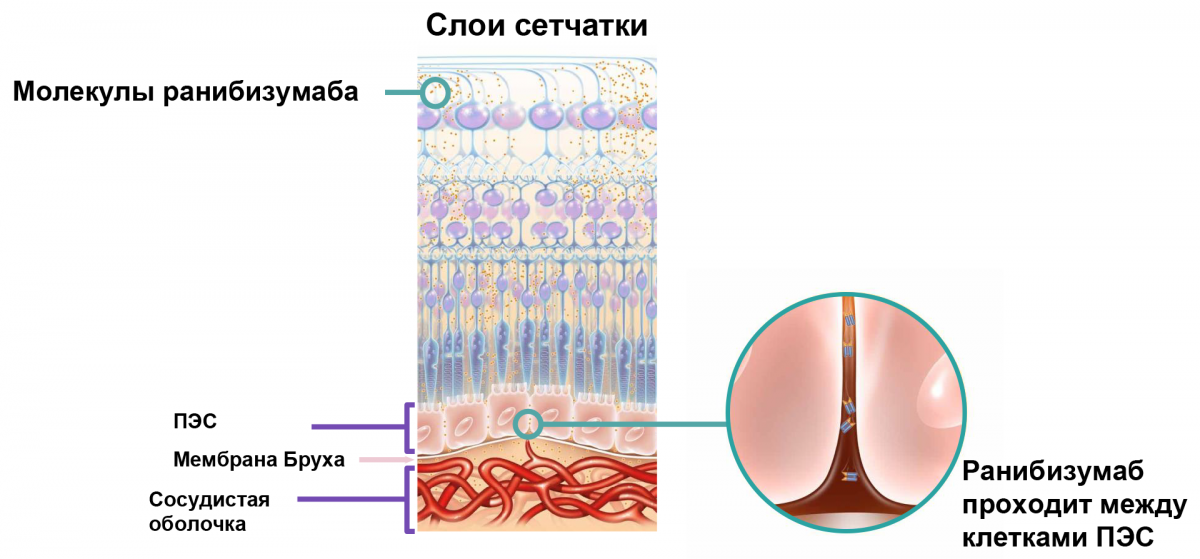
Рисунок 1. Схема прохождения молекул ранибизумаба через слои сетчатки: таргетность действия
Эффективность анти-VEGF при различных заболеваниях
Клинические данные показали улучшение ОЗ на фоне лечения ранибизумабом при различных заболеваниях15: неоваскулярной ВМД (нВМД), диабетическом макулярном отеке (ДМО), окклюзии центральной вены сетчатки (ОЦВС), окклюзии ветвей центральной вены сетчатки (ОВВС), хориоидальной неоваскуляризации (ХНВ), в частности миопической (мХНВ) (рис. 2).
Изменение ОЗ через год у пациентов с потерей ОЗ на 0–14 букв к 4-му месяцу

Рисунок 2. Результаты терапии ранибизумабом при всех одобренных показаниях
Было установлено долгосрочное сохранение улучшения ОЗ, полученного на ранних сроках терапии14.
Оценка реальной клинической практики
Использование ранибизумаба при низкой частоте инъекций в реальной клинической практике может сопровождаться отсутствием или отрицательной динамикой ОЗ (рис. 3). Это объясняется тем, что частота введения препарата в рамках исследования строго регламентирована, а в реальной практике не всегда есть возможность соблюсти сроки инъекций7.
Мониторинг активности заболевания и проактивный подход к терапии — основа успешного ведения пациентов в реальной клинической практике.
Рисунок 3. Режимы анти-VEGF-терапии и реальная клиническая практика
Международный опыт показал, что результаты реальной практики могут отличаться от клинических исследований по нескольким причинам.
-
Во-первых, речь идет о вышеупомянутых сроках инъекций: интервалы между инъекциями могут быть более длительными, чем показано клинически; кроме того, имеет место задержка начала терапии или ее возобновления при ухудшении.
-
Во-вторых, в реальной практике наблюдается меньшее количество инъекций по сравнению с исследованиями и различная интерпретация критериев проведения повторных инъекций или прекращения терапии.
-
В-третьих, в реальную клиническую практику включаются пациенты с сопутствующими системными или офтальмологическими заболеваниями, которые могут ограничивать эффективность лечения, а при клинических исследованиях такие пациенты могли исключаться8.
Ретроспективное сравнительное исследование динамики ОЗ в зависимости от количества инъекций в год показало, что при большем количестве инъекций в год результаты ОЗ в течение 10 лет были лучше. Соответственно, при адекватном объеме терапии ОЗ может достигать оптимальных значений и в долгосрочном периоде14.
Назначение анти-VEGF-терапии
Метаанализ 42 исследований реальной клинической практики, включавших 26 360 пациентов, показал взаимосвязь между улучшением ОЗ и количеством инъекций ранибизумаба. Так, при среднем количестве инъекций 4,3 увеличение ОЗ по ETDRS составило 1,2 буквы, при 6,2 инъекции — уже 7 букв, а при 7,8 инъекции — 7,8 буквы к первому году анти-VEGF-терапии9.
С учетом этих данных была сформирована определенная последовательность действий для пациентов, которым планируется анти-VEGF-терапия10.
Алгоритм ведения пациента
Шаг 1. Определение показаний, выбор анти-VEGF-препарата.
Этап включает тщательное обследование, постановку диагноза и выбор анти-VEGF-препарата для старта терапии.
Шаг 2. Формирование ожиданий у пациентов.
Необходимо сформировать ожидания у пациентов: предположить среднее количество инъекций, объяснить важность раннего лечения и вариабельность ответа на препарат у каждого пациента.
Шаг 3. Выбор режима введения препарата.
Важно не допускать избыточных интервалов между инъекциями.
Шаг 4. Переключение или комбинация.
Далее проводится оценка эффективности выбранного режима, и при необходимости режим может меняться.
Шаг 5. Долгосрочное наблюдение.
Ключевую роль на данном этапе играет мониторинг заболевания с целью определения интервала между визитами и инъекциями.
Значение мультимодальной визуализации
Для адекватного выбора тактики и реалистичной оценки динамики заболевания важна мультимодальная визуализация — то есть использование нескольких способов обследования для получения более полной картины заболевания11. Для неоваскулярной ВМД примером мультимодальной визуализации может быть сочетание офтальмоскопии (появление отека и кровоизлияний на глазном дне), оптической когерентной томографии (картина отека, элевация сетчатки в области субретинальной неоваскулярной мембраны (СНМ), «размытый» контур СНМ) и флюоресцентной ангиографии (накопление и патологическое просачивание красителя в зоне СНМ) на фоне жалоб пациента на снижение зрения, «пятно» перед глазом или метаморфопсии.
Критерии эффективности и отсутствия ответа на терапию
Мультимодальная визуализация используется и для оценки эффективности терапии.
Критерии эффективности:
-
Любое улучшение ОЗ или потеря зрения менее 5–10 букв ETDRS.
-
Уменьшение центральной толщины сетчатки.
-
Частичная или полная резорбция субретинальной жидкости.
-
Уменьшение количества интраретинальной жидкости.
-
Уменьшение высоты и протяженности отслойки ПЭС.
-
Восстановление анатомии наружных слоев сетчатки.
Критерии отсутствия ответа на терапию:
-
Потеря ОЗ более чем на 10 букв ETDRS.
-
Увеличение отека сетчатки на 100 мкм и более.
-
Увеличение объема субретинальной жидкости по данным ОКТ.
-
Новые кровоизлияния при офтальмоскопии.
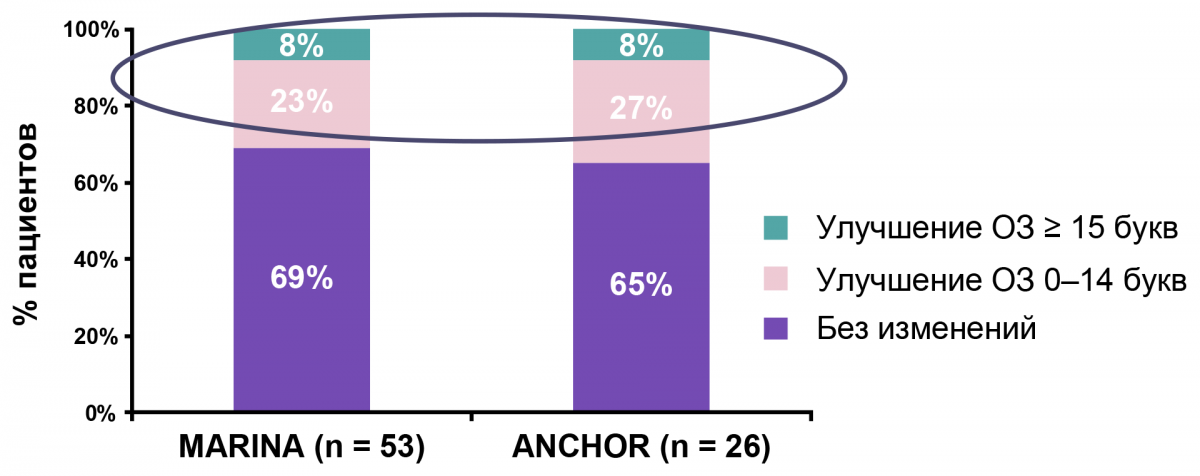
Для того, чтобы заподозрить отсутствие ответа на терапию, необходимо минимум 3 инъекции с четким следованием протоколу с 4-недельными интервалами между инъекциями (рис. 4). Так, в исследованиях ANCHOR и MARINA более чем у 30% пациентов наблюдался отсроченный ответ на ранибизумаб12. Лечение должно быть продлено до 6 месяцев, и только на этом этапе можно делать вывод об отсутствии ответа12.
Изменение ОЗ через год у пациентов с потерей ОЗ на 0–14 букв к 4-му месяцу
Примечание.
* Независимо от начального ответа на ранибизумаб необходимо продолжение мониторинга и лечения.
Рисунок 4. Частота отсроченного ответа на терапию ранибизумабом в исследованиях ANCHOR и MARINA
Что касается ДМО, критерии оценки эффективности его лечения несколько отличаются от нВМД. Улучшение зрения как критерий успешности является более постепенным процессом, и пик ОЗ может быть достигнут только после 6–9 месяцев с момента начала лечения. Рекомендуемый срок оценки ответа при ДМО — 12 месяцев терапии13.
Для принятия решения об успешности терапии и адекватной коррекции дальнейшей тактики ведения пациента необходимо соблюсти стартовый протокол и своевременно оценить динамику в зависимости от патологии, количества инъекций анти-VEGF-препарата и временного интервала между инъекциями и контрольными осмотрами.
Источники:
- Li J.Q. et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis,The British Journal of Ophthalmology, 2019:1–8.
- Kent C. Rev Ophthalmol, 2009. URL: https://www.reviewofophthalmolofy.com/article/macular-degeneration-is-laser-still-relevant (актуализация 20.12.2020).
- Wykoff C.C. et al. J Manag Care Spec Pharm, 2018;24(2-a Suppl):S3-S15.
- Mordenti J. et al. Toxicol Pathol 1999: 27:536-544.
- Ferrara N. et al. Retina 2006; 26:859-870.
- Julien S. et al. Br J Ophthalmol 2014;98:813-825.
- Holz F.G. et al. Br J Ophthalmol. 2015;99:220-226.
- Egan C. et al. The United Kingdom Diabetic Retinopathy Electronic Medical Record Users Group, Report 1: baseline characteristics and visual acuity outcomes in eyes treated with intravitreal injections of ranibizumab for diabetic macular oedema. Br J Ophthalmol 2017;101:75-80.
- Kim L.N. et al. Retina 2016;36:1418-31.
- Experts on anti-VEGF Tx for AMD: Starting, Switching, and Stopping. URL: https://www.aao.org/eyenet/article/3-experts-on-anri-vegf-tx-amd-starting-switching-s (актуализация от 20.12.2020 г.).
- Novartis E.A. et al. Multimodal Imaging in Retinal Disease: A Consensus Definition. Ophthalmic Surg Lasers Imaging. Retina. 2016;47(3):201-5.
- Androudi S. et al. Guidelines for the Management of Wet Age-Related Macular Degeneration; Recommandations from a Panel of Greek Experts. Adv Ther (2016)33:715-726.
- Chatziralli I. et al. Identification of time point to best define suboptimal response following intravitreal ranibizumab therapy for diabetic macular edema based on reallife data. Eye (2017), 1–6.
- Brown D.M. et al. Ophthalmology 2009;116:57–65; 3. Pedenet al. Ophthalmol2015;122:803-8.
- Gross J.G. et al. JAMA. 2015; 314:2137–46.
11439805/RAN/DIG/06.25/0
