Ранибизумаб является фрагментом гуманизированного антитела к эндотелиальному фактору роста сосудов А (VEGF-A) и экспрессируется рекомбинантным штаммом Escherichia coli. Он избирательно связывается с VEGF-А (VEGF110, VEGF121, VEGF165) и предотвращает его взаимодействие с рецепторами на поверхности клеток эндотелия (VEGFR1 и VEGFR2), что приводит к подавлению неоваскуляризации и пролиферации эндотелиальных клеток.
Подавляя пролиферацию эндотелиальных клеток, рост новообразованных сосудов хориоидеи и экссудацию из них, ранибизумаб останавливает прогрессирование неоваскулярной (влажной) формы возрастной макулярной дегенерации (нВМД), развитие хориоидальной неоваскуляризации (ХНВ), включая ХНВ вследствие патологической миопии, и уменьшает макулярный отек (МО) при диабетической ретинопатии (ДР) или окклюзии вен сетчатки (ОВС), сопровождающийся снижением остроты зрения (ОЗ)1.
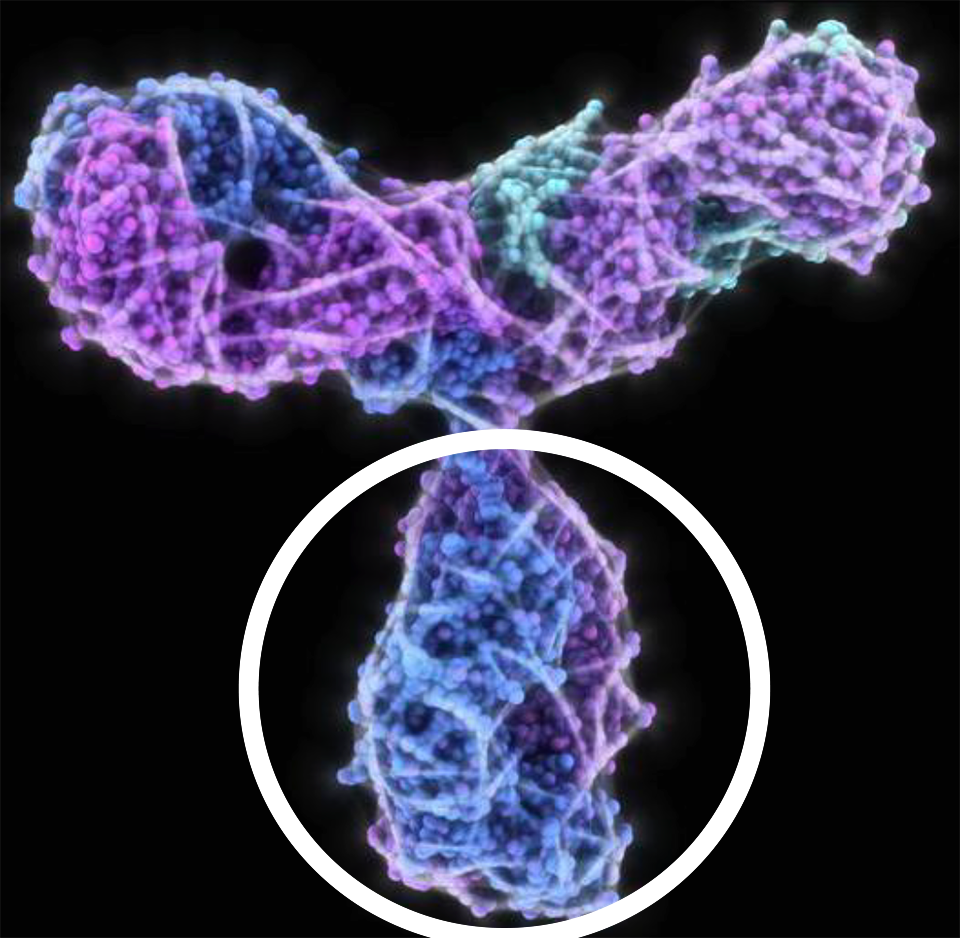
Строение молекулы и особенности ее фрагментов2,3
Ранибизумаб был специально создан для применения в офтальмологии и зарегистрирован для лечения неоваскулярной ВМД в США (FDA — Food and Drug Administration) в 2006 г. и Европе (ЕМА — European Medicines Agency) в 2007 г.
-
Препарат разработан в виде антигенсвязывающего фрагмента антитела (Fab — Fragment anligen binding) для:
-
более глубокой пенетрации через все слои сетчатки: в доклинических исследованиях выявлено, что целые антитела не проникают во все слои сетчатки;
-
во избежание риска комплемент-опосредованной или клеточной цитотоксичности, например воспаления глаз;
-
минимизации системного воздействия (сокращение периода полувыведения).
-
-
Обеспечение высокой связывающей аффинности и низкого молекулярного веса для оптимальной биологической активности:
-
5–20-кратное повышение аффинности к VEGF-A по сравнению с исходными антителами в связи с селективной мутацией в участке связывания VEGF-A.
-
Различные фрагменты антитела отвечают за разные функции:
-
Fab (antigen-binding) — антигенсвязывающий фрагмент.
-
Fc (crystallizable) — кристаллизующийся фрагмент.Fc-фрагмент может активировать систему комплемента → риск комплемент- или клеточно-опосредованного воспаления.
-
«Неонатальный» Fc-рецептор может обеспечивать попадание молекул с Fc‑фрагментом в хориоидальную циркуляцию.
Особенности ранибизумаба для применения в офтальмологии:
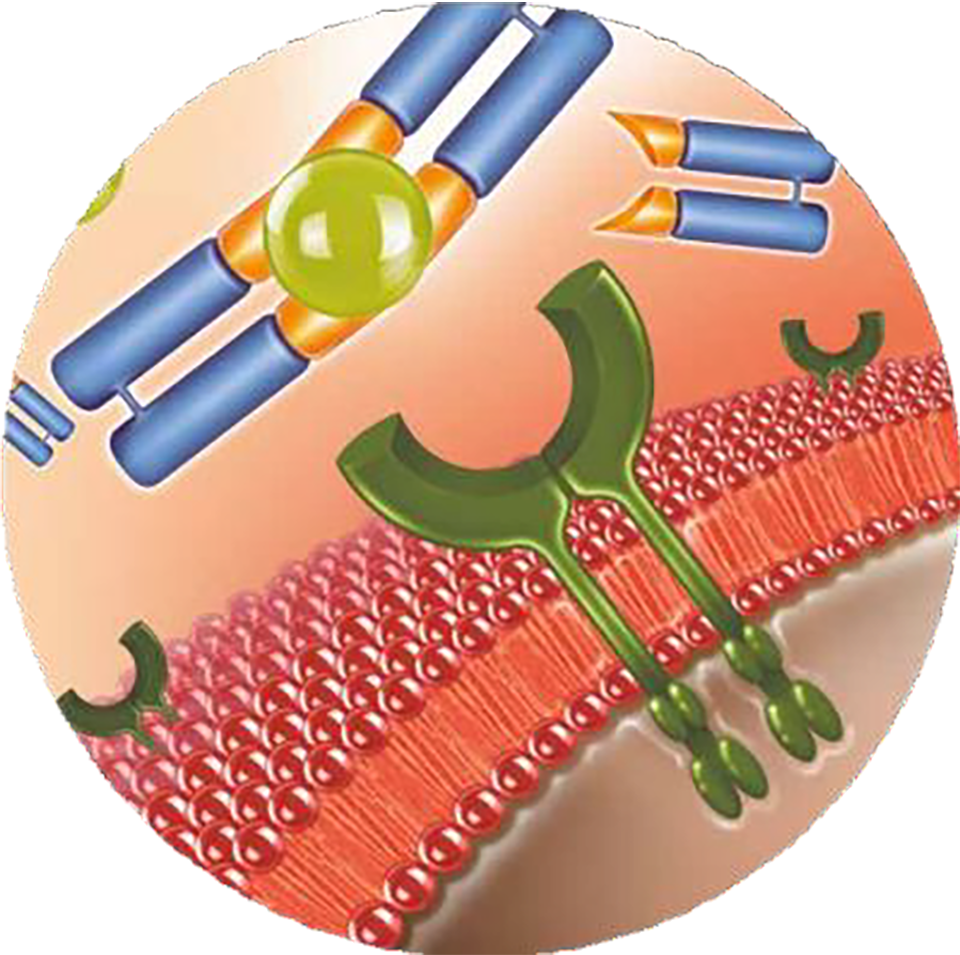
1. Высокоселективное действие1,2

2. Маленькая молекулярная масса, обеспечивающая быструю пенетрацию3,4,6
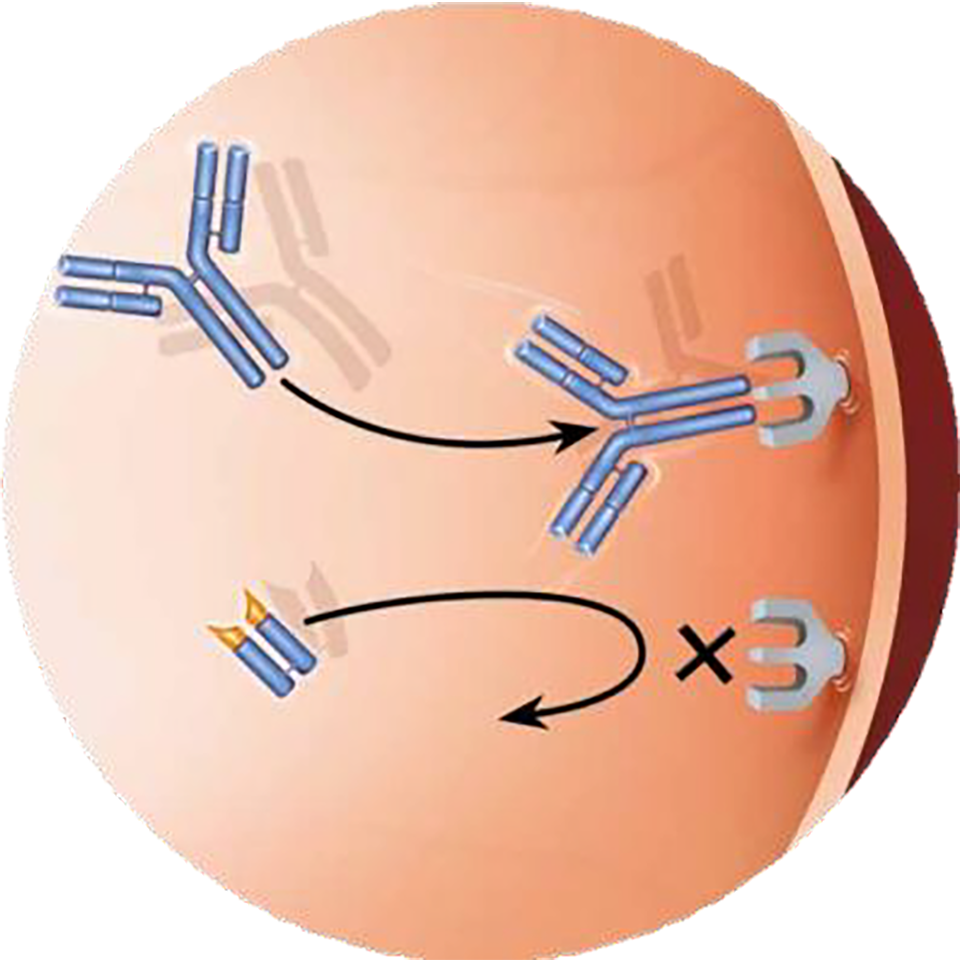
3. Минимальная системная экспозиция1,5
Ранибизумаб селективно воздействует на VEGF-A — главный регулятор процессов неоваскуляризации в глазу1,5.
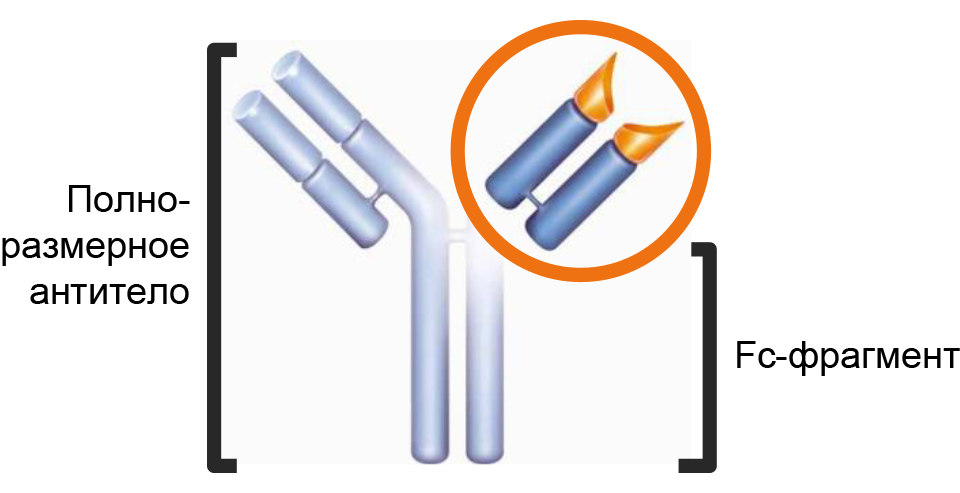
Также к особенностям можно отнести уникальный дизайн молекулы4,5:
-
небольшой размер (48 кДа)4;
-
отсутствие Fc-фрагмента4;
-
связывает все изоформы VEGF-A1,2.
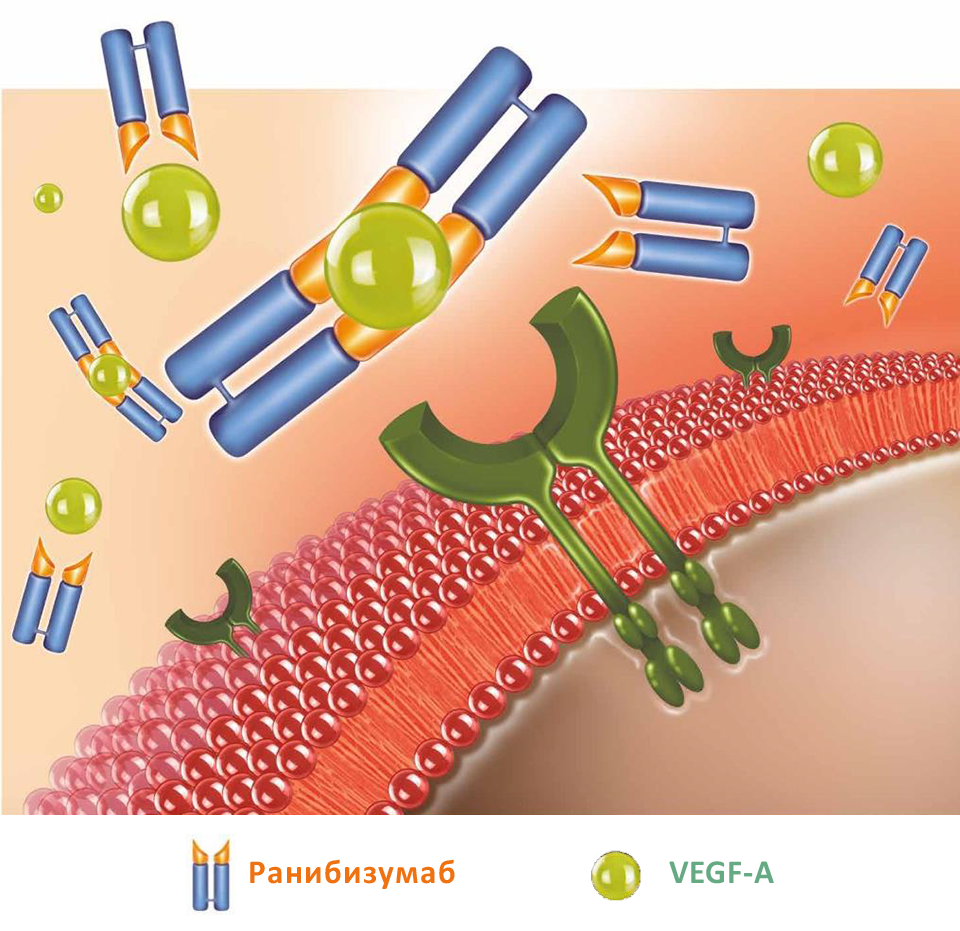
Схематическое представление молекул ранибизумаба, связывающих VEGF-A
Преимущества ранибизумаба в сравнении с афлиберцептом7
-
Проходит между клеток пигментного эпителия сетчатки (ПЭС) и не захватывается ими.
-
Таргетность — не действует на структуры, не связанные с патогенезом заболевания.
-
-
Не вызывает гибели и гипертрофии клеток ПЭС.
-
Меньше потенциал географической атрофии.
-
-
Не вызывает выраженного гемолиза.
-
Меньше/не проявляет токсического влияния.
-
Гемолиз в хориокапиллярах и в более глубоких хориоидальных сосудах, а также наличие внеклеточного гемоглобина является токсичным (может повреждать пигментный эпителий и клетки эндотелия).
-
Ранибизумаб и доказательные данные
-
Высокая эффективность и длительность, сопоставимая с другими разрешенными к применению анти-VEGF препаратами8, и результаты в реальной клинической практике.
-
7 одобренных показаний: нВМД, ДМО, ОВВС, ОЦВС, ПДР, мХНВ и другие ХНВ1.
-
Гибкий подход к выбору режима терапии1.
-
Более 5 млн пациенто-лет9.
Список источников:
- Инструкция по медицинскому применению (ИМП) лекарственного препарата Луцентис® NPI v 0.1 approved on 15-Jun-2020.
- Ferrara N et al. Retina 2006;26:859–870.
- Mordenti J et al. Toxicol Pathol 1999;27:536–544.
- Steinbrook R. N Engl J Med. 2006; 355(14):1409-1412.
- Ferrara N and Adamis AP. Nat Rev Drug Discov. 2016;15(6): 385-403.
- GaudreaultJ, et al. Retina. 2007; 27(9): 1260-1266.
- Julien S, et al. Br J Ophthalmol 2014;98:813–825.
- Schmidt-ErfurthU,etal.Ophthalmol2014;121:193-201.
- Novartis data onfile, DSUR Nov 2017.
400909/LUX/WEB/03.23/0
