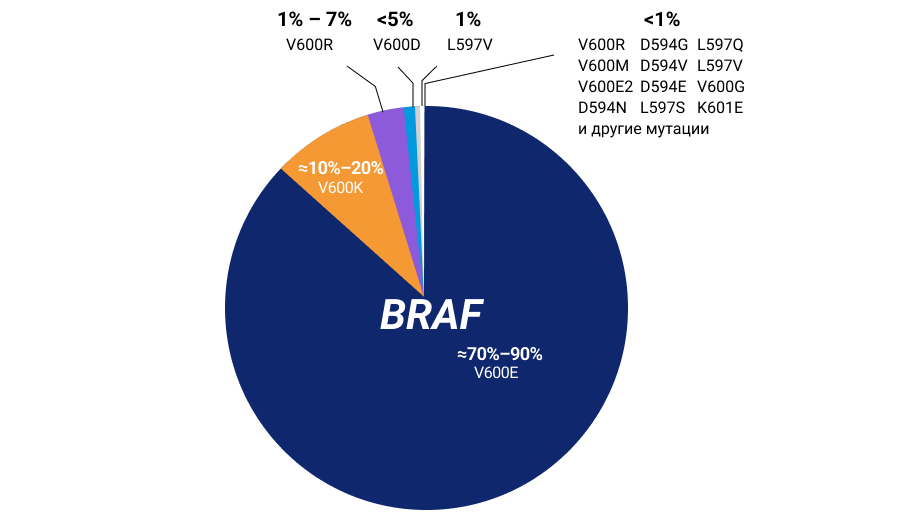
Активирующая мутация гена белка BRAF встречается примерно у 35–60% пациентов с меланомой кожи1,2,3. Большая часть мутаций BRAF относится к группе мутаций V600, в том числе от 70% до 90% приходится на мутацию V600E и еще от 10% до 20% на менее активную мутацию V600K1,3. Мутация V600R является третьей по частоте мутацией BRAF при меланоме кожи, составляя 1–7%3,4. Мутации BRAF, не связанные с V600 (неV600), обнаруживаются по данным из разных источников в 3–16% меланом4.
Рисунок 1. Частота встречаемости различных типов мутаций в гене BRAF у пациентов с меланомой кожи (адаптировано из Cheng L. et al., 20183)
Исследования эффективности таргетной терапии ингибиторами BRAF/MEK у пациентов с редкими мутациями BRAF
Наиболее часто встречающиеся мутации BRAF V600E и V600K являются основными мишенями для таргетной терапии (ТТ) ингибиторами BRAF/MEK (BRAFi/MEKi), такими как дабрафениб/траметиниб, вемурафениб/кобиметиниб и энкорафениб/биниметиниб. Приведенные дуплеты продемонстрировали значительное увеличение общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП) в исследованиях COMBI–d/v, CoBRIM и COLUMBUS1,5,6,7. В регистрационные исследования ТТ в основном были включены пациенты с мутациями BRAF V600 E/K5,6,7. Терапевтическая эффективность BRAFi/MEKi у больных меланомой с более редкими мутациями BRAF не изучалась в масштабных клинических исследованиях и может быть оценена только в единичных или сериях клинических случаев4,8.
Menzer C. et al. обобщили литературные данные по эффективности ТТ у 96 пациентов с меланомой с редкими мутациями в гене BRAF (кроме V600E/K)1. У большинства пациентов был диагноз меланомы кожи (89% среди пациентов с мутациями неV600; 81% среди пациентов с редкими подтипами мутаций V600). В анализ были включены пациенты, которые получали лечение как BRAFi и MEKi в режиме монотерапии, так и их комбинацией.
Таргетная терапия меланомы с редкими мутациями BRAF V600
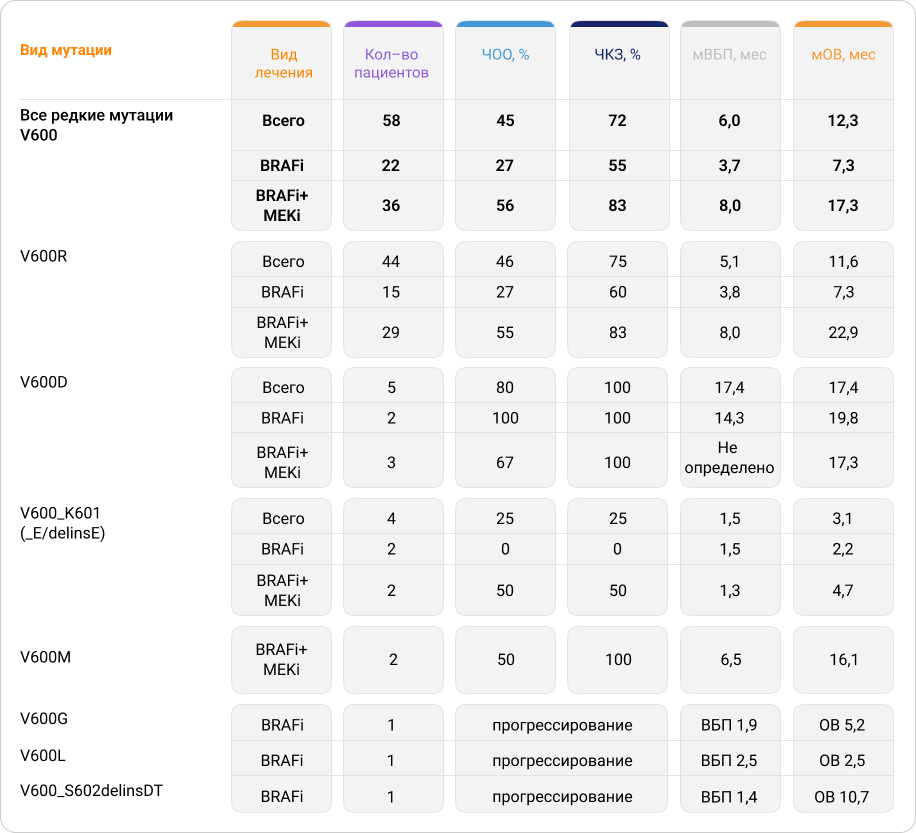
По данным Menzer C. et al.1 из 58 пациентов с редкими мутациями BRAF V600 (V600R/D/M/G/L, V600_K601 (_E/delinsE), V600_S602delinsDT) общий ответ был получен у 45% пациентов. При применении BRAFi в монорежиме и комбинации BRAFi/MEKi частота общего ответа (ЧОО) в среднем составляла 27% и 56%; частота контроля над заболеванием (ЧКЗ) — 55% и 83%; медиана выживаемости без прогрессирования (мВБП) — 3,7 и 8 месяцев; медиана общей выживаемости (мОВ) — 7,3 и 17,3 месяца соответственно. Был проведен анализ по отдельным подтипам мутаций V600. При лечении меланомы у 44 пациентов с мутацией V600R (третья по распространенности мутация в гене BRAF после V600E/K) были получены обнадеживающие результаты при использовании комбинации BRAFi/MEKi: ЧОО — 55%, ЧКЗ — 83%, мВБП — 8 месяцев, мОВ — 22,9 месяца. При применении у пациентов с этой же мутацией BRAFi в режиме монотерапии результаты были существенно хуже: ЧОО — 27%, ЧКЗ — 60%, мВБП — 3,8 месяца, мОВ — 7,3 месяца. Наибольшая эффективность монотерапии BRAFi и терапии комбинацией BRAFi/MEKi была получена у 5 пациентов с мутацией V600D: ЧОО — 100% и 67%, ЧКЗ — 100% для обоих вариантов лечения, мВБП — 14,3 месяца для монотерапии и не определена при лечении комбинацией, мОВ — 19,8 и 17,3 месяца соответственно. У пациентов с наиболее редкими подтипами мутаций (V600G/L и V600_S602delinsDT) для лечения применяли только BRAFi, и результат лечения у всех трех пациентов был оценен как прогрессирование. Малое количество пациентов в последнем случае не позволяет делать выводы о целесообразности применения ТТ BRAFi при указанных мутациях.
В целом для всех редких подтипов мутаций V600 эффективность была выше при использовании комбинации BRAFi/MEKi по сравнению с монотерапией BRAFi.
Таблица 1. Эффективность таргетной терапии BRAFi/MEKi у пациентов с меланомой кожи с редкими типами мутаций BRAF V6001
Таргетная терапия меланомы с мутациями BRAF неV600
В анализ Menzer C. et al.1 также были включены данные 38 пациентов с мутациями, неV600 (в том числе L597P/Q/R/S, K601E, G469R/S/A, A598V, 1596_1597insTAC, T599_V600insT, D594G и G593D). ЧОО у 38 пациентов составила 18%. При применении BRAFi или MEKi в режиме монотерапии и комбинации BRAFi/MEKi ЧОО составила 0%, 40% и 28%; ЧКЗ — 47%, 40% и 60%; мВБП — 1,8, 3,7 и 3,3 месяца и мОВ — 7,6, 5,9 и 11,3 месяца соответственно.
Таблица 2. Эффективность таргетной терапии BRAFi/MEKi у пациентов с меланомой кожи с редкими типами мутаций BRAF неV6001
Ключевые выводы
В клинической практике информация о подтипе мутации в гене BRAF у пациента с меланомой кожи может помочь правильно спланировать дальнейшее лечение.
Пациенты с меланомой с редкими мутациями в гене BRAF отвечают на терапию BRAFi/MEKi, хотя и менее выраженно, чем пациенты с мутацией в гене BRAF V600E/K.
Наиболее чувствительными к таргетной терапии BRAFi/MEKi оказались редкие мутации в гене BRAF V600R/D/M.
При применении комбинированной таргетной терапии ЧОО среди пациентов с редкими мутациями BRAF V600 составила 56%, неV600 – 28%.
Клинические данные по эффективности таргетной терапии BRAFi/MEKi у пациентов с редкими мутациями в гене BRAF ограничены и требуют уточнения.
Список сокращений
ВБП — выживаемость без прогрессирования
мВБП — медиана выживаемости без прогрессирования
мОВ — медиана общей выживаемости
ОВ — общая выживаемость
ТТ — таргетная терапия
ЧКЗ — частота контроля заболевания
ЧОО — частота объективного ответа
BRAFi — ингибиторы BRAF
MEKi — ингибиторы MEK
MKi — мультикиназный ингибитор
Номенклатура генных мутаций
К генным мутациям относят мутации, связанные с заменой, удалением, вставкой одного или нескольких нуклеотидов, а также с переносом, удвоением или инверсией отдельных частей гена. Генные мутации, в отличие от хромосомных и геномных мутаций, как правило, затрагивают только небольшую часть гена.
Как описать генную мутацию, чтобы не возникло путаницы, а другие исследователи точно могли понять, о каком изменении структуры кодирующей ДНК или образующегося белка идет речь?
Чтобы дать точное определение мутации на уровне ДНК, нужно указать, какие нуклеотиды и в каком положении были удалены, заменены или добавлены. При описании мутации на уровне белка нужно также указать удаленные, замененные или добавленные в результате мутации аминокислоты и их расположение (порядковый номер) в полипептидной цепи9.
Для удобства используют различные варианты сокращенных обозначений мутаций9.
При составлении краткой записи мутации на уровне изменений в структуре белка следуют следующим основным правилам9:
- Используется однобуквенный аминокислотный код.
- Указывается положение измененной в результате мутации аминокислоты в белке (порядковый номер аминокислоты в полипептидной цепи с N-конца).
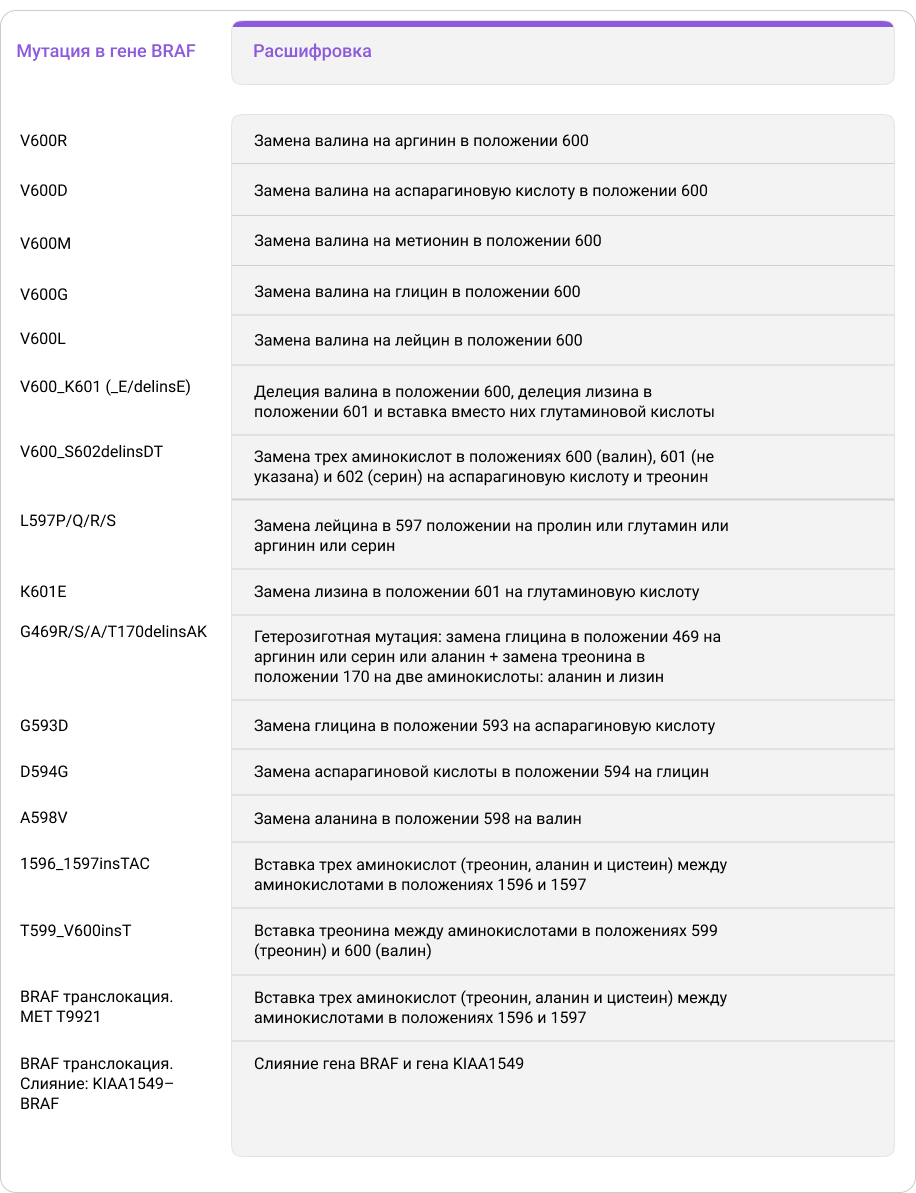
- При замене одной аминокислоты указывается ее название и положение в немутантном белке, а также аминокислота, на которую произошла замена (например, запись V600E обозначает, что в результате мутации произошла замена аминокислоты валин (V) в положении 600 на глутаминовую кислоту (E)).
- Диапазон аминокислот, измененных в результате мутации, обозначается нижним подчеркиванием (например, запись G345_E347 обозначает, что в результате мутации произошли изменения с аминокислотами в положениях 345 (глицин (G)), 346 (не указывается в краткой записи) и 347 (глутаминовая кислота (E)).
- Для обозначения удаленной аминокислоты используется обозначение del (от deletion — «удаление») (например, запись К132del обозначает, что в результате мутации произошло удаление лизина (K) в положении 132).
- Для обозначения добавленной аминокислоты используется обозначение ins (от insertion — «вставка») (например, запись Q36_G37insR обозначает, что в результате мутации произошла вставка аргинина (R) между аминокислотами глутамин (Q) и глицин (G) в 36 и 37 положениях).
- Обозначение delins используется, если необходимо описать одновременное удаление и вставку аминокислот и если эти изменения затрагивают более чем одну аминокислоту (например, запись С67delinsWV обозначает удаление цистеина (C) в 67 положении с заменой его на две аминокислоты: триптофан (W) и валин (V)).
Для описания более сложных мутаций могут использоваться дополнительные обозначения.
Таблица 3. Расшифровка обозначений мутаций, встречающихся в статье
Источники
- Menzer C. et al. Targeted therapy in advanced melanoma with rare BRAF mutations //Journal of clinical oncology: official journal of the American Society of Clinical Oncology. – 2019. – Т. 37. – №. 33. – С. 3142–3151.
- Франк Г.А., Завалишина Л.Э., Кекеева Т.В., и др. Первое Всероссийское молекулярно–эпидемиологическое исследование меланомы: результаты анализа мутаций в гене BRAF. Архив патологии. – 2014. – № 76(3). – С. 65‑73
- Cheng L. et al. Molecular testing for BRAF mutations to inform melanoma treatment decisions: a move toward precision medicine //Modern Pathology. – 2018. – Т. 31. – №. 1. – С. 24–38.
- Menzer C., Hassel J. C. Targeted therapy for melanomas without BRAF V600 mutations //Current Treatment Options in Oncology. – 2022. – Т. 23. – №. 6. – С. 831–842.
- Long G. V. et al. Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF–mutant melanoma: a multicentre, double–blind, phase 3 randomised controlled trial //The Lancet. – 2015. – Т. 386. – №. 9992. – С. 444–451.
- Larkin J. et al. Combined vemurafenib and cobimetinib in BRAF–mutated melanoma //New England Journal of Medicine. – 2014. – Т. 371. – №. 20. – С. 1867–1876.
- Dummer R. et al. Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF–mutant melanoma (COLUMBUS): a multicentre, open–label, randomised phase 3 trial //The Lancet Oncology. – 2018. – Т. 19. – №. 5. – С. 603–615.
- Choi J. S., Chandra S. Targeted Therapy for Melanomas Without BRAF V600 Mutation //Current Oncology Reports. – 2022. – С. 1–9.
- Dunnen J. T., Antonarakis S. E. Mutation nomenclature extensions and suggestions to describe complex mutations: a discussion //Human mutation. – 2000. – Т. 15. – №. 1. – С. 7–12.
11338312/ONCO/DIG/12.24/0