До недавнего времени данные об эффективности возврата к таргетной терапии (ТТ) у пациентов с прогрессирующей или нерезектабельной меланомой кожи были ограничены отдельными клиническими наблюдениями и небольшими исследованиями1—5 (самое крупное — 106 пациентов4), которые тем не менее демонстрировали достаточно высокую результативность повторного назначения ТТ: частота контроля заболевания (ЧКЗ) от 50% до 100%1—5, медиана общей выживаемости (мОВ) — до 22,2 месяца1. В 2024 г. были опубликованы результаты самого масштабного на сегодняшний день исследования в данной области. Были проанализированы данные 468 пациентов из голландского реестра меланомы, получавших повторную ТТ по поводу прогрессирующей или нерезектабельной меланомы кожи в период с 2013 по 2022 гг6. Проведенное исследование позволило получить более полные данные об эффективности возврата к ТТ у различных групп пациентов, а также дать ответ на вопрос о том, какие характеристики пациентов могут повлиять на эффективность возврата к ТТ.
Характеристика пациентов
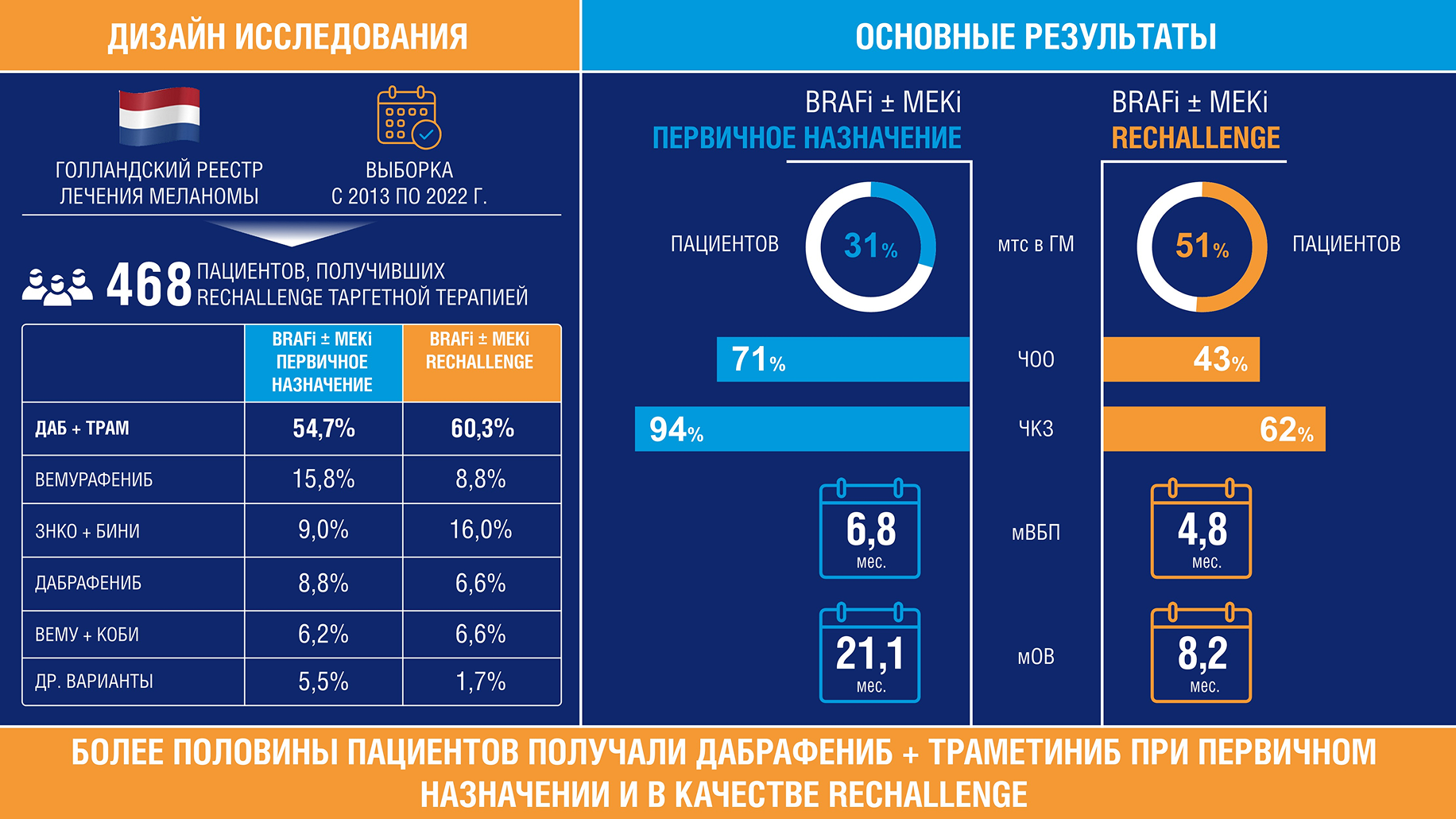
В исследовании были проанализированы данные 468 пациентов.
Пациенты получали ингибиторы BRAF (BRAFi) в виде монотерапии или в комбинации с ингибиторами MEK (MEKi) в следующих последовательностях (первичное назначение ТТ → повторное назначение ТТ)6:
- BRAFi+MEKi → BRAFi+MEKi (324 пациента);
- BRAFi → BRAFi+MEKi (65 пациентов);
- BRAFi → BRAFi (63 пациента);
- BRAFi+MEKi → BRAFi (16 пациентов).
Как при первичном, так и при повторном назначении ТТ, лечение чаще всего проводили комбинацией дабрафениб + траметиниб (54,7% и 60,3% соответственно)6.
94 пациента до первичного назначения BRAFi±MEKi получали терапию ингибиторами иммунных контрольных точек (ИКТ)6.
Интервал между первой и повторной ТТ составлял не менее 30 дней. В этот период пациентам могло быть назначено другое лечение. 357 (76,3%) пациентов получали в это время ингибиторы ИКТ6.
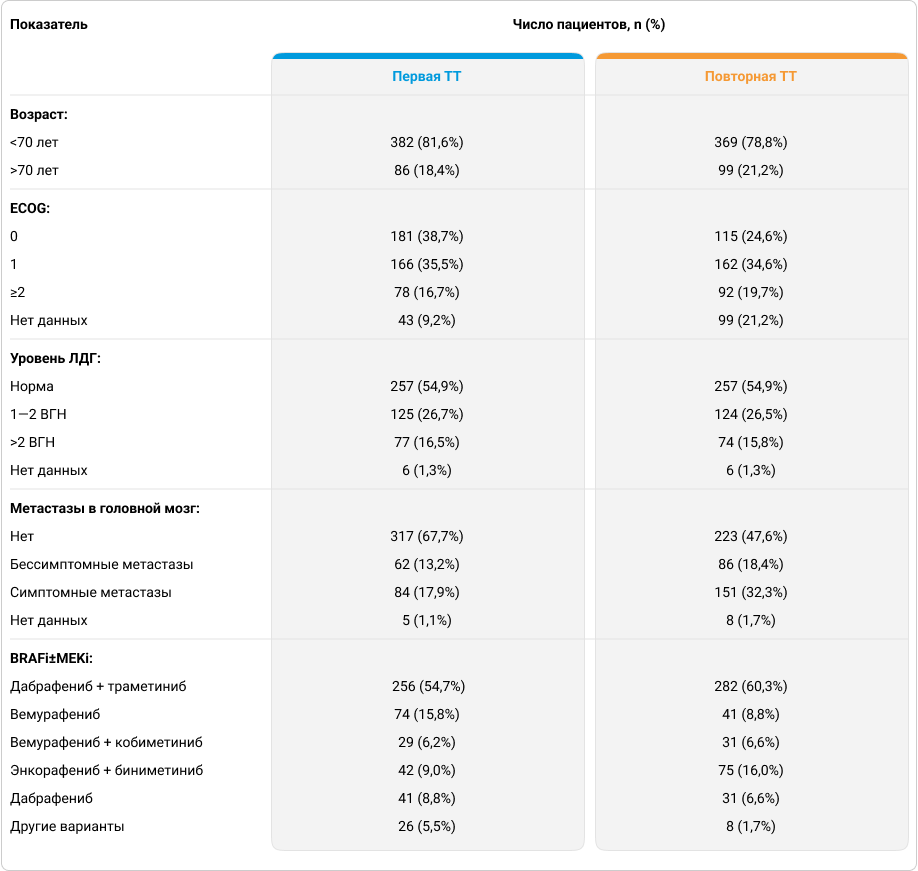
В табл. 1 приведены характеристики пациентов во время первой и повторной ТТ.
Таблица 1. Характеристика пациентов, получавших первую и повторную ТТ6.
Во время получения повторной ТТ по ряду показателей состояние пациентов было более тяжелым6:
- статус ECOG ≥2 (19,7% против 16,7% при первичном назначении ТТ);
- доля пациентов с метастазами в головной мозг (50,7% против 31,1% при первичном назначении ТТ).
Эффективность таргетной терапии
Медиана времени наблюдения с момента начала повторной ТТ составила 42,6 месяца6.
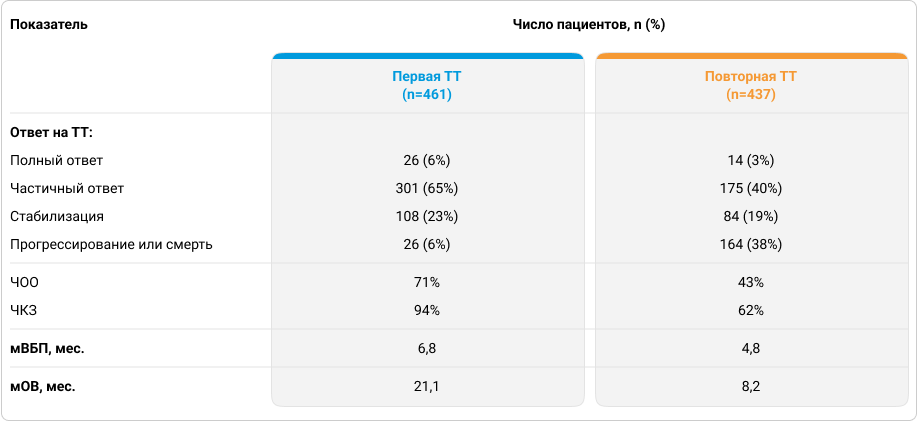
После первичного назначения ТТ у большинства пациентов был получен объективный ответ на лечение: частота объективного ответа (ЧОО) составила 71%, ЧКЗ — 94%. Эффективность возврата к ТТ также была достаточно высокой, несмотря на то что у пациентов, получающих повторную ТТ, функциональное состояние было достоверно тяжелее, а симптомные метастазы в головной мозг, значительно ухудшающие прогноз заболевания, встречались почти в два раза чаще, чем у пациентов, получающих ТТ первый раз6. ЧОО составила 43%, ЧКЗ — 62% (табл. 2)6.
Медиана выживаемости без прогрессирования (мВБП) после первичного назначения ТТ составила 6,8 месяца, а после возврата к ТТ была несколько ниже — 4,8 месяца. мОВ при первичном и повторном назначении ТТ составила 21,1 месяца и 8,2 месяца соответственно6.
Таблица 2. Эффективность первой и повторной ТТ6.
Факторы, влияющие на эффективность возврата к таргетной терапии
Авторы исследования провели анализ факторов, влияющих на эффективность возврата к ТТ, и пришли к интересным результатам.
Факторы, влияющие на ЧОО
Большинство оцененных факторов (возраст, пол, статус ECOG и другие) при возврате к ТТ не оказывали значимого влияния на показатель ЧОО (p > 0,05). Вместе с тем с более низкой вероятностью объективного ответа на повторную ТТ были связаны6:
- высокие уровни ЛДГ (>2 ВГН) (скорректированное отношение шансов 0,30; p = 0,006);
- прекращение первой ТТ в связи с прогрессированием (скорректированное отношение шансов 0,54; p = 0,029).
Факторы, влияющие на мВБП
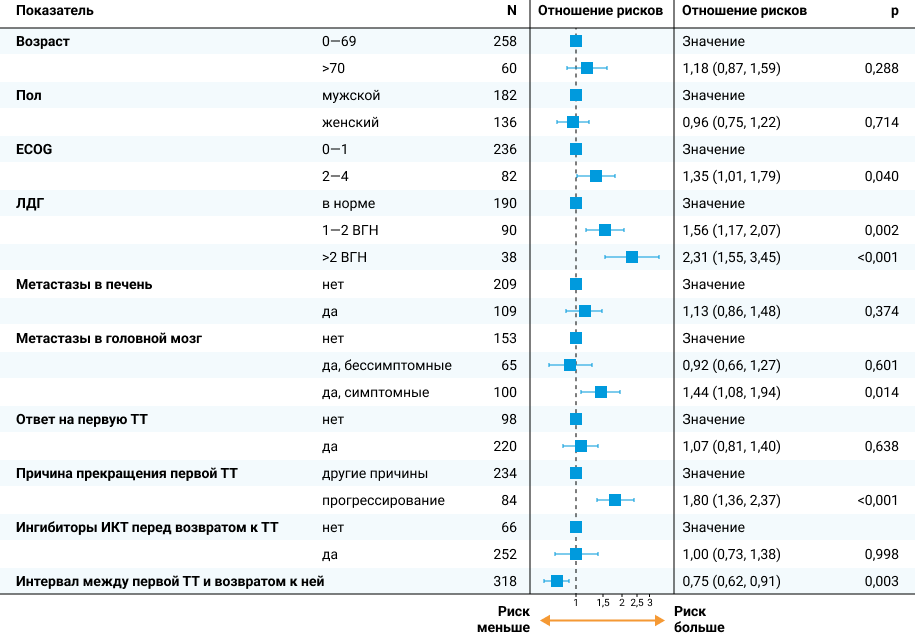
На риск прогрессирования влияло больше различных факторов (рис. 1).
Рисунок 1. Влияние различных факторов на риски прогрессирования меланомы при повторной ТТ.
Достоверно более высокий риск прогрессирования при повторном назначении ТТ был связан со следующими факторами6:
- высокие уровни ЛДГ (повышение риска прогрессирования на 56% при уровне ЛДГ 1—2 ВГН, на 131% при уровне ЛДГ >2 ВГН);
- прерывание первой ТТ по причине прогрессирования (повышение риска прогрессирования на 80%);
- симптомные метастазы в головной мозг (повышение риска прогрессирования на 44%).
На риск прогрессирования при возврате к ТТ также влиял интервал времени от первой до повторной ТТ. Чем больше был данный интервал, тем меньше был риск прогрессирования:
Интересно, что риск прогрессирования не был связан с ответом пациента на первичное назначение ТТ6. Также не было различий в рисках прогрессирования между пациентами, получавшими ингибиторы ИКТ до повторной ТТ, и теми, кто не получал ингибиторы ИКТ в этот период6.
Факторы, влияющие на мОВ
Достоверно более высокий риск смерти во время возврата к ТТ был связан с рядом факторов (рис. 2)6:
- возраст старше 70 лет (повышение риска смерти на 62%);
- ECOG ≥2 (повышение риска смерти на 49%);
- высокие уровни ЛДГ (повышение риска смерти на 87% при уровне ЛДГ 1—2 ВГН, на 168% при уровне ЛДГ >2 ВГН);
- симптомные метастазы в головной мозг (повышение риска смерти на 53%).
Рисунок 2. Влияние различных факторов на риски смерти при повторном назначении ТТ
Более длительный интервал между первой и повторной ТТ был связан с лучшей общей выживаемостью6.
Эффективность возврата к таргетной терапии у пациентов с метастазами в головной мозг
Несмотря на то что метастазы в головной мозг ухудшают прогноз течения меланомы, а также ответ меланомы на повторное назначение ТТ, эффективность возврата к ТТ у данной группы пациентов была достаточно высокая. У пациентов с метастазами в головной мозг ЧОО практически не отличалась от ЧОО в общей когорте пациентов (42% против 43%). мВБП после повторного назначения ТТ составила 4,3 месяца, а мОВ — 6,8 месяца.
Прекращение таргетной терапии по причине токсичности
Интересное наблюдение было связано с частотой прекращения ТТ по причине токсичности. Нежелательные явления послужили причиной прекращения терапии у 78 (16,7%) пациентов, получающих ТТ первый раз, и в полтора раза реже во время возврата к ТТ (у 43 (10,6%) пациентов). Токсичность ≥3 степени также чаще встречалась во время первой ТТ по сравнению с повторной ТТ (21,2% против 10,9%; p <0,001). Возможное объяснение связано с тем, что пациенты, плохо переносившие первую ТТ, могли получать скорректированную дозу BRAFi/MEKi при возврате к лечению6.
Выводы
- Опубликованы результаты голландского исследования эффективности возврата к ТТ в самой крупной на сегодняшний день когорте пациентов с метастатической и нерезектабельной меланомой (468 пациентов)6.
- Как при первичном, так и при повторном проведении ТТ пациентам чаще всего назначали комбинацию дабрафениб + траметиниб (54,7% и 60,3% соответственно)6.
- Несмотря на то что половина пациентов на момент повторной ТТ имела тяжелое функциональное состояние (ECOG ≥1—54,3%) и метастазы в головной мозг (50,7%), эффективность возврата к ТТ оказалась клинически значимой: ЧОО — 43%, ЧКЗ — 62%, мВБП — 4,6 месяца, мОВ — 8,2 месяца6.
- Более длительный интервал между первой ТТ и возвратом к ней был связан с лучшей выживаемостью во время повторной ТТ6.
- У пациентов с неблагоприятным прогнозом (симптомные метастазы в головной мозг, повышенный уровень ЛДГ, прерывание первой ТТ по причине прогрессирования, ECOG ≥2, возраст старше 70 лет) риск прогрессирования был выше. Однако даже в этой подгруппе сохранялась клиническая эффективность повторной терапии.
- У пациентов с метастазами в головной мозг ЧОО составила 42%, мВБП — 4,3 месяца, мОВ — 6,8 месяца.
- Ответ на первую ТТ, а также назначение ингибиторов ИКТ до повторной ТТ не влияли на ответ или выживаемость во время возврата к ТТ6.
Список сокращений
- ВГН — верхняя граница нормы;
- ИКТ — иммунные контрольные точки;
- ЛДГ — лактатдегидрогеназа;
- мВБП — медиана выживаемости без прогрессирования;
- мОВ — медиана общей выживаемости;
- ТТ — таргетная терапия;
- ЧКЗ — частота контроля заболевания;
- ЧОО — частота объективного ответа;
- BRAFi — ингибиторы BRAF;
- MEKi — ингибиторы MEK.
Список литературы
- Ayala de Miguel P. et al. Retreatment and rechallenge with BRAF/MEK inhibitors in patients with metastatic melanoma: Results from the observational study GEM1801 (ASCO 2023). – 2023. – С. 9547.
- Schreuer M. et al. Combination of dabrafenib plus trametinib for BRAF and MEK inhibitor pretreated patients with advanced BRAFV600–mutant melanoma: an open–label, single arm, dual–centre, phase 2 clinical trial //The Lancet Oncology. – 2017. – Т. 18. – №. 4. – С. 464–472.
- Rogiers A., Wolter P., Bechter O. Dabrafenib plus trametinib rechallenge in four melanoma patients who previously progressed on this combination //Melanoma research. – 2017. – Т. 27. – №. 2. – С. 164–167.
- Valpione S. et al. Rechallenge with BRAF–directed treatment in metastatic melanoma: A multi–institutional retrospective study //European Journal of Cancer. – 2018. – Т. 91. – С. 116–124.
- Tietze J. K. et al. The efficacy of re–challenge with BRAF inhibitors after previous progression to BRAF inhibitors in melanoma: A retrospective multicenter study //Oncotarget. – 2018. – Т. 9. – №. 76. – С. 34336.
- Van Not O. J. et al. BRAF/MEK inhibitor rechallenge in advanced melanoma patients //Cancer. – 2024. – Т. 130. – №. 9. – С. 1673-1683.
11456512/ONCO/DIG/06.25/0