Стимуляторы рецепторов тромбопоэтина (ТПО-миметики, агонисты рецептора ТПО)
| Револейд (элтромбопаг), Новартис1 | Энплейт (ромиплостим), Амджен2 | |
| Форма выпуска | Таблетки 25 и 50 мг | Лиофилизат для приготовления раствора для инъекций 250 и 500 мкг |
| Молекула | Не пептидная, низкая молекулярная масса | Пептидная, высокая молекулярная масса |
| Способ введения | Внутрь 1 раз в день | Подкожные инъекции 1 раз в неделю |
| Показания |
|
|
Примечание.
ИТП — идиопатическая тромбоцитопеническая пурпура; ТАА — тяжелая апластическая анемия; ГКС — глюкокортикостероиды.
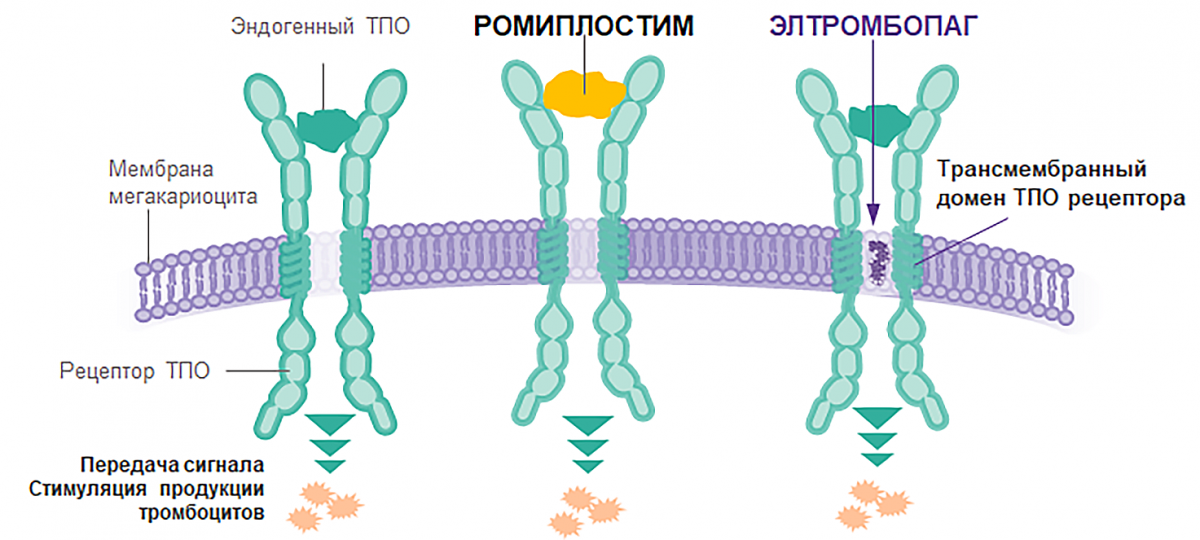
Механизм действия ТПО-миметиков
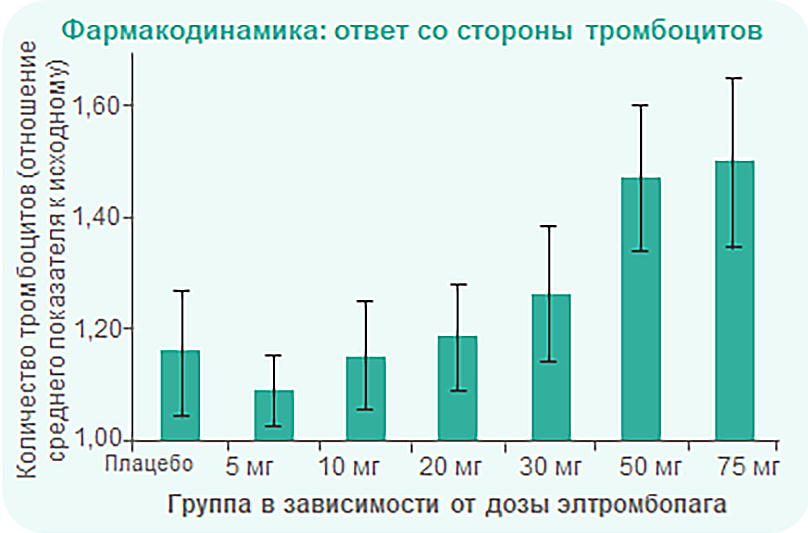
Эффект элтромбопага является дозозависимым и достигает пика к 15 дню лечения
-
Однократный прием элтромбопага не приводил к увеличению числа тромбоцитов.
-
Дозозависимое увеличение уровня тромбоцитов наблюдалось при повторном приеме ≥ 30 мг препарата.
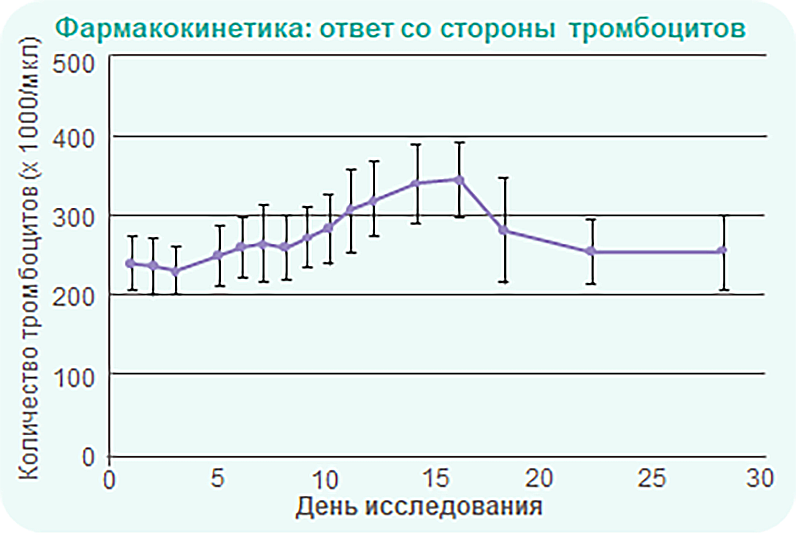
-
Количество тромбоцитов начинало увеличиваться через 5 дней приема и достигало пика к 15‑му дню.
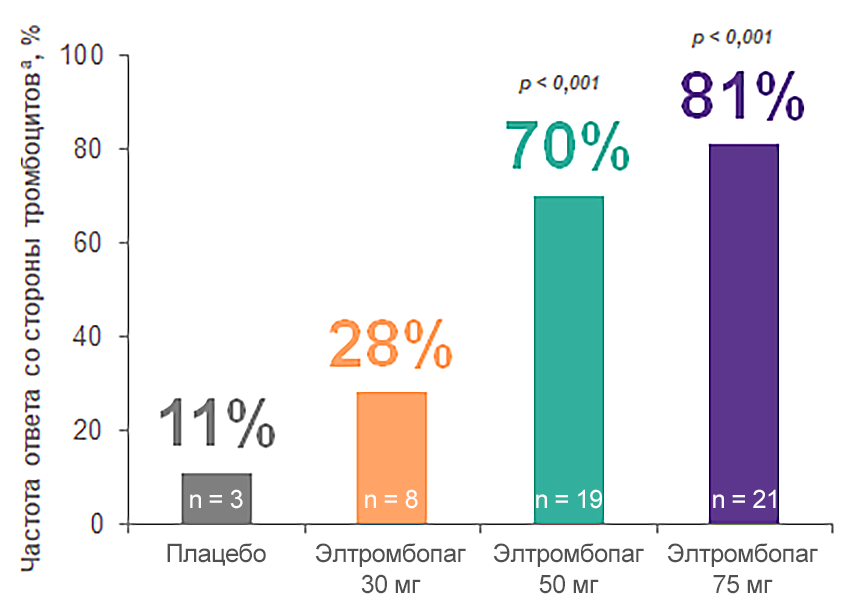
Эффективность и безопасность применения элтромбопага при ИТП у взрослых изучались в многочисленных клинических исследованиях
| Исследование | N пациентов: элтромбопаг/общее количество | Описание | Доза элтромбопага | Основная конечная точка |
| TRA100773A NCT001027399 | 88/117 | Рандомизированное двойное слепое плацебо-контролируемое исследование II фазы по подбору дозы длительностью 6 недель | 30, 50 или 75 мг в сутки | Увеличение количества тромбоцитов ≥ 50 × 109/л |
| TRA100773B NCT0010273910 | 76/114 | Рандомизированное двойное слепое плацебо-контролируемое исследование III фазы длительностью 6 недель | Начальная доза 50 мг в сутки с последующей коррекцией при необходимости | Увеличение количества тромбоцитов ≥ 50 × 109/л |
| RAISE NCT0037033111 | 135/197 | Рандомизированное двойное слепое плацебо-контролируемое исследование III фазы длительностью 6 месяцев | Начальная доза 50 мг в сутки с последующей коррекцией при необходимости | Вероятность достижения количества тромбоцитов 50–400 × 109/л |
| REPEAT NCT0042417712 | 66/66 | Открытое исследование II фазы по изучению применения многократных доз длительностью 6 недель | Начальная доза 50 мг в сутки | Устойчивость ответа |
| EXTEND NCT0035146813,14 | 302/302 | Открытое расширенное исследование III фазы с участием пациентов из предыдущих исследований применения элтромбопага при ИТП у взрослых | Начальная доза 50 мг в сутки с последующей коррекцией при необходимости | Долгосрочная безопасность и эффективность |
| Исследование костного мозга NCT0109848715 | 167/167 | Открытое исследование IV фазы по оценке безопасности у взрослых пациентов с хронической ИТП длительностью 2 года | Начальная доза 50 мг в сутки с последующей коррекцией при необходимости | Изменение выраженности фиброза костного мозга спустя 1 и 2 года лечения |
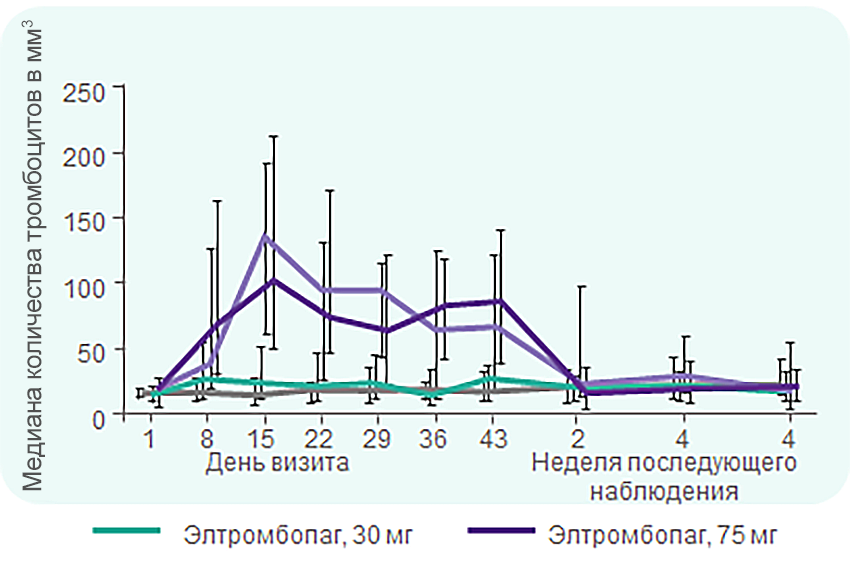
TRA100773A: кратковременная терапия элтромбопагом в дозе 50–75 мг эффективна у большинства взрослых с рецидивирующей или рефрактерной ИТП
-
К 15-му дню vs день 8 наблюдалось увеличение доли пациентов с количеством тромбоцитов ≥ 50 × 109/л:
-
с 44% до 88% в группе применения элтромбопага в дозе 50 мг;
-
с 62% до 81% в группе применения элтромбопага в дозе 75 мг.
-
-
У пациентов, получавших элтромбопаг в дозе 50 мг или 75 мг, частота развития кровотечений снижалась по мере увеличения количества тромбоцитов.
-
В течение 6 недель последующего наблюдения частота развития кровотечений постепенно вернулась к исходному уровню соответственно снижению количества тромбоцитов до уровня, близкого к исходному.
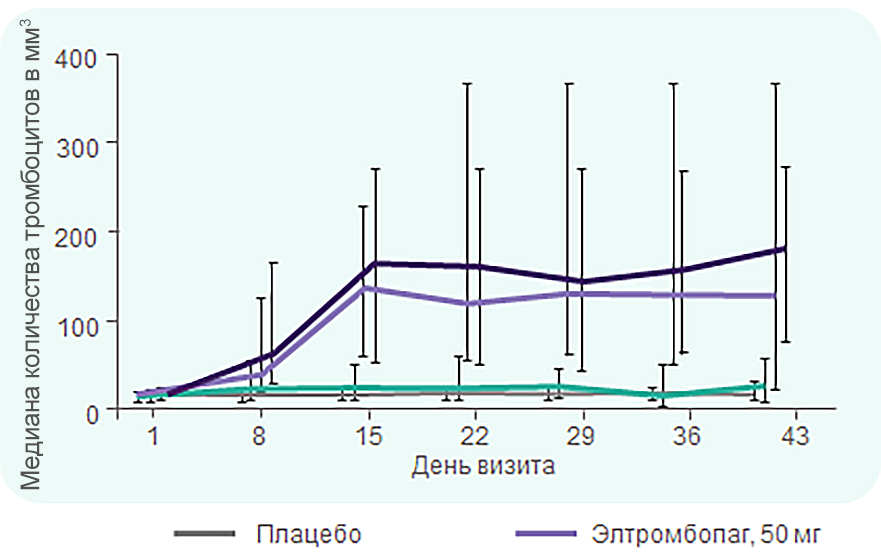
TRA100773A: медиана количества тромбоцитов достигает нормального диапазона через 2 недели лечения элтромбопагом в дозе 50 и 75 мг
-
В группах применения элтромбопага в дозе 50 мг и 75 мг медиана количества тромбоцитов* достигла нормального диапазона (150–400 × 109/л) к 15-му дню и оставалась на таком уровне до 43-го дня.
-
Медиана количества тромбоцитов в группе последующего наблюдения оставалась на уровне ≥ 50 × 109/л в течение всего периода лечения и вернулась на уровень, близкий к исходному, в течение 2 недель после прекращения лечения.
Примечание.
* 25-й и 75-й процентили показаны столбцами «I».
** Пациенты, прекратившие лечение раньше 43-го дня, были включены в группу последующего наблюдения.
TRA100773A: частота и тяжесть нежелательных явлений при применении элтромбопага сопоставимы с плацебо
| Явление, n (%) | Плацебо n = 29 | Элтромбопаг 30 мг n = 30 | Элтромбопаг 50 мг n = 30 | Элтромбопаг 75 мг n = 28 |
| Общее количество пациентов, у которых зарегистрировано ≥ 1 НЯ во время терапии | 17 (59) | 14 (47) | 14 (47) | 17 (61) |
| Общее количество НЯ 3-й или 4-й степени* | 4 (14) | 2 (7) | 4 (13) | 3 (1) |
| Головная боль | 6 (21) | 4 (13) | 3 (10) | 6 (21) |
| Повышение уровня аспартатаминотрансферазы | — | 1 (3) | — | 2 (7) |
| Запор | 2 (7) | 1 (3) | — | 2 (7) |
| Утомляемость | 5 (17) | — | 1 (3) | 2 (7) |
| Сыпь | 1 (3) | 1 (3) | — | 2 (7) |
| Анемия | 2 (7) | 1 (3) | 1 (3) | 1 (4) |
| Диарея | 2 (7) | — | — | 1 (4) |
| Периферический отек | 2 (7) | — | 1 (3) | 1 (4) |
| Нарушение вкусовых ощущений | 2 (7) | — | — | 1 (4) |
| Вздутие живота | 2 (7) | 1 (3) | — | — |
| Артралгия | 3 (10) | 1 (3) | — | — |
| Носовое кровотечение | — | 4 (13) | — | — |
| Геморрой | 2 (7) | — | — | — |
| Боль в конечности | 1 (3) | 2 (7) | — | — |
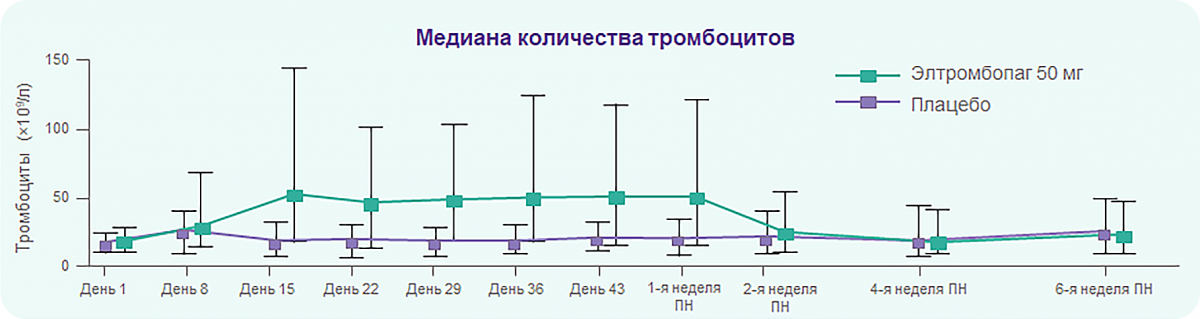
TRA100773B: Элтромбопаг в дозе 50 мг эффективен у пациентов с хронической ИТП
-
У пациентов, принимавших элтромбопаг, к 15-му дню медиана количества тромбоцитов увеличилась до 53 × 109/л, и сохранялась в течение 6 недель.
-
К 43-му дню медиана количества тромбоцитов у пациентов, ответивших на терапию элтромбопагом (n = 43), составила 144 × 109/л (МКР: 92,5–268).
-
Медиана количества тромбоцитов вернулась к исходной в течение 2 недель после окончания терапии.
Примечание.
Планки погрешностей: 95% доверительные интервалы.
ПН — период наблюдения.
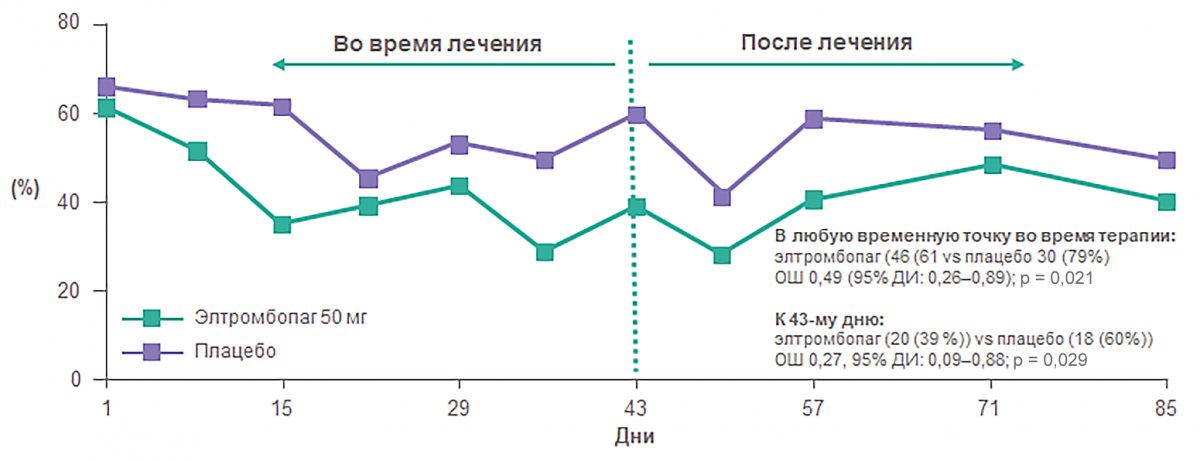
TRA100773B: Элтромбопаг достоверно уменьшает частоту кровотечений
-
В группе применения элтромбопага наблюдалось статистически значимо меньше кровотечений по сравнению с группой плацебо к 43-му дню и в любой временной точке за 6 недель терапии.
Пациенты с любым кровотечением*
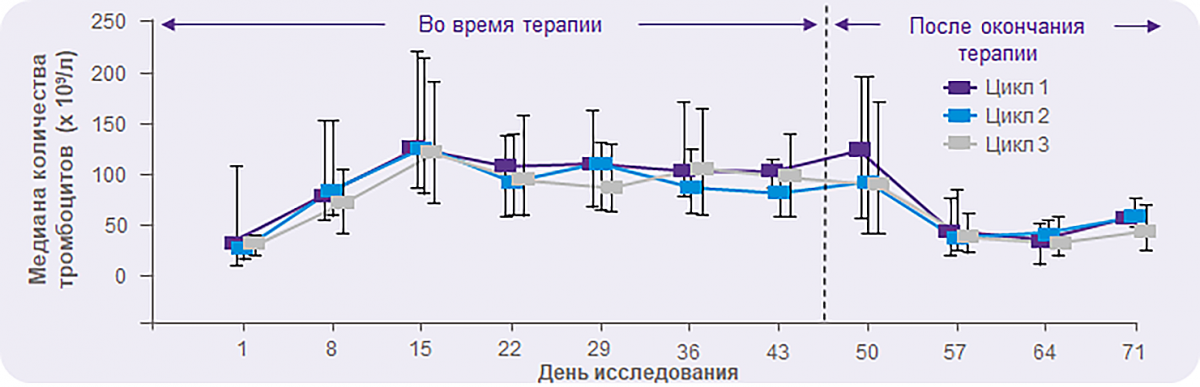
REPEAT: Применение элтромбопага может быть эффективным у пациентов с хронической ИТП в непостоянном режиме
Повторное назначение элтромбопага после перерыва позволяло достичь сходных показателей ответа, который сохранялся в течение всего периода терапии в каждом цикле:
-
> 50% и > 75% пациентов ответили на лечение к 8-му и 15-му дню терапии соответственно;
-
количество тромбоцитов оставалось на уровне ≥ 79 × 109/л вплоть до окончания терапии во всех 3 циклах;
-
уровень тромбоцитов оставался неизменным течение 1 недели после окончания каждого из 3 циклов и возвращался к исходному ко 2-й неделе.
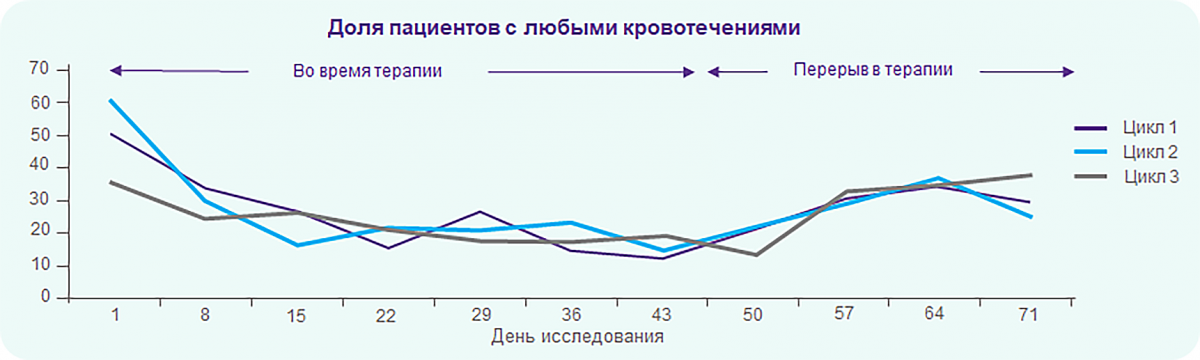
REPEAT: Элтромбопаг эффективно снижает частоту кровотечений при применении в непостоянном режиме
-
Частота развития всех кровотечений и клинически значимых кровотечений* снижалась примерно на 50% в каждом цикле терапии.
-
Ни один из пациентов не получал препаратов неотложной терапии во время приема элтромбопага ни во время циклов 1–3, ни в перерывах между ними.
Примечание.
* Все кровотечения (1–4 степени) и клинически значимые кровотечения (2–4 степени).
REPEAT: Применение элтромбопага в непостоянном режиме обладает приемлемым уровнем безопасности
Нежелательные явления в каждом цикле
| Сводные данные о НЯ n (%) | Цикл 1 | Цикл 2 | Цикл 3 | Цикл 4 | ||||
| Во время терапии n = 66 | В перерыве n = 65 | Во время терапии n = 55 | В перерыве n = 55 | Во время терапии n = 51 | В перерыве n = 51 | Во время терапии n = 66 | В перерыве n = 65 | |
| Любое НЯ | 29 (44) | 25 (38) | 23 (42) | 19 (35) | 25 (49) | 23 (45) | 45 (68) | 41 (63) |
| Любое СНЯ | 0 | 0 | 1 (2) | 2 (4) | 0 | 1 (2) | 1 (2) | 3 (5) |
| НЯ, связанные с исследуемым препаратом | 12 (18) | 2 (3) | 8 (15) | 1 (2) | 4 (8) | 0 | 15 (23) | 2 (3) |
| НЯ, приведшие к прекращению лечения | 1 (2) | 0 | 0 | 0 | 0 | 0 | 1 (2) | 0 |
-
Частота НЯ, возникших во время терапии (196 явлений у 45 (68%) пациентов), была такой же, как и во время перерывов (122 явления у 41 (63%) пациента).
-
Самыми частыми НЯ, возникшими во время терапии, были головная боль (21%), диарея (11%), слабость (9%) и назофарингит (9%).
-
Во время всех 3 циклов головная боль и диарея регистрировались на 13% и 5% чаще во время терапии, чем в перерывах в терапии.
-
-
В большинстве случаев НЯ были легкой и средней степени тяжести.
-
У 4 пациентов отмечено 1 и более НЯ 3-й степени тяжести:
-
3-й цикл, во время терапии: одышка, кашель и заложенность пазух (n = 1); гипергликемия (n = 1).
-
Перерыв: СНЯ в виде кровотечения из уха, носового кровотечения, кровотечения из слизистой полости рта (n = 1) и гипертензия (n = 1).
-
-
Во время терапии не было зарегистрировано НЯ 4-й степени тяжести или смертельных исходов.
-
НЯ, связанные с терапией, регистрировались чаще во время терапии по сравнению с перерывами во всех трех циклах (23% и 3% соответственно).
Примечание.
НЯ — нежелательное явление; СНЯ — серьезное нежелательное явление.
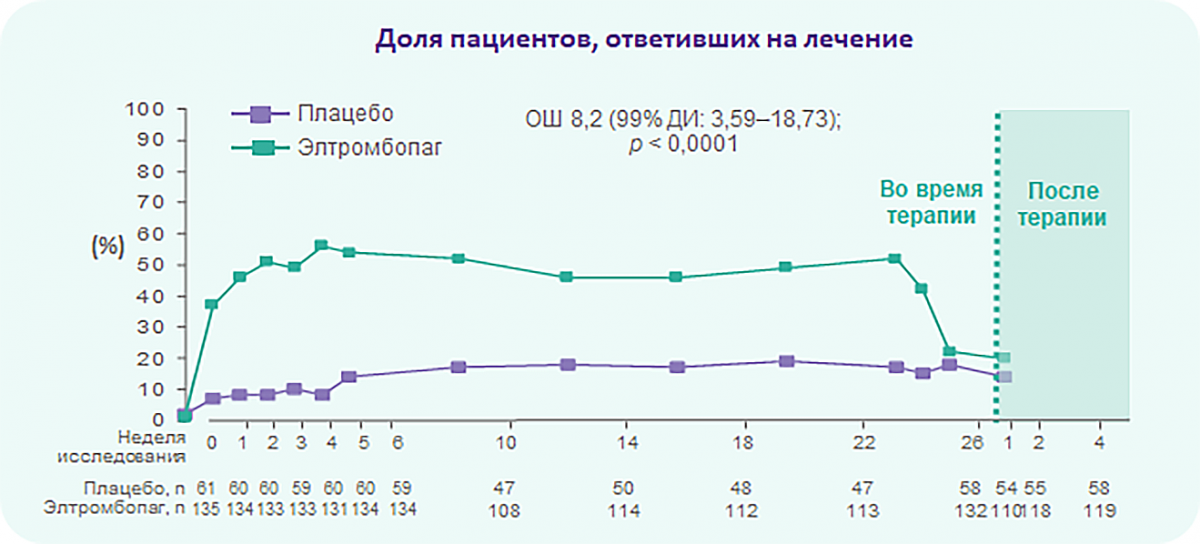
RAISE: Большинство пациентов отвечают на терапию элтромбопагом
-
Доля пациентов, ответивших на терапию как минимум один раз за 6 месяцев, была достоверно выше в группе применения элтромбопага (106/79%) vs плацебо (17/28%).
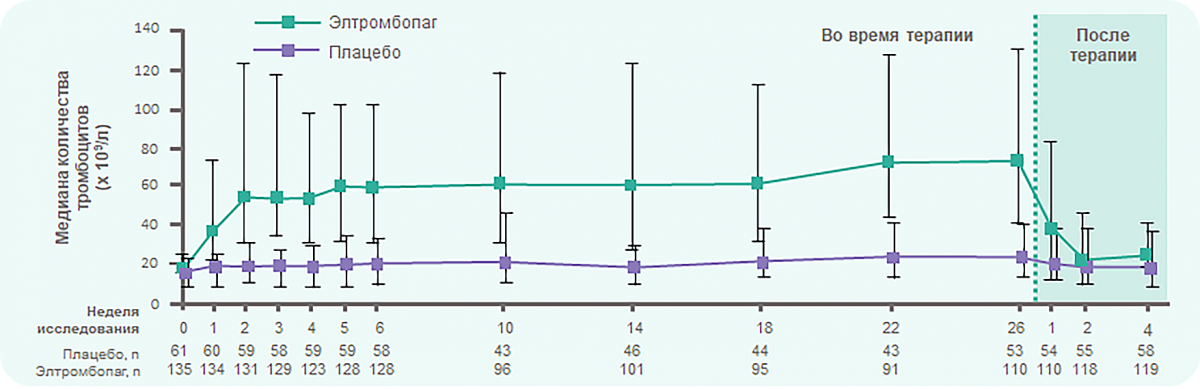
RAISE: Элтромбопаг ОБЕСПЕЧИВАЕТ ТРОМБОЦИТАРНЫЙ ОТВЕТ уже на 1 неделе лечения
-
В группе, принимавшей элтромбопаг, медиана количества тромбоцитов выросла с 16 × 109/л до 36 × 109/л через 1 неделю терапии и сохранялась на уровне > 50 × 109/л в течение всего оставшегося времени лечения.
-
В группе, принимавшей плацебо, количество тромбоцитов не поднималось выше 23 × 109/л в течение всего времени лечения.
RAISE: Эффективность элтромбопага не зависит от наличия спленэктомии в анамнезе
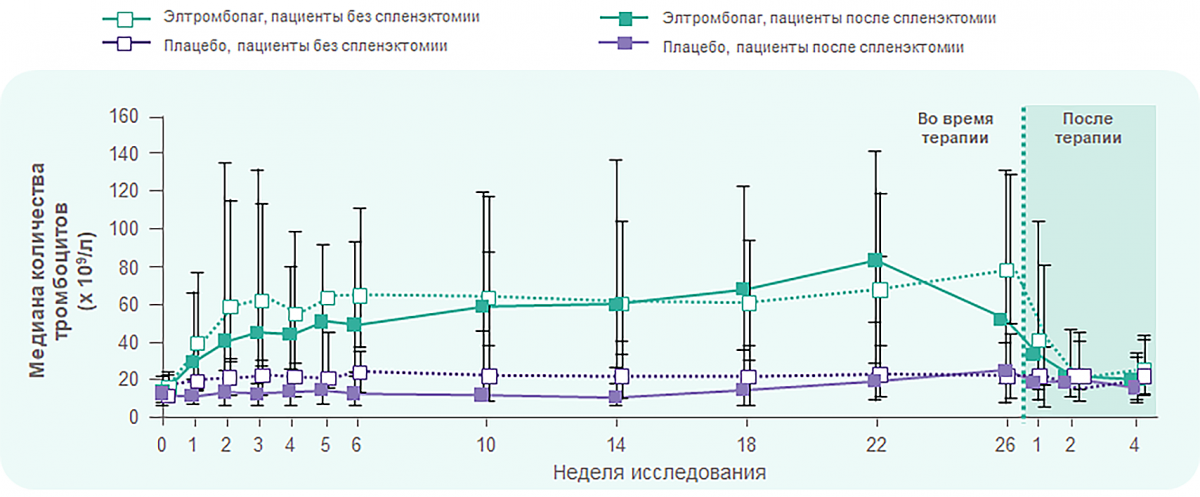
Элтромбопаг уменьшает кровотечения и снижает потребность в глюкокортикостероидах
-
Х ~ 2 раза
сокращение частоты кровотечений и клинически значимых кровотечений по сравнению с контролем начиная с 15 дня лечения и в течение 6-месячного курса терапии элтромбопагом. -
59 %
пациентов уменьшили дозу или полностью прекратили прием ≥ 1 препарата для лечения ИТП к 6 месяцу (vs 32% в группе контроля). -
84 %
из них уменьшили или прекратили прием глюкокортикостероидов
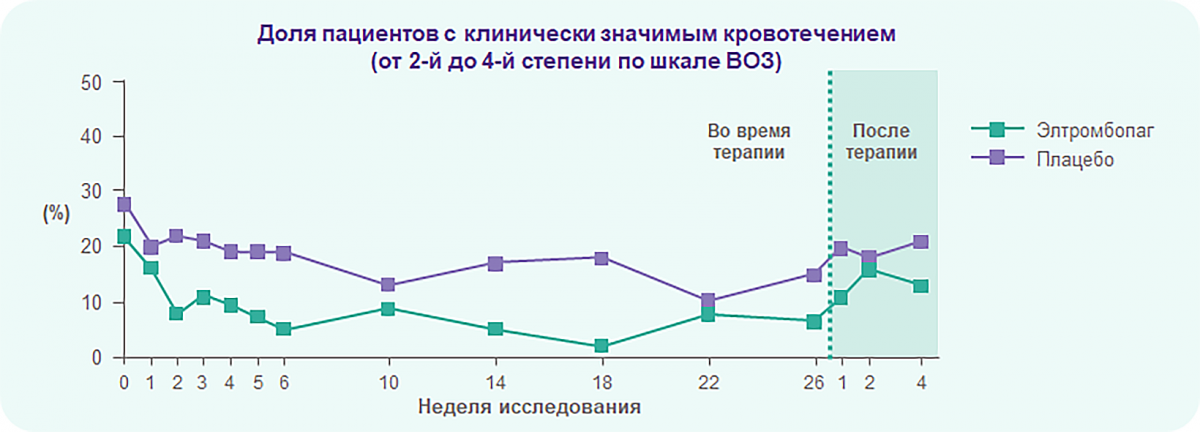
RAISE: Элтромбопаг достоверно снижает риск кровотечений у пациентов с хронической ИТП
-
За 6 месяцев терапии риск развития кровотечений и клинически значимых кровотечений на фоне приема элтромбопага снизился на 76% и 65% соответственно по сравнению с плацебо (ОШ 0,24; 95% ДИ: 0,16−0,38; p < 0,0001 и ОШ 0,35; 95% ДИ: 0,19−0,64; p = 0,0008).
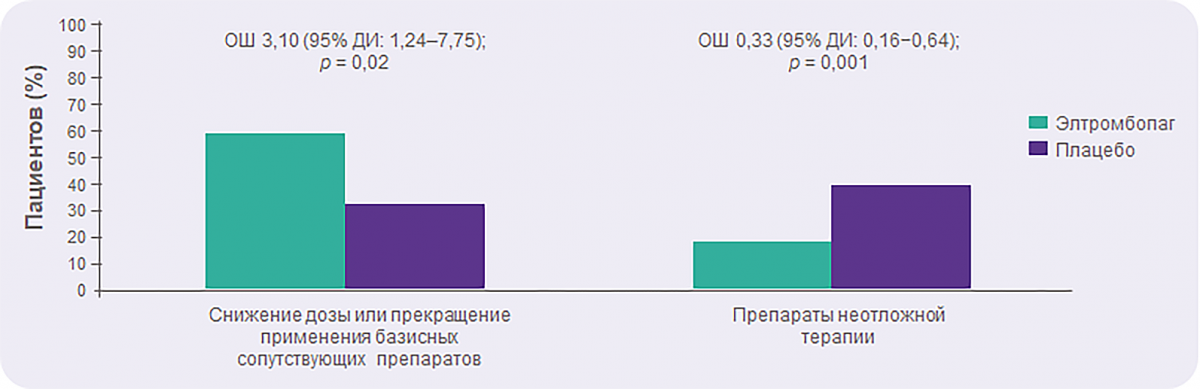
RAISE: Элтромбопаг позволяет снизить необходимость в сопутствующей или неотложной терапии
-
Из сопутствующих препаратов чаще всего снижали дозу или отменяли кортикостероиды (84% из 37 пациентов, принимавших элтромбопаг, и 90% из 10 пациентов, принимавших плацебо).
-
Чаще всего в качестве препаратов неотложной терапии применяли кортикостероиды (n = 15 в группе плацебо; n = 14 в группе элтромбопага).
RAISE: Элтромбопаг обладает приемлемым уровнем безопасности
Нежелательные явления у ≥ 10% пациентов
| НЯ, n (%) | Плацебо n = 61 | Элтромбопаг n = 135 |
| Любые НЯ независимо от причин | 56 (92) | 118 (87) |
| Головная боль | 20 (33) | 41 (30) |
| Диарея | 6 (10) | 17 (13) |
| Тошнота | 4 (7) | 16 (12) |
| Назофарингит | 8 (13) | 14 (10) |
| Инфекции верхних дыхательных путей | 7 (11) | 14 (10) |
| Утомляемость | 8 (13) | 13 (10) |
| Боль в конечностях | 6 (10) | 9 (7) |
| Носовое кровотечение | 6 (10) | 7 (5) |
| Головокружение | 6 (10) | 5 (4) |
| Периферический отек | 6 (10) | 2 (3) |
| Все нежелательные явления 3-й или 4-й степени тяжести | 7 (11) | 20 (15) |
| НЯ связанные с кровотечениями | 4 (7)a | 3 (2) |
| Смертельные исходы | 1 (2)b | 0 |
Примечание.
a — у 4 пациентов зарегистрировано 11 эпизодов кровотечения; b — пациент умер из-за смертельного кровоизлияния в ствол головного мозга.
Нежелательные явления со стороны печени и желчевыводящих путей:
-
Повышение АЛТ ≥ 3 × ВГН: 9 в группе применения элтромбопага (7%) vs 2 в группе плацебо (3%).
-
Увеличение уровня общего билирубина > 1,5 × ВГН: 5 (4%) пациентов в группе применения элтромбопага и ни одного пациента в группе плацебо.
-
По одному пациенту в группе применения элтромбопага и плацебо были выведены из исследования вследствие повышения АЛТ (≥ 3-й степени).
Случаи тромбоэмболии:
-
2 во время терапии (1,5%):
-
тромбоэмболия легочной артерии (4-й степени);
-
тромбоз глубоких вен (3-й степени).
-
-
1 после терапии (< 1%)
-
тромбоэмболия легочной артерии (4-й степени).
-
Примечание.
ВГН — верхняя граница нормы.
Элтромбопаг статистически значимо улучшает показатели как физического, так и психического здоровья
-
Улучшения качества жизни, связанного со здоровьем, были статистически значимо связаны не только с увеличением количества тромбоцитов (р от 0,034 до < 0,001 в зависимости от домена), но и со снижением частоты кровотечений по критериям ВОЗ (р от 0,002 до < 0,001 в зависимости от домена).
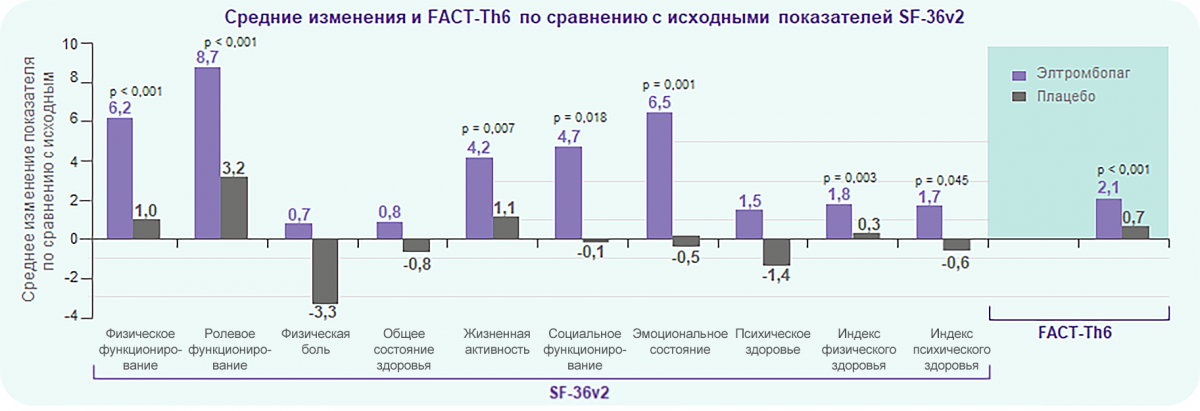
Примечание.
* SF-36v2 — сокращенная форма опросника из 36 вопросов, версия 2.
** FACT-Th6 — опросник из 6 вопросов для функциональной оценки хронических заболеваний (FACIT), применяется для оценки обеспокоенности пациентов в отношении кровотечений и их влияния на повседневную активность пациента.
EXTEND: Элтромбопаг обеспечивает быстрый и устойчивый тромбоцитарный ответ
Средний уровень тромбоцитов составил ≥ 50 × 109/л ко 2-й неделе. Достигнутый уровень стабильно сохранялся в течение 250 недель лечения.
-
91 %
пациентов достигли числа тромбоцитов ≥ 30 × 109/л. -
86 %
пациентов достигли числа тромбоцитов ≥ 50 × 109/л.
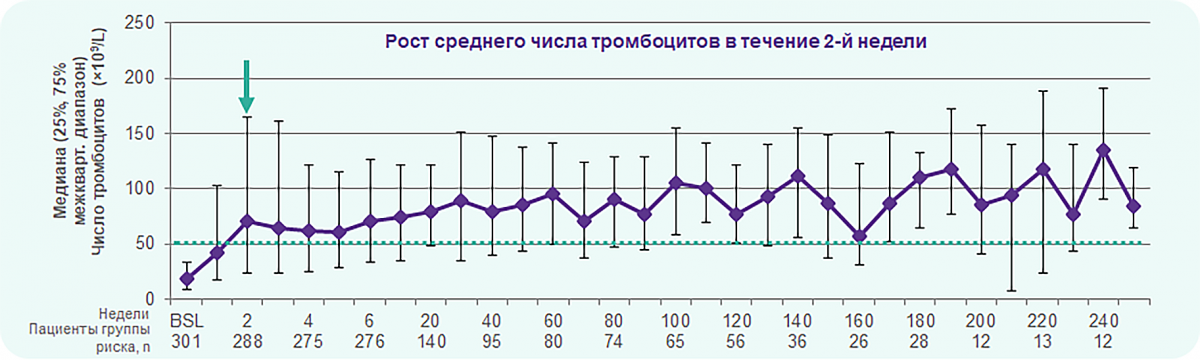
EXTEND: Элтромбопаг уменьшает кровотечения и снижает потребность в глюкокортикостероидах
Элтромбопаг уменьшает частоту развития кровотечений.
исходно
57 %
через год
16 %
Элтромбопаг уменьшает потребность пациентов в:
приеме дополнительных препаратов
34 %
пациентов полностью прекратили прием ≥ 1 препарата, обычно глюкокортикостероида
52 %
Уровень тромбоцитов ≥ 50 × 109/л сохранялся ≥ 25 недель без изменения терапии
неотложной терапии
71 %
Уровень тромбоцитов ≥ 30 × 109/л сохранялся ≥ 25 недель без изменения терапии
EXTEND: Элтромбопаг уменьшает показатели выраженности усталости и обеспокоенности в отношении кровотечений в течение 5 лет
-
~ 80 %
пациентов сообщили об улучшении показателя качества жизни, связанного со здоровьем.
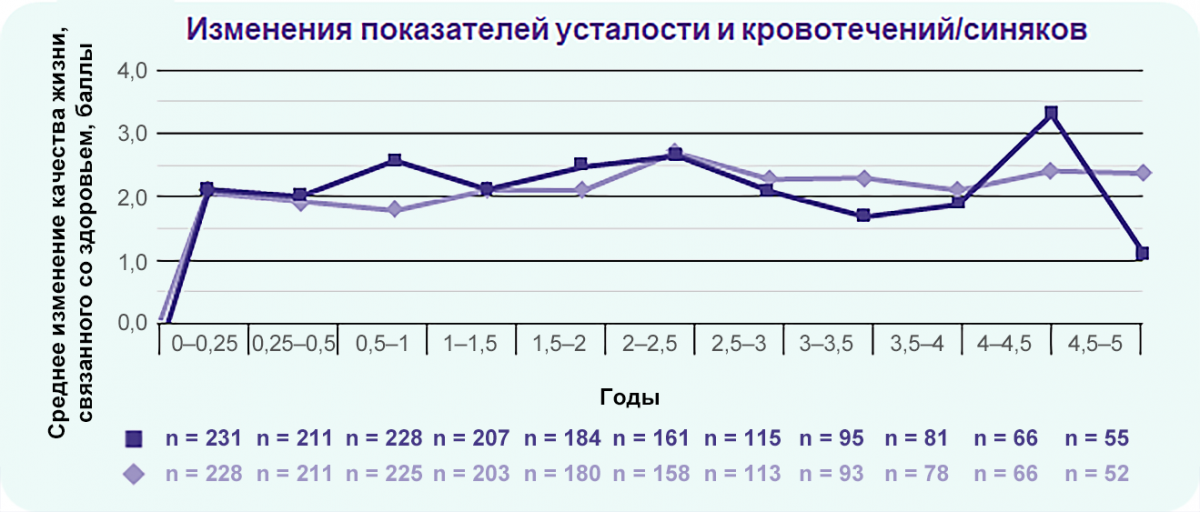
Примечание.
FACIT-Усталость (n = 291) — подшкала функциональной оценки терапии хронических заболеваний (FACIT), применяется для измерения выраженности усталости и ее влияния на повседневную жизнь и деятельность пациентов.
FACT-Th6 (n = 288) — опросник из 6 вопросов для функциональной оценки хронических заболеваний (FACIT), применяется для оценки обеспокоенности пациентов в отношении кровотечений и их влияния повседневную активность пациента.
EXTEND: Элтромбопаг обладает приемлемым уровнем безопасности при долгосрочном применении > 8 лет
| Нежелательные явления | Пациенты n (%) n = 302 |
| Все НЯ | 277 (92) |
| Головная боль | 86 (28) |
| Назофарингит | 74 (25) |
| Инфекции верхних дыхательных путей | 69 (23) |
| Утомляемость | 50 (17) |
| Диарея | 47 (16) |
| Артралгия | 45 (15) |
| Боль в спине | 40 (13) |
| Инфекции мочевыводящих путей | 34 (11) |
| Тошнота | 34 (11) |
| Кашель | 32 (11) |
| Грипп | 30 (10) |
| Анемия | 29 (10) |
-
Большинство НЯ были 1 и 2 степени тяжести.
-
Наиболее часто встречающиеся НЯ: головная боль, назофарингит, инфекции верхних дыхательных путей.
-
НЯ 3 степени были отмечены у 26% пациентов.
Примечание.
НЯ — нежелательное явление.
EXTEND: Катаракта при долгосрочной терапии элтромбопагом отмечалась у пациентов, исходно имевших факторы риска
-
В начале исследования у 192 (66%) пациентов выявлен 1 фактор риска катаракты или более: применение ГКС — 49%, курение — 18% и/или сахарный диабет — 12%.
-
В ходе исследования развитие катаракты было отмечено у 28 (9%) пациентов:
-
16 (5%) пациентов ее рассматривали как СНЯ;
-
4 явления привели к прекращению лечения.
-
Примечание.
СНЯ — серьезное нежелательное явление.
| Исходные факторы риска развития катаракты | Элтромбопаг n = 28a n (%) |
| Факторы риска отсутствуют | 6 (22)b |
| Не менее одного фактора риска | 21 (78) |
| Длительное применение стероидов | 16 (59) |
| Сахарный диабет | 6 (22) |
| Офтальмологическая операция в анамнезе | 4 (15) |
| Офтальмологические заболевания, требовавшие медикаментозного лечения, в анамнезе | 2 (7) |
| Серьезная травма глаза | 1 (4) |
| Подагра | 1 (4) |
| Курение | 4 (15) |
| Другое | 3 (11) |
EXTEND: У большинства пациентов фиброз КМ при длительной терапии элтромбопагом отсутствовал или был незначительным
| Степень по ЕКШa | Интервалы оценок во время лечения, месяцы n (%) | ||||||
| < 10 n = 15 | 12 n = 150 | 24 n = 76 | 36 n = 55 | 48 n = 33 | 60 n = 18 | Максимальная степень n = 166b | |
| ФКМ-0 | 12 (80) | 97 (65) | 63 (83) | 44 (80) | 22 (67) | 11 (61) | 87 (52) |
| ФКМ-1 | 3 (20) | 43 (29) | 11 (15) | 10 (19) | 10 (30) | 7 (39) | 68 (41) |
| ФКМ-2 | 0 | 10 (7) | 1 (1) | 1 (2) | 1 (3) | 0 | 10 (6) |
| ФКМ-3 | 0 | 0 | 1 (1) | 0 | 0 | 0 | 1 (< 1) |
Примечание.
a — Степени по ЕКШ (Thiele J. et al. Haematologica 2005; 90: 1128–132).
b — Результаты централизованного и местного анализа биопсии костного мозга (n = 356) были получены для 166 пациентов, принимающих элтромбопаг в течение периода до 7 лет. Анализ проводили с использованием ЕКШ.
ЕКШ — Европейская консенсусная шкала; ФКМ — фиброз костного мозга.
Терапия элтромбопагом в течение ≥ 2 лет не сопровождается клинически значимым увеличением содержания ретикулина или коллагена в КМ у большинства пациентов с ИТП
-
Через 1 и 2 года терапии отмечалось отсутствие или незначительное количество ретикулина у 96% и 100% пациентов соответственно по результатам биопсии костного мозга.
-
Признаки миелофиброза или других клинически значимых аномалий КМ у пациентов, получавших элтромбопаг в течение ≥ 2 лет, отсутствовали.
-
Ни у одного из пациентов, у которых был обнаружен ретикулин или коллаген, не было признаков или симптомов, указывающих на дисфункцию КМ, в течение 2 лет приема препарата.
-
Не было зарегистрировано НЯ, связанных с ФКМ.
Литературные источники:
- Инструкция по медицинскому применению препарата Револейд® РУ № ЛСР-010032/09 от 03.11.2020.
- Инструкция по медицинскому применению препарата Энплейт®.
- Kuter D.J. Biology and chemistry of thrombopoietic agents. Semin hematol. 2010; 47(3): 243—248.
- Liu X., Liu S., Liu X. et al. Thrombopoietin receptor agonists shift the balance of Fcg receptors toward inhibitory receptor IIb on monocytes in ITP. 2016; 128: 852—861.
- Schifferli A., Kühne T. Thrombopoietin receptor agonists: a new immune modulatory strategy in immune thrombocytopenia? Blood. 2016; S31–S34.
- Bao W., Bussel J., Heck S. et al. Improved regulatory T-cell activity in patients with chronic immune thrombocytopenia treated with thrombopoietic agents. Blood. 116(22): 4639—4645.
- Global Data Sheet. Version 14. November 23, 2016.
- Jenkins M. и соавт. Blood. 2007;109:4739–4741.
- Bussel J. и соавт. N Engl J Med. 2007;357:2237–2247.
- Bussel J. и соавт. Lancet. 2009;373:641–648.
- Cheng G. и соавт. Lancet. 2011;377:393–402. Erratum in Lancet. 2011;377:382.
- Bussel J. и соавт. Br J Haematol. 2013;160:538-546.
- Saleh и соавт. Blood. 2013;121:537–545.
- Wong R.S.M. и соавт. Blood. 2017;130:2527-2536. Erratum in Blood. 2018;131:709.
- Wong R.S. и соавт. Scand J Clin Lab Invest. 2015;75:13-17.
- Cheng G. et al. Lancet. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. 2011;377(9763):393-402. doi: 10.1016/S0140-6736(10)60959-2.
- Wong R.S.M., Saleh M.N., Khelif A. et al. Safety and effi cacy of long-term treatment of chronic/persistent ITP with eltrombopag: final results of the EXTEND study. Blood. 2017;130(3):2527-2536.
- Khelif A., Saleh M.N., Salama A. et al. Patient-reported health-related quality of life improves over time in patients with chronic immune thrombocytopenia receiving long-term treatment with eltrombopag. Blood. 2016;128(22):3750.
- Brynes R.K. и соавт. A 2-Year, Longitudinal, Prospective Study of the Effects of Eltrombopag on Bone Marrow in Patients With Chronic Immune Thrombocytopenia. Acta Haematol. 2016;137:66-72.
- Brynes R.K. и соавт. EHA. 2015;Oral S500.
11213656/REV/WEB/07.24/0
