Исследование RADIANCE
Одним из главных инвалидизирующих осложнений дегенеративной миопии (ДМ) является хориоидальная неоваскуляризация (ХНВ), которая в основном поражает макулу — центральную область сетчатки. ХНВ развивается у пациентов с ДМ при естественном течении от 5% до 11% и сопровождается значительными поражениями фоторецепторов и необратимой потерей центрального зрения1.
Эффективность интравитреального введения ранибизумаба в терапии ХНВ при ДМ доказана в международном рандомизированном многоцентровом исследовании RADIANCE1.
Дизайн исследования
RADIANCE: 12-месячное рандомизированное двойное слепое многоцентровое исследование III фазы с активным контролем2.
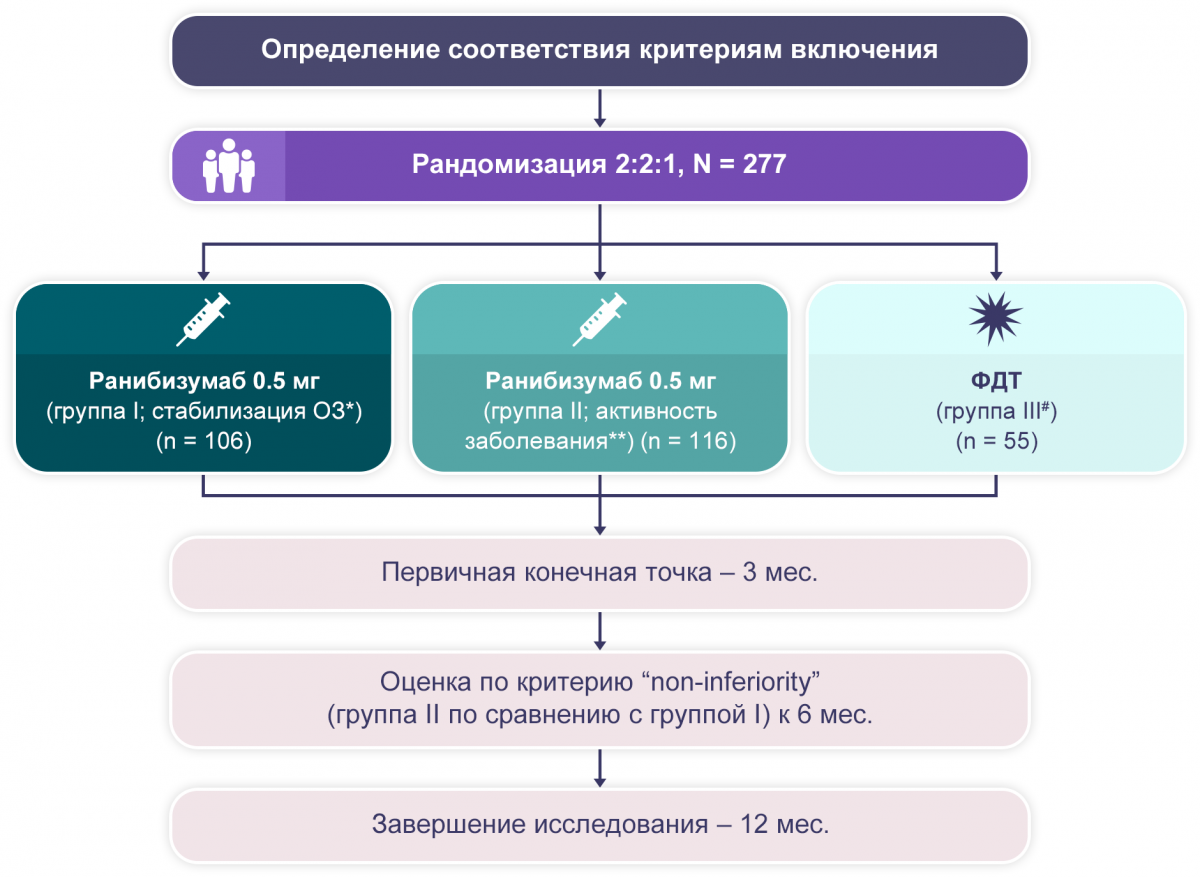
* Пациенты получали ранибизумаб в 1-й день и 1-й мес., в последующем применение было основано на критерии стабилизации. ** Пациенты получали ранибизумаб в 1-й день, в последующем применение было основано на критерии активности заболевания. # Допускалось применение ранибизумаба начиная с 3-го месяца.
Изменение остроты зрения в течение 12 месяцев
-
В группах терапии ранибизумабом наблюдалось стойкое улучшение зрения на протяжении 12 мес. (рис. 1, 2).
-
В группе фотодинамической терапии (ФДТ) с вертепорфином — улучшение зрения при присоединении ранибизумаба с 3-го мес.
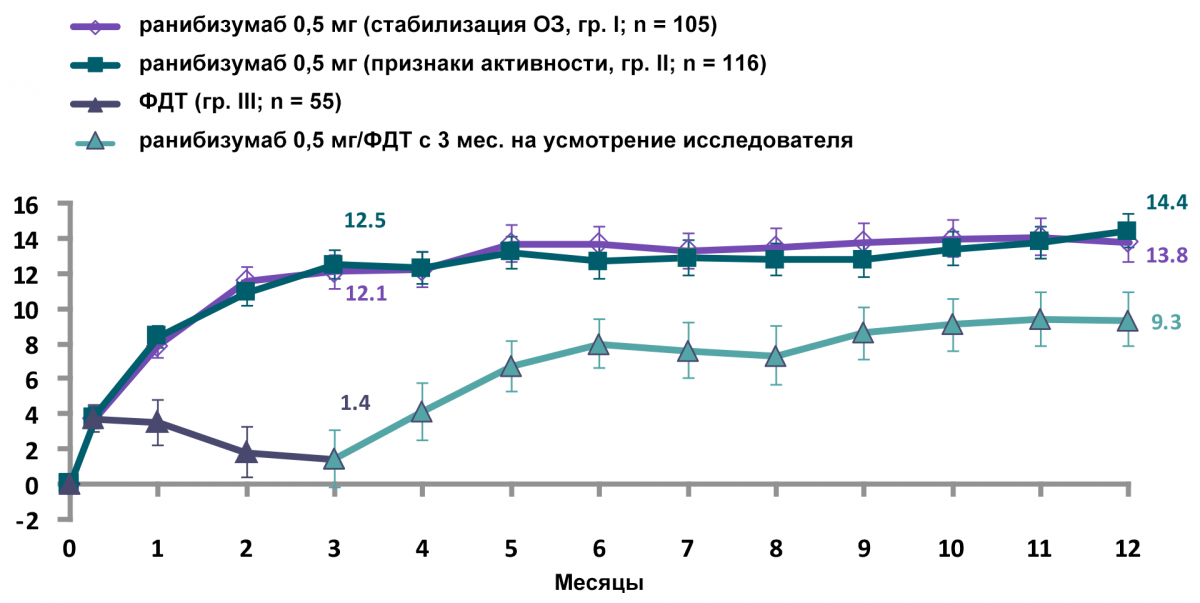
Рисунок 1 — Изменение остроты зрения в течение 12 месяцев
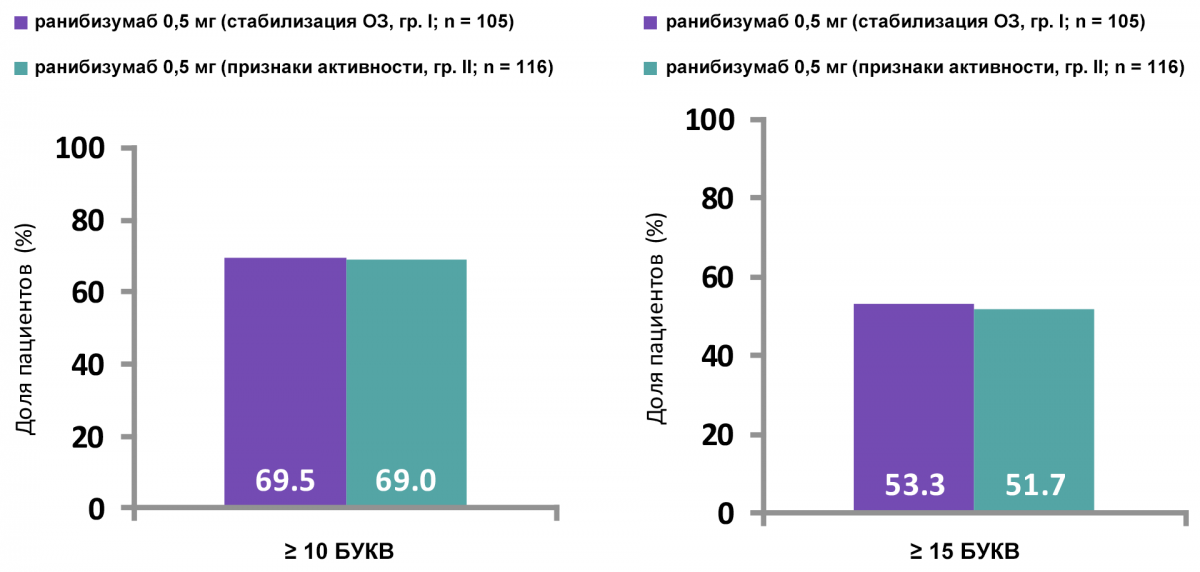
Рисунок 2 — Пациенты с улучшением остроты зрения на ≥ 10 и ≥ 15 букв к 12 месяцам
Индивидуальная потребность в инъекциях на протяжении 12 месяцев
-
> 60% пациентов (ретритмент, основанный на активности) не требовалось повторных инъекций после 6 месяцев (рис. 3);
-
> 50% пациентов (ретритмент, основанный на активности) требовалось 1–2 инъекции (медиана) на протяжении 12 месяцев.
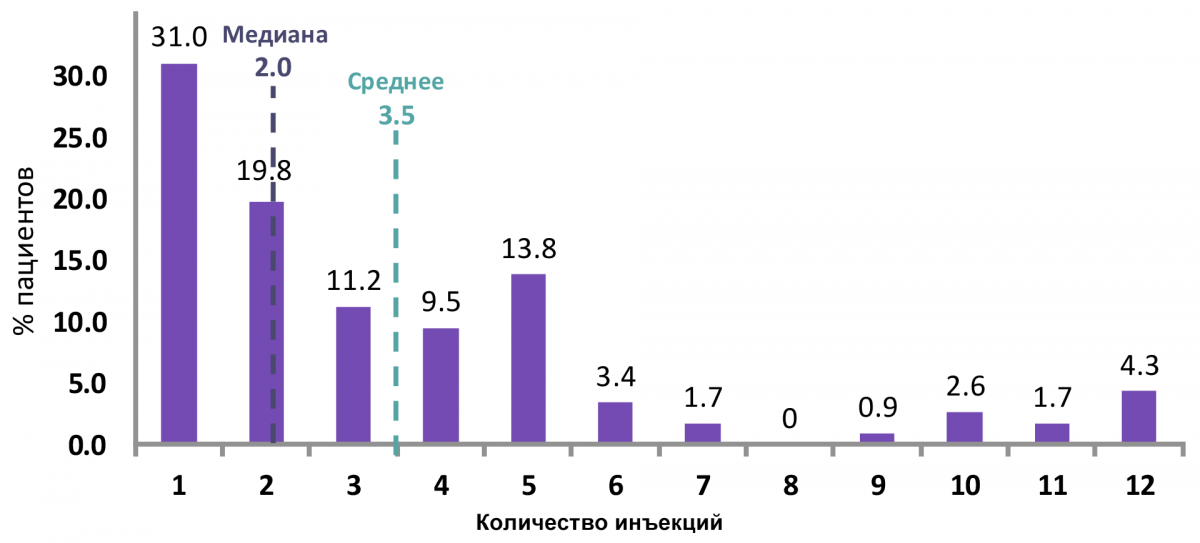
Рисунок 3 — Индивидуальная потребность в инъекциях на протяжении 12 месяцев
Количество инъекций ранибизумаба, потребовавшееся участникам каждой группы, указано в таблице 1.
Таблица 1. Количество инъекций ранибизумаба
| Ранибизумаб 0,5 мг (гр. I; стабилизация ОЗ) | Ранибизумаб 0,5 мг (гр. II; активность заболевания) | вФДТ (гр. III) | |
| N | 106 | 118 | 38 |
| Всего | 489 | 412 | 123* |
| Среднее значение (SD) | 4.6 (2.6) | 3.5 (2.9) | 3.2 (2.5) |
| Медиана | 4.0 | 2.0 | 2.0 |
* Пациенты из группы с вФДТ начиная с 3-го месяца получали ранибизумаб 0,5 мг/вФДТ.
Ключевые параметры безопасности
В ходе исследования у наблюдаемых пациентов ни в одной из групп терапии не было зарегистрировано случаев:
-
Эндофтальмита;
-
Отслойки сетчатки;
-
Смертей;
-
Инфаркта миокарда;
-
Цереброваскулярных осложнений.
Заключение и выводы
-
В обоих режимах ранибизумаб был более эффективен, чем ФДТ, в отношении улучшения зрения к 3 месяцам терапии.
-
Терапия ранибизумабом, основанная на активности (группа II), была «не хуже» (критерий non-inferiority) в отношении улучшения зрения по сравнению терапией, основанной на критерии стабилизации (группа I).
-
Терапия ранибизумабом сопровождалась быстрым улучшением остроты зрения к 3 месяцу и сохранением достигнутого улучшения к 12 месяцам.
-
Среднее количество инъекций ранибизумаба было выше в группе I (терапия, основанная на стабилизации) = 4.0 по сравнению с группой II (терапия, основанная на активности) = 2.0 (медиана).
Исследование REPAIR
В исследовании REPAIR оценивалась эффективность и безопасность интравитреального применения ранибизумаба у пациентов с ХНВ, вторичной по отношению к патологической миопии (миопическая ХНВ — мХНВ)3. Была разработана оптимальная стратегия и режим дозирования анти-VEGF препарата.
Дизайн исследования
REPAIR: фаза II, oткрытое несравнительное многоцентровое 12-месячное исследование3.
Ключевые показатели исследования приведены в таблице 2.
Таблица 2. Ключевые показатели исследования
| Ключевые показатели | Результаты |
| Среднее улучшение ОЗ к 12 мес. | +13.76 буквы |
| Среднее уменьшение ТЦЗС к 12 мес. | -135.16 мкм |
| Среднее количество инъекций за 12 мес. | 3.6 |
| Медиана инъекций за 12 мес. | 3 |
| Пациенты, которым потребовалась 1 инъекция на протяжении 12 мес. | 21% |
| Среднее количество дополнительных инъекций после начальной (медиана) | 2 |
| Серьезные нежелательные явления |
|
Примечание. ТЦЗС — толщина центральной зоны сетчатки.
Выводы
Анти-VEGF терапия (исследования REPAIR, RADIANCE):
-
Обеспечивает улучшение и сохранение зрения у пациентов со снижением остроты зрения, вызванным хориоидальной неоваскуляризацией, обусловленной патологической миопией.
-
При в среднем небольшой потребности в инъекциях:
-
2.0 (группа терапии, основанная на активности, REPAIR).
-
Каждому 5-му пациенту может потребоваться только 1 инъекция на протяжении 1 года.
-
Исследование MINERVA
Целью исследования является оценка эффективности и безопасности ранибизумаба в индивидуализированном режиме «по потребности», основанном на активности заболевания, у пациентов с нарушениями зрения вследствие ХНВ на фоне причин, не связанных с неоваскулярной формой возрастной макулярной дегенерации (нВМД) и мХНВ4.
Дизайн исследования
MINERVA: 12-месячное двойное маскированное плацебо-контролируемое многоцентровое рандомизированное исследование III фазы4.
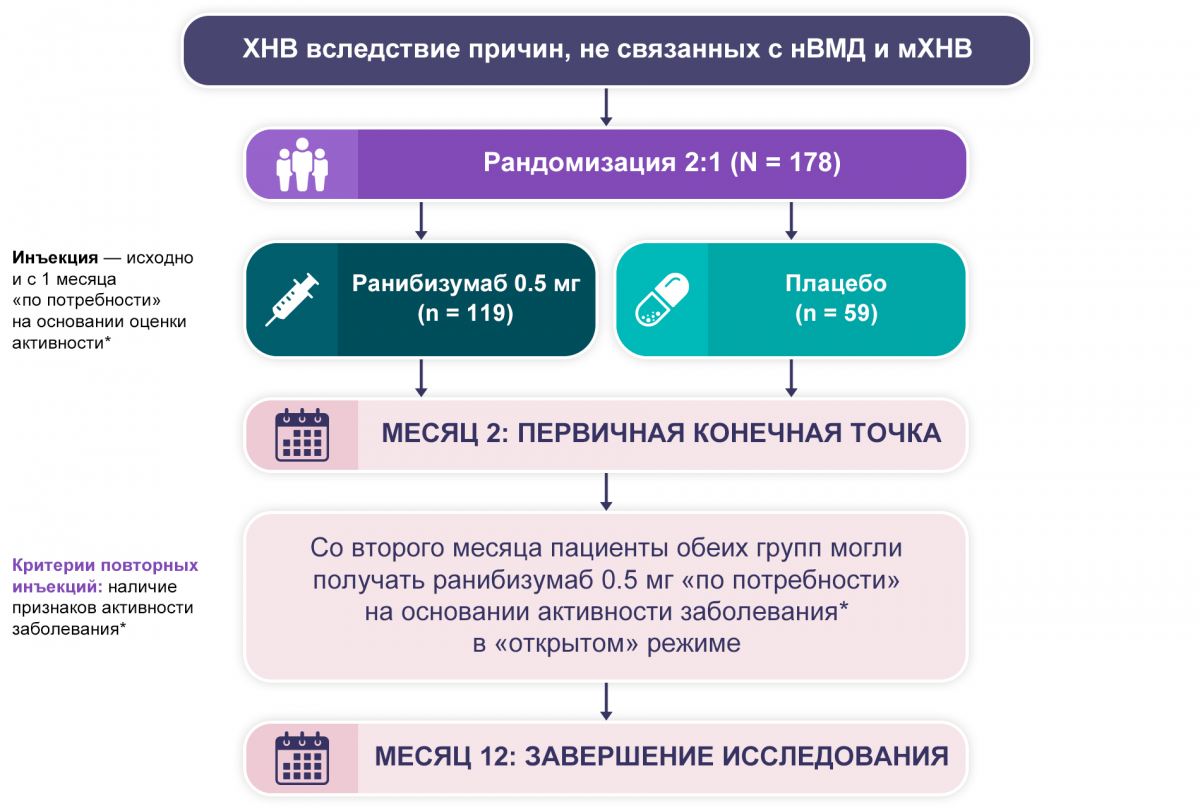
* Снижение ОЗ, наличие суб-/интраретинальной жидкости, геморрагий или ликиджа. Пациенты из группы плацебо, которые со 2-го месяца не получали ранибизумаб, обозначаются как группа «плацебо без ранибизумаба» (n = 7), а те, которые получали ранибизумаб в «открытом» режиме со 2-го месяца, — группа «плацебо с ранибизумабом» (n = 52).
Ключевые критерии включения и исключения
Критерии включения:
-
Пациенты ≥ 18 лет.
-
Наличие очага ХНВ в исследуемом глазу.
-
Наилучшая корригированная острота зрения (НКОЗ) от ≥ 24 до ≤ 83 букв ETDRS в исследуемом глазу.
Критерии исключения:
-
ХНВ, ассоциированная с нВМД, полипоидная хориоидальная васкулопатия (ПХВ) или патологическая миопия.
-
Любое системное тяжелое или нестабильное состояние или лечение, которые могут влиять на оценку первичных или вторичных исходов.
-
Неконтролируемое системное воспаление или инфекция, непосредственно связанные с развитием ХНВ.
-
Активная диабетическая ретинопатия, активная инфекция глаза/периокулярной локализации или активное тяжелое интраокулярное воспаление.
-
Лазерная коагуляция области макулы в анамнезе, фотодинамическая терапия с вертепорфином, витреоретинальная хирургия и интравитреальные импланты в анамнезе независимо от давности проведения; анти-VEGF терапия и интравитреальные стероиды в течение 6 мес. до первого визита.
Цели исследования и конечные точки
Первичная конечная точка
Оценка эффективности ранибизумаба по сравнению с плацебо по изменению НКОЗ от исходного значения ко второму месяцу.
Запланированный анализ подгрупп касался следующих показателей первичной конечной точки:
-
Исходный возраст (≤ 60 и > 60 лет).
-
Исходная НКОЗ (≤ 60 и > 60 букв).
-
Этиология ХНВ:
-
Идиопатическая хориоретинопатия.
-
Ангиоидные полосы.
-
Поствоспалительная хориоретинопатия.
-
Центральная серозная хориоретинопатия (ЦСХР).
-
Смешанные причины — причины ХНВ, которые не соответствуют ни одной из указанных выше подгрупп и недостаточно часто встречаются, чтобы сформировать отдельные подгруппы.
-
Ключевые вторичные конечные точки:
-
Изменения НКОЗ от исходного уровня ко 2-му и 12-му месяцу.
-
Доля пациентов с улучшением зрения на ≥ 5, ≥ 10 и ≥ 15 букв или достигающих 84 букв ко 2-му и 12-му месяцу.
-
Изменения толщины центральной зоны сетчатки от исходного уровня ко 2-му месяцу.
-
Доля пациентов с наличием интра-/субретинальной жидкости ко 2-му и 12-му месяцу.
-
Доля пациентов с наличием активного ликиджа ко 2-му и 12-му месяцу.
-
Количество инъекций ранибизумаба в исследуемом глазу до 11-го месяца.
-
Оценка безопасности в течение 12 месяцев.
Характеристика пациентов
В 12-месячном исследовании из 178 рандомизированных пациентов завершили участие — 167 (93,8%).


Терапия ранибизумабом эффективнее по сравнению с плацебо ко 2-му месяцу
Данные по сравнению эффективности ранибизумаба и плацебо представлены на рисунке 4.
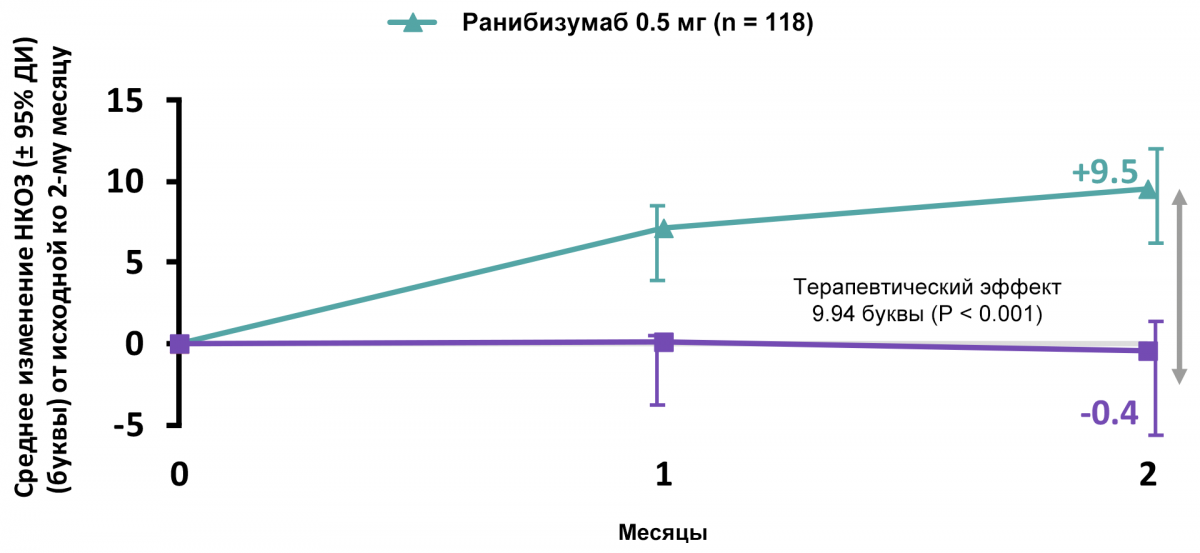
Рисунок 4 — Эффективность тарапии ранибизумабом по сравнению с плацебо ко 2-му месяцу
Эффективность ранибизумаба в улучшении НКОЗ не зависит от исходной НКОЗ и этиологии ХНВ (таблица 3).
Таблица 3. Эффективность ранибизумаба в улучшении НКОЗ
| n (%) | Ранибизумаб | Плацебо | |
| Всего | 175 (100) | 9.5 | -0.4 |
| Демографические характеристики | |||
| Возраст, годы | |||
| ≤ 60 | 105 (60.0) | 13.0 | -0.2 |
| > 60 | 70 (40.0) | 4.2 | -0.8 |
| Исходная ОЗ, буквы | |||
| ≤ 60 | 76 (43.4) | 12.9 | 0.8 |
| > 60 | 99 (56.6) | 6.9 | -1.2 |
| Исходная ОЗ, буквы | |||
| Идиопатическая | 62 (35.4) | 12.5 | 1.1 |
| Ангиоидные полосы | 27 (15.4) | 11.0 | -3.5 |
| Поствоспалительная хориоретинопатия | 27 (15.4) | 7.0 | 0.4 |
| ЦСХР | 23 (13.1) | 6.6 | 1.6 |
| Смешанная этиология | 36 (20.6) | 7.5 | -3.0 |
Улучшение НКОЗ ко 2-му месяцу сохранялось к 12-му месяцу при терапии ранибизумабом
Динамика улучшения НКОЗ представлена на рисунке 5.
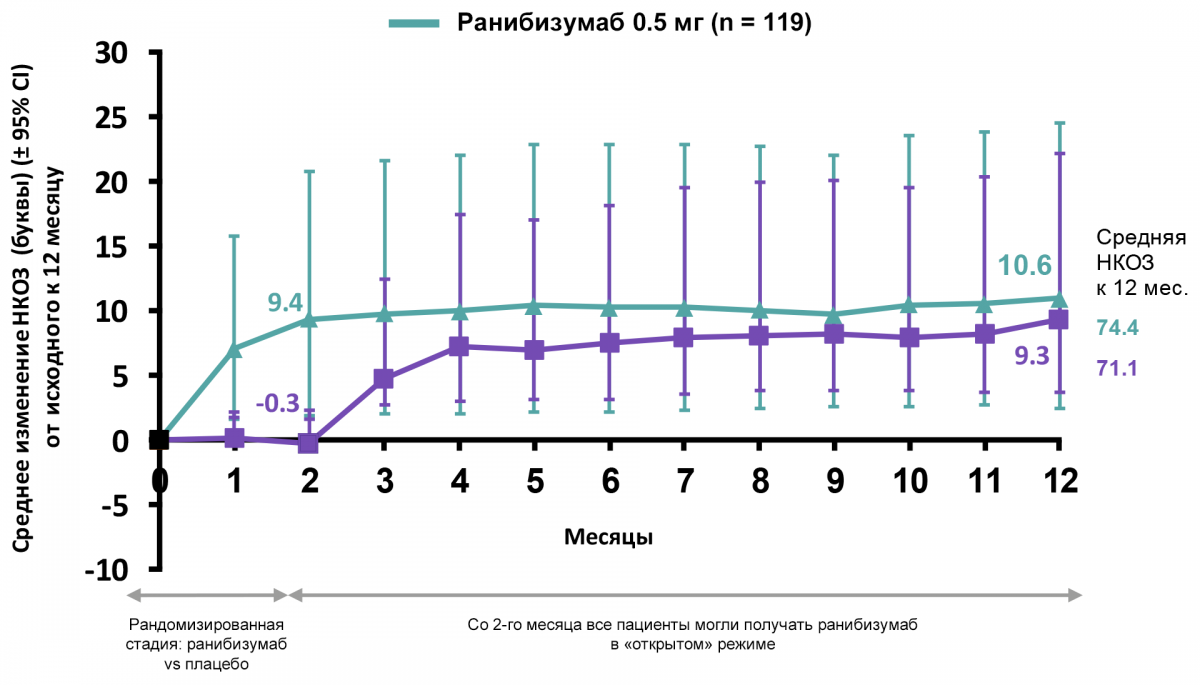
Рисунок 5 — Динамика улучшения НКОЗ в течение 12 месяцев
Результаты оценки безопасности подтверждают благоприятный профиль безопасности ранибизумаба
Частота нежелательных явлений, развившихся в ходе исследования, указана в таблице 4.
Таблица 4. Частота нежелательных явлений
| НЯ, n (%) | Ранибизумаб 0.5 мг (n = 119) | Плацебо и ранибизумаб 0.5 мг (n = 52) | Плацебо без ранибизумаба (n = 7) | Всего (N = 178) |
| Офтальмологические НЯ, всего | 30 (25.2) | 22 (42.3) | 3 (42.9) | 55 (30.9) |
| Кровоизлияния в конъюнктиву | 7 (5.9) | 6 (11.5) | 0 | 13 (7.3) |
| Неофтальмологические НЯ, всего | 67 (56.3) | 25 (48.1) | 3 (42.9) | 95 (53.4) |
| Назофарингит | 14 (11.8) | 9 (17.3) | 1 (14.3) | 24 (13.5) |
| Респираторная инфекция | 9 (7.6) | 0 | 0 | 9 (5.1) |
| Офтальмологические СНЯ, всего | 0 | 0 | 0 | 0 |
| Неофтальмологические СНЯ, всего | 8 (6.7) | 4 (7.7) | 0 | 12 (6.7) |
| Смерть | 0 | 0 | 0 | 0 |
Примечание. НЯ — нежелательное явление, СНЯ — серьезное нежелательное явление. НЯ представлены в порядке убывающей частоты.
Заключение
-
Ранибизумаб был эффективен в лечении ХНВ независимо от причины, лежащей в основе ее развития.
-
Применение ранибизумаба в режиме, основанном на оценке активности заболевания, приводило к улучшению зрения ≈ 10 букв по сравнению с плацебо ко второму месяцу.
-
Наблюдалось сохранение остроты зрения, достигнутой при терапии ранибизумабом ко второму месяцу, вплоть до 12-го месяца.
-
Наблюдалась хорошая переносимость ранибизумаба и не было зарегистрировано каких-либо новых нежелательных явлений, что подтверждает благоприятный профиль безопасности ранибизумаба.
MINERVA: Дополнительные данные применения у взрослых
Другие вторичные цели и конечные точки
-
Среднее значение изменения показателя НКОЗ от исходного к 1 и 6 месяцам и к 1 и 12 месяцам (рис. 6).
-
Изменения толщины центральной зоны сетчатки (ТЦЗС) и центрального фовеолярного объема (ЦФО) от исходного к 12 месяцу.
-
Доля пациентов с потерей > 5, > 10 и > 15 букв ко 2 и 12 месяцам.
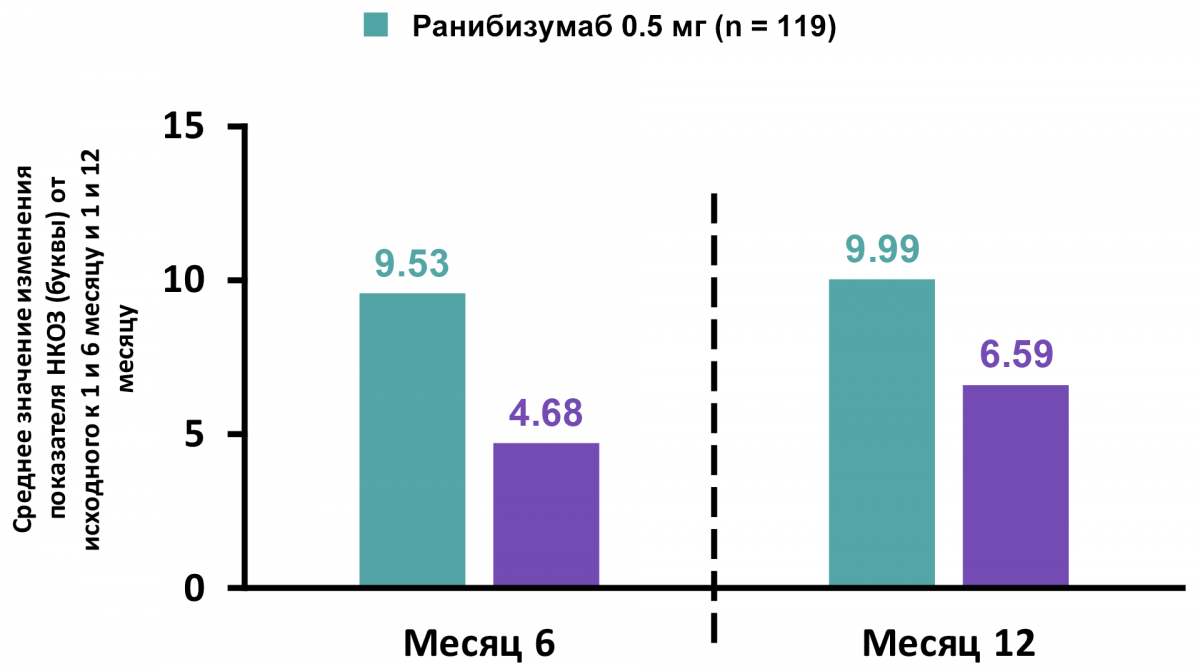
Рисунок 6 — Среднее значение изменения показателя НКОЗ к 6 и 12 месяцу
Со 2 месяца пациенты обеих групп могли получать ранибизумаб в «открытом» режиме.
-
Среднее уменьшение ТЦЗС, достигнутое ко 2 месяцу, сохранялось к 12 месяцу на фоне терапии ранибизумабом.
-
Среднее уменьшение макулярного объема, достигнутое ко 2 месяцу, сохранялось к 12 месяцу на фоне терапии ранибизумабом.
-
Потеря зрения на > 5, > 10 и > 15 ко 2 и 12 месяцу наблюдалась у большего числа пациентов, получавших плацебо.
Не наблюдалось серьезных офтальмологических НЯ или летальных исходов
Частота и структура НЯ указаны в таблице 5.
Таблица 5. Частота нежелательных явлений
| Характеристики, n (%) | Ранибизумаб 0.5 мг (n = 119) | Плацебо с ранибизумабом 0.5 мг (n = 52) | Всего (N = 178) |
| Офтальмологические СНЯ | 0 | 0 | 0 |
| Системные СНЯ | 8 (6.7) | 4 (7.7) | 12 (6.7) |
| Боль в верхней части живота | 1 (0.8) | 0 | 1 (0.6) |
| Острая дыхательная недостаточность | 1 (0.8) | 0 | 1 (0.6) |
| Фибрилляция предсердий | 1 (0.8) | 0 | 1 (0.6) |
| Внутрипротоковая папиллома молочной железы | 1 (0.8) | 0 | 1 (0.6) |
| Инвазивная карцинома доли молочной железы | 1 (0.8) | 0 | 1 (0.6) |
| Инвазивная карцинома доли молочной железы | 1 (0.8) | 0 | 1 (0.6) |
| Паркинсонизм | 1 (0.8) | 0 | 1 (0.6) |
| Периферический стеноз артерии | 1 (0.8) | 0 | 1 (0.6) |
| Доброкачественная опухоль гипофиза | 1 (0.8) | 0 | 1 (0.6) |
| ХОБЛ | 0 | 1 (1.9) | 1 (0.6) |
| Фекалома | 0 | 1 (1.9) | 1 (0.6) |
| Гепатоцеллюлярная карцинома | 0 | 1 (1.9) | 1 (0.6) |
| Олигурия | 0 | 1 (1.9) | 1 (0.6) |
| Пирексия | 0 | 1 (1.9) | 1 (0.6) |
| Ревматическая болезнь | 0 | 1 (1.9) | 1 (0.6) |
| Уросепсис | 0 | 1 (1.9) | 1 (0.6) |
| Смерть | 0 | 0 | 0 |
Примечание. СНЯ — серьезное нежелательное явление.
Выводы
-
MINERVA — клиническое исследование 3-й фазы, в котором изучались эффективность и безопасность ранибизумаба 0,5 мг в индивидуализированном режиме у пациентов с нарушениями зрения вследствие ХНВ, ассоциированной с любой причиной, кроме нВМД и мХНВ.
-
У большого числа взрослых пациентов с ХНВ различной этиологии лечение ранибизумабом было эффективным и требовало относительно небольшого количества инъекций.
-
Отмечалась хорошая переносимость ранибизумаба в течение 12 мес., что согласуется с хорошо изученным благоприятным профилем безопасности ранибизумаба.
Список источников:
- Fujikado T., Ohji M., Kusaka S. et al. Visual function after foveal translocation with 360‐degree retinotomy and simultaneous torsional muscle surgery in patients with myopic neovascular maculopathy. Am J Ophthalmol. 2001;131:101‐10.
- Wolf S, et al. RADIANCE: a randomized controlled study of ranibizumab in patients with choroidal neov ascularization secondary to pathologic myopia. Ophthalmology 2014; 121 (3): 682-92.e2.
- A.Tuf ail et al. Ranibizumab in My opic Choroidal Neov ascularization: The 12-Month Results from the REPAIR Study. Ophthalmology 2013; 120(9): 1944-5.
- T.Y .Y .Lai et al. Efficacy and safety of ranibizumab 0.5 mg in adult patients with visual impairment due to choroidal neov ascularization associated with rare diseases: 12 month results of the MINERVA study. RETINA 38:1464–1477, 2018.
400909/LUX/WEB/03.23/0
