Хориоидальная неоваскуляризация (ХНВ) — патологический механизм, который является общим для многих глазных заболеваний. ХНВ характеризуется ростом новообразованных кровеносных сосудов из хориоидеи в субретинальный эпителий и (или) субретинальное пространство1.
ХНВ наиболее часто развивается при возрастной макулярной дегенерации (ВМД) у людей старше 50 лет и является одной из ведущих причин слепоты2.
ХНВ другой этиологии встречается реже, преимущественно у пациентов трудоспособного возраста. Чаще она бывает мультифокальной, иногда юкста- или экстрафовеальной локализации с рецидивирующим течением3, 4.
Классификация по Age-Related Eye Disease Study (AREDS) [18], принятая в клинических исследованиях и также используемая в клинической практике, выделяет стадии:
- Отсутствие ВМД (категория 1 AREDS) — это отсутствие изменений или небольшое количество мелких друз (диаметр < 63 микрон);
- Раннюю стадию ВМД (категория 2 AREDS, ранняя сухая форма ВМД) — это множественные мелкие друзы, небольшое число друз среднего размера (диаметр от 63 до 124 микрон) или начальные изменения ПЭ сетчатки;
- Промежуточную стадию ВМД (категория 3 AREDS, промежуточная сухая форма ВМД) — это множество друз среднего размера, по крайней мере одна большая друза (диаметр ≥ 125 микрон) или ГА, не затрагивающая центральной ямки;
- Позднюю стадию ВМД (категория 4 AREDS) — характеризуется одним или несколькими из следующих признаков (при отсутствии других причин):
- наличием ГА, затрагивающей центральную зону глазного дна, — атрофическая (сухая) форма;
- наличием ХНВ с различными проявлениями (отслойкой НЭ и (или) ПЭ, отеком НЭ, геморрагиями, твердыми (липидными) экссудатами и другими) — влажная (неоваскулярная, экссудативная) форма ВМД;
- образованием рубцово-атрофических изменений (исход влажной формы ВМД).
На основании локализации ХНВ подразделяют на следующие типы:
-
ХНВ 1 типа — локализуется под ПЭ (соответствует скрытой ХНВ в классификации, основанной на данных ФАГ).
-
ХНВ 2 типа — локализуется над ПЭ (соответствует классической ХНВ в классификации, основанной на данных ФАГ).
-
К ХНВ 3 типа относят РАП, которая характеризуется началом пролиферативного процесса в ретинальной сосудистой сети с последующим формированием ХНВ.
ХНВ 1 типа
Новообразованные сосуды развиваются под РПЭ (рис. 1).
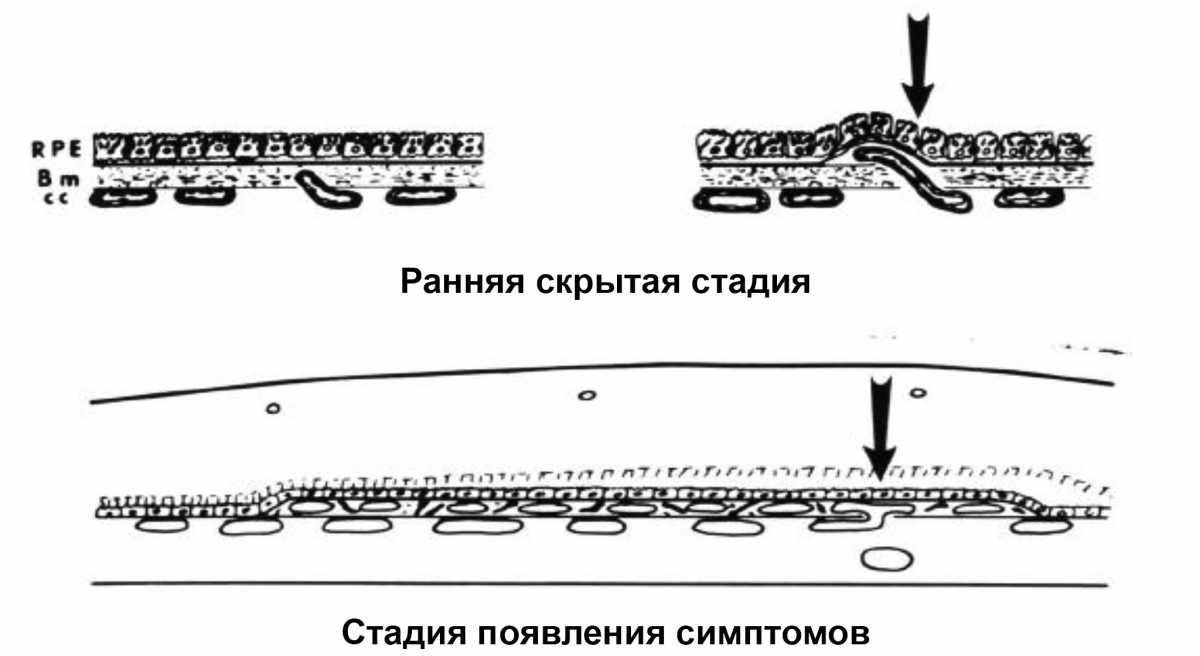
Рисунок 1. ХНВ 1 типа: черные стрелки показывают рост новых капилляров из хориокапилляров через мембрану Бруха и между базальной мембраной РПЭ и утолщенным и дегенеративно измененным внутриколлагеновым слоем мембраны Бруха
ХНВ 2 типа
Новообразованные сосуды пенетрируют комплекс РПЭ / мембрану Бруха и прорастают в субретинальное пространство над РПЭ (рис. 2).
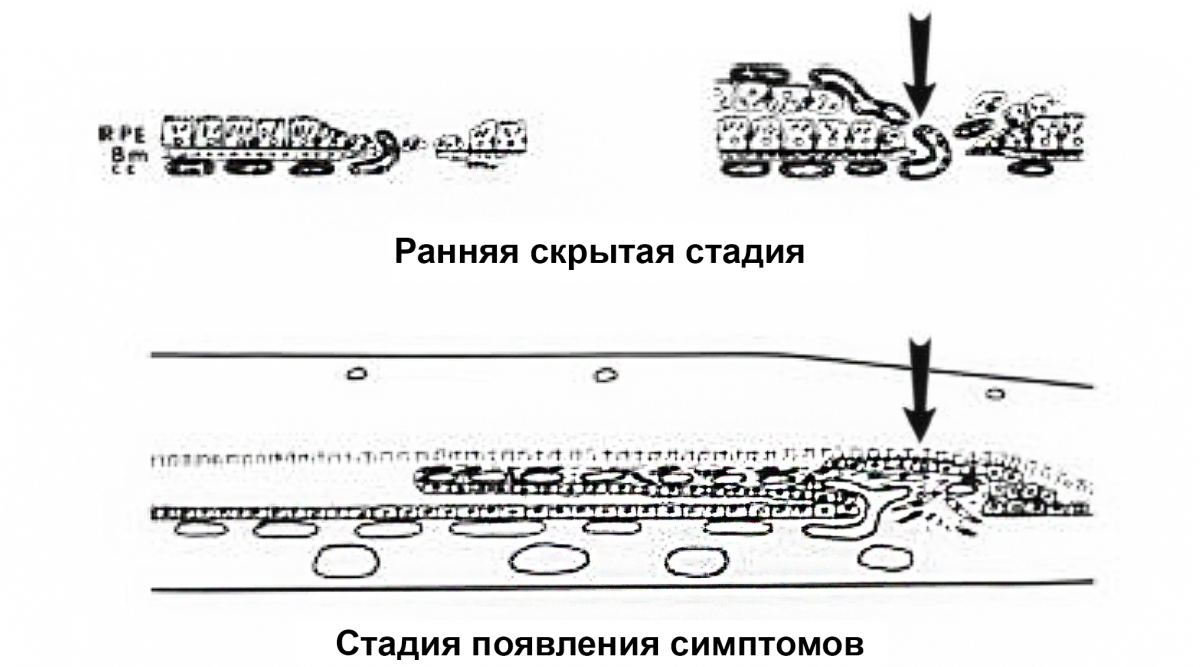
Рисунок 2. ХНВ 2 типа: черные стрелки показывают рост новых капилляров из хориокапилляров через дефект в локально поврежденной мембране Бруха в пространство под нейроэпителием вдоль участка пролиферирующего
Патогенез субретинальной неоваскуляризации
Фактор роста эндотелия сосудов (Vascular Endothelial Growth Factor, VEGF) рассматривают как ключевое звено в развитии ХНВ (рис. 3).
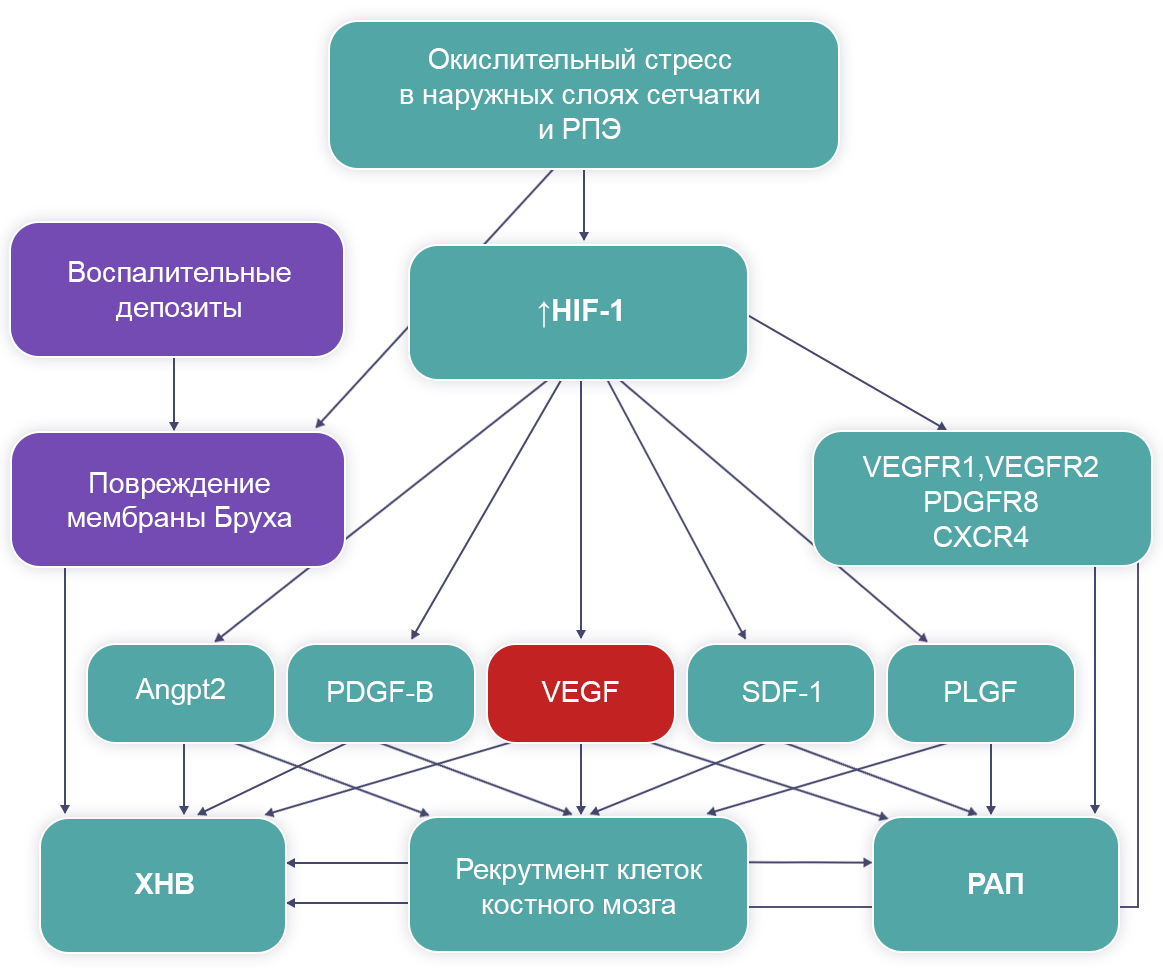
Рисунок 3. Патогенез субретинальной неоваскуляризации
VEGFR1, VEGFR2 — тирозинкиназные рецепторы;
PDGFR8 — рецептор эндотелия сосудов;
CXCR4 — рецептор хемокинов;
Angpt2 — гликопротеин семейства ангиопоэтин-подобных белков, продукт гена человека ANGPTL2;
PLGF, PDGF-B — тромбоцитарные факторы роста;
SDF-1 — производный от стромальных клеток фактор-1.
Роль VEGF в формировании ХНВ
VEGF — это мощный митоген для эндотелиальных клеток, стимулирующий пролиферацию, миграцию и формирование каналов, что в свою очередь приводит к росту новых кровеносных сосудов. С повышенной выработкой VEGF связано развитие многих глазных заболеваний, таких как ВМД, диабетическая ретинопатия, ретинопатия недоношенных и окклюзия вен сетчатки7.
VEGF связан со множеством цитокинов в каскаде воспалительных реакций, таких как8:
-
NF-κB;
-
ИЛ-1β;
-
TNF-α;
-
ИЛ-6;
-
ИЛ-8;
-
TGF-β2.
Макрофаги, концентрирующиеся вокруг неоваскулярных каналов, продуцируют TNF-α, который стимулирует выработку VEGF РПЭ1, 9. VEGF считается ключевой молекулой в развитии ХНВ2, 8, 10.
Неоваскулярная ВМД, патологическая миопия и редкие формы ХНВ
Неоваскулярная ВМД (нВМД) — офтальмологическое заболевание, развивающееся у пациентов старше 50 лет, среди которых наиболее часто наблюдается ХНВ3, 11.
Особенности нВМД:
-
представляет собой 20% всех случаев ВМД и является причиной 80% случаев потери зрения12;
-
чаще поражает один глаз;
-
часто сопровождается резким снижением остроты зрения12;
-
несколько факторов, включая VEGF, стимулируют рост ХНВ при нВМД12.
Патологическая миопия
Встречается у пациентов моложе 50 лет. Распространенность в мире — до 3%, является третьей наиболее частой причиной слепоты13.
Патологическая миопия — вторая наиболее частая причина ХНВ (5,2 — 11,3%), а в популяции более молодых пациентов — основная причина13.
Редкие формы ХНВ
Редкие формы ХНВ, как правило, встречаются у пациентов трудоспособного возраста моложе 50 лет и являются причиной потери зрения, а также могут быть рецидивирующими3, 14.
Причины редких форм ХНВ:
-
Центральная серозная хориоретинопатия.
-
Разрыв хориоидеи.
-
Паттерн-дистрофия пигментного эпителия сетчатки.
-
Макулярные телеангиэктазии 2 типа.
-
Ретинальная ангиоматозная пролиферация.
-
Вителлиформная макулярная дегенерация взрослых.
-
Наследственные («семейные») друзы.
-
Ангиоидные полосы.
-
Хориоидальная гемангиома.
-
Травма.
-
Псевдовителлиформная макулярная дегенерация.
-
Болезнь Беста.
-
Болезнь Штаргардта.
-
Хориоидальный невус.
-
Рубец после хирургии.
-
Полипоидная хориоидальная васкулопатия.
Классификация ВМД
Отсутствие ВМД — отсутствие изменений или небольшое количество мелких друз (диаметр < 63 микрон).
Ранняя стадия ВМД — множественные мелкие друзы, небольшое число друз среднего размера (диаметр от 63 до 124 микрон) или начальные изменения ПЭ сетчатки.
Промежуточная стадия ВМД — множество друз среднего размера, по крайней мере одна большая друза (диаметр ≥ 125 микрон) или ГА, не затрагивающая центральной ямки.
Атрофическая форма ВМД (поздняя стадия ВМД) — наличие ГА, затрагивающей центральную зону глазного дна.
Влажная форма ВМД (поздняя стадия ВМД):
- наличие ХНВ с различными проявлениями (интра- и (или) субретинальная жидкость и (или) неоваскулярная отслойка ПЭ, геморрагия, твердые (липидные) экссудаты и другие);
- рубцово-атрофические изменения в макуле (исход влажной формы ВМД).
Примечание.
* С использованием рекомендаций AREDS.
Миопическая ХНВ
Миопическая ХНВ (мХНВ) обладает рядом специфических признаков, отличающих ее от других подобных заболеваний, например от нВМД.
Для мХНВ характерны:
-
молодой возраст пациентов;
-
сопутствующие дегенеративные миопические изменения на глазном дне;
-
малые размеры самого очага ХНВ;
-
«классический» тип субретинальной неоваскулярной мембраны;
-
минимально выраженный отек сетчатки;
-
слабо выраженный геморрагический компонент в зоне поражения;
-
выраженный положительный ответ на антиангиогенную терапию в виде значительного улучшения зрительных функций при минимальной кратности интравитреальных инъекций32.
Лечение мХНВ
-
Anti-VEGF терапия32:
-
Ранибизумаб (одобрен к применению при мХНВ в РФ с 2014 года).
-
Афлиберцепт (одобрен к применению при мХНВ в РФ с 2017 года).
-
-
Лазерная коагуляция сетчатки:
-
Долгое время была единственным методом терапии.
-
Эффективна только при экстрафовеальных поражениях22.
-
Кратковременный эффект стабилизации остроты зрения22, 29, 30.
-
-
Хирургия (удаление СНМ / транслокация макулы):
-
Более не является предпочтительным методом терапии для большинства пациентов, поскольку существуют менее инвазивные способы лечения22.
-
В редких случаях может быть эффективна при фовеальном фиброзе или при отсутствии ответа на другие виды терапии22.
-
-
Фотодинамическая терапия (ФДТ):
-
В прошлом стандарт терапии.
-
Позволяет стабилизировать, но не улучшать остроту зрения22, 31.
-
Патогенез
Точный патогенез мХНВ на данный момент остается неизвестным, но существует несколько теорий22—28:
-
Механическая теория:
-
Прогрессивное/избыточное удлинение передне-заднего отрезка глаза.
-
Образование «лаковых трещин».
-
Дисрегуляция ангиогенных факторов (VEGF).
-
Стимуляция секреции VEGF пигментным эпителием за счет механического растяжения глаза.
-
-
Наследственно-дегенеративная теория:
-
Генетически детерминированное развитие патологической миопии.
-
-
Гемодинамическая теория:
-
Диффузное истончение хориоидеи и нарушение ее перфузии.
-
Развитие ишемии за счет снижения хориоидальной перфузии.
-
Дисбаланс факторов ангиогенеза (VEGF).
-
Диагностика
-
Осмотр глазного дна.
-
Флюоресцентная ангиография:
-
Основной метод диагностики мХНВ.
-
Оценка стадии и активности мХНВ.
-
Гиперфлюоресценция в ранней и промежуточной фазе и, в отличие от нВМД, минимальный ликедж в поздней фазе.
-
-
Ангиография с индоцианином зеленым.
-
Оптическая когерентная ангиография:
-
Основной метод диагностики мХНВ.
-
Гиперрефлективный очаг.
-
Имеет ограничения в ряде клинических ситуаций при мХНВ (например, тонкая хориоидея и минимальный ликедж) → необходимо сочетать с ФАГ.
-
-
Аутофлюоресценция.
Список сокращений:
AREDS — классификация по Age-Related Eye Disease Study;
VEGF — Vascular Endothelial Growth Factor, фактор роста эндотелия сосудов;
ВМД — возрастная макулярная дегенерация;
нВМД — неоваскулярная возрастная макулярная дегенерация;
ГА — географическая атрофия;
НЭ — нейроэпителий;
ПЭ — пигментный эпителий;
РАП — ретинальная ангиоматозная пролиферация;
РПЭ — ретинальный пигментный эпителий;
СНМ — субретинальная неоваскулярная мембрана;
ФАГ — флюоресцентная ангиография;
ФДТ — фотодинамическая терапия;
ХНВ — хориоидальная неоваскуляризация;
мХНВ — миопическая хориоидальная неоваскуляризация.
Источники:
- Wet AMD Progression and Treatment poster; The Angiogenesis Foundation. https://angio.org/ Дата обращения: 28 августа 2019 г.
- Stuart, A et al. BMJ Open 2015;5:e007746.
- Miller DG & Singerman LJ. Optom Vis Sci 2006;83:316-325.
- Carneiro, AM et al. Ophthalmologica 2011;225:81-88.
- Gass JDM. Am J Ophthalmol. 1994;118:285-98.
- Freund KB, et al. Retina. 2010;30:1333–1349.
- Penn JS, et al. Prog Retin Ey e Res. 2008; 27: 331-71.
- Gulati N, et al. Br J Ophthalmol 2011;95:162-165.
- Oh H, et al. Inv est Ophthalmol Vis Sci. 1999;40:1891-8.
- Adamis PA & Shima DT. Retina 2005; 25:111-8.
- Cohen SY, et al. Ophthalmology 1996;103:1241–1244.
- Rapid diagnosis in ophthalmology, Retina by Rogers, AH, and Duker, JS. Series ed. Duker JS and Macsai MS. 2008;pp 16-18. Elsev ier Inc.
- Wong TY, et al. Am J Ophthalmol 2014;157:9–25.
- Spaide RF. Curr Opin Ophthalmol 1999;10:177–81.
- T.Y .Y .Lai et al. Retina 38:1464–1477, 2018.
- Silv a R. Ophthalmologica 2012;228:197-213.
- Gao LQ, et al. Arch Ophthalmol 2011;129:1199-204.
- Liu HH, et al. Ophthalmology 2010;117:1763-8.
- Curtin BJ, Karlin DB. Trans Am Ophthalmol Soc 1970;68:312-34.
- Hayashi K, et al. Ophthalmology 2010;117:1595-611.
- Neelam K, et al. Prog Retin Ey e Res 2012;31:495-525.
- Ohno-Matsui K, et al. Br J Ophthalmol 2003 87:570-73.
- Tong J-P, et al. Am J Ophthalmol 2006;141:456-62.
- Kim YM, et al. Eye 2011;25:937-46.
- Seko Y , et al. Inv est Ophthalmol Vis Sci 1999; 40: 3287–3291.
- Kobay ashi T, Ikuno Y . Br J Ophthalmol 2010; 94: 611–615.
- Aky ol N. Can J Ophthalmol 1996; 31: 113–119.
- Virgili G, et al. Cochrane DatabaseSyst Rev 2005;4:Art. No.:CD004765.
- Parodi MB, et al. Arch Ophthalmol 2010;128:437-42.
- Blinder KJ, et al. Ophthalmology 2003;110:667-73.
- Mitry D, et al. Graefes Arch Clin Exp Ophthalmol 2012;250:3-13.
- А. Г. Щуко, Н. В. Зайцева, Т. Н. Юрьева и др. Влияние иммунологических факторов на механизмы формирования миопической хориоидальной неоваскуляризации. Вестник офтальмологии. 2016;132(5): 5-14.
11439823/RAN/DIG/06.25/0


