Источник: Kameda, H., Ishii, K., Kiriyama, J. et al. Secukinumab Persistence in Patients with Psoriatic Arthritis: An Adalimumab-Matched Retrospective Cohort Database Study (FLYWAY). Rheumatol Ther 12, 493–511 (2025). https://doi.org/10.1007/s40744–025–00749–7
Введение
Псориатический артрит (PsA) — это воспалительное, иммунно-опосредованное хроническое заболевание, поражающее различные системы, включая кожу и суставы1. Заболевание характеризуется прогрессирующим деструктивным процессом, часто приводящим к необратимому инвалидизирующему артриту2, с эпизодическими обострениями симптомов, ассоциированными с усилением воспалительной активности3. В Японии PsA диагностируется примерно у 10% пациентов с псориазом4.
С 2005 года внедрение биологических болезнь-модифицирующих противоревматических препаратов (bDMARDs), нацеленных на провоспалительные цитокины, ознаменовало новую эру в лечении PsA5. В настоящее время в Японии доступны bDMARDs, включающие ингибиторы фактора некроза опухоли-α (ФНО-α), моноклональные антитела к интерлейкину (ИЛ)-23, биспецифические антитела к ИЛ-23 и ИЛ-12, антитела к ИЛ-17A, антитела к ИЛ-17A и ИЛ-17F, а также антитела к рецептору ИЛ-17A. Наиболее часто используемыми bDMARDs в Японии являются адалимумаб (анти-ФНО-α) и секукинумаб (анти-ИЛ-17A)6.
Учитывая хронический характер заболевания, для сохранения целостности суставов и предотвращения прогрессирования требуется длительная терапия5. Однако соблюдение режима лечения представляет собой проблему из-за переносимости и приемлемости препаратов7, 8. Прерывание терапии приводит к быстрому обострению у большинства пациентов9, 10. Кроме того, смена bDMARD за исключением неэффективности должна осуществляться с осторожностью, так как может привести к потере эффективности, снижению удержания на терапии и перерывам в воздействии bDMARD, обусловленным необходимостью титрации дозы11, 12. Таким образом, удержание на терапии является важнейшим фактором эффективности лечения. Однако в реальной клинической практике удержание на bDMARDs, как правило, низкое, медианная продолжительность терапии редко превышает 2 года7, 13–15.
Понимание роли и оценка степени удержания необходима для обеспечения длительного клинического ответа. Тем не менее, большинство существующих исследований сосредоточено на ингибиторах ФНО-α или устекинумабе. Кроме того, существует ограниченное количество данных из реальной клинической практики в отношении секукинумаба14, 16, 17. Исключением является исследование SERENA, проведенное в 16 европейских странах, где удержание терапии секукинумабом через 12 месяцев составило 85,2%18.
В связи с этим в Японии было проведено крупное, ретроспективное, наблюдательное, когортное, продолжительное исследование с использованием базы данных медицинских страховых требований Medical Data Vision (MDV), с целью оценки удержания терапии на двух наиболее часто назначаемых bDMARDs: секукинумабе и адалимумабе. Первичной целью исследования была оценка 12-месячного удержания на секукинумабе. Вторичными целями являлись сравнение показателей удержания между сопоставленными когортами пациентов, получающих секукинумаб и адалимумаб, сравнение характеристик пациентов, оценка удержания в подгруппах по исходным данным, оценка полезности лечения и регистрация нежелательных явлений (НЯ), возникавших при применении секукинумаба и адалимумаба.
Методы
Дизайн исследования
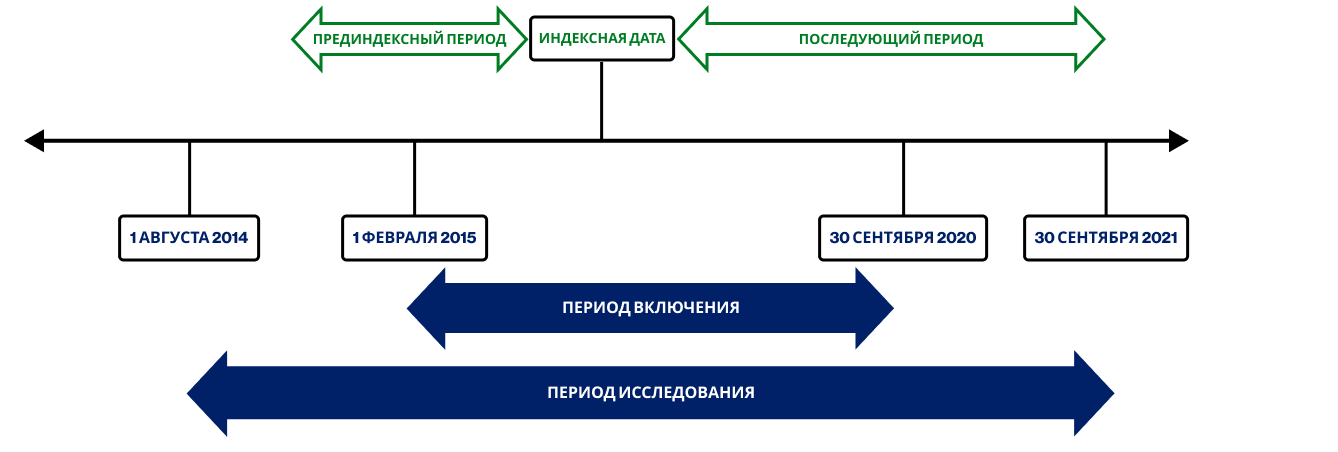
Общий период исследования охватывал временной интервал с 1 августа 2014 г. по 30 сентября 2021 г.. Из базы данных извлекались сведения обо всех пациентах с подтвержденным диагнозом псориатического артрита (PsA) в течение указанного периода. Индексной датой считалась дата первой выписки рецепта на секукинумаб или адалимумаб в пределах периода включения между 1 февраля 2015 года (дата запуска секукинумаба для лечения PsA в Японии) и 30 сентября 2020 года. Наблюдение за пациентами продолжалось от индексной даты до момента смерти, прекращения терапии интересующими препаратами или завершения периода наблюдения — в зависимости от того, что наступало первым. Также был определен 6-месячный ретроспективный период перед индексной датой для документирования диагноза PsA, сопутствующей патологии и предшествующего применения DMARD.
Дизайн исследования представлен на Рисунке 1.
Рисунок 1. Дизайн исследования
Источник данных
Данные были получены из базы MDV, предоставленной компанией Medical Data Vision Co., Ltd. (Токио, Япония). База была основана в 2003 году и охватывает более 400 стационаров для лечения острой патологии, использующих возмещение расходов по системе фиксированной оплаты Diagnosis Procedure Combination (DPC)19. На момент анализа в базе содержалась информация о более чем 42 миллионах индивидуальных пациентов. База включает стандартизированные записи обо всех медицинских услугах, предоставленных в учреждениях, входящих в систему MDV.
Переменные исследования
Демографические данные
Фиксировались возраст и пол пациента на индексную дату. Также регистрировались показатели роста и массы тела, наиболее близкие к индексной дате, на основании которых рассчитывался индекс массы тела (ИМТ). Определялось отделение медицинского учреждения, в которое обратился пациент в индексную дату.
Воздействие (экспозиция) и удержание на терапии
Началом воздействия считалась индексная дата. Каждое назначение препарата считалось действующим с даты назначения в течение периода, соответствующего продолжительности действия bDMARD в соответствии с инструкцией по применению (секукинумаб: 150 или 300 мг еженедельно до 4-й недели, затем ежемесячно; адалимумаб: 40 мг один раз в 2 недели с возможностью повышения дозы до 80 мг при недостаточном клиническом ответе). При перерыве более 120 дней между предполагаемым окончанием действия предыдущего назначения и началом следующего (или окончанием наблюдения) пациент считался прекратившим лечение. Датой прекращения считалась дата окончания последнего охваченного рецептом периода. Считалось, что пациент удерживается на терапии с индексной даты до даты прекращения.
Медицинский анамнез
Регистрировался интервал между первой зафиксированной в базе заявкой, связанной с PsA, и индексной датой. Следует учитывать, что первая заявка не всегда соответствует фактической дате установления диагноза, так как он мог быть поставлен в другом учреждении, не входящем в систему MDV. Также фиксировались сопутствующие заболевания, определенные на индексную дату или в течение ретроспективного периода, с использованием кодов МКБ-10.
Лечение
Фиксировались сопутствующие назначения, относящиеся к терапии PsA, в течение индексного месяца, включая пероральные и интраартикулярные глюкокортикостероиды, традиционные синтетические DMARDs (csDMARDs) и bDMARDs. Пациенты считались bDMARD-наивными при отсутствии назначений любого bDMARD, одобренного для лечения псориаза или PsA, в течение ретроспективного периода.
Полезность лечения
Терапия считалась полезной при соблюдении всех нижеперечисленных критериев в течение периода воздействия20:
(i) коэффициент обеспеченности медикаментами (MPR, Medication Possession Ratio) >80%21;
(ii) отсутствие перехода на другую терапию PsA;
(iii) отсутствие увеличения дозы;
(iv) отсутствие добавления csDMARD;
(v) отсутствие увеличения системной терапии глюкокортикоидами;
(vi) не более одной интраартикулярной инъекции глюкокортикоида спустя 90 дней после индексной даты.
Нежелательные явления
Регистрировались нежелательные явления, представляющие интерес, по кодам МКБ-10 в течение периода наблюдения. В частности, это воспалительные заболевания кишечника, анафилактические реакции, нейтропения, эритродермия (эксфолиативный дерматит). Также документировались подтвержденные серьезные инфекции, возникшие в период воздействия секукинумаба или адалимумаба. Серьезными считались инфекции, приведшие к госпитализации (как основная причина госпитализации либо как заболевание, обусловившее наибольшие затраты на лечение) или если пациент умер в больнице, где проходил лечение по поводу PsA. В таком случае фиксировалась дата смерти.
Статистическая обработка
Описательная статистика
Непрерывные переменные представлены как средние значения ± стандартное отклонение (СО) или как медианы с интерквартильным размахом [IQR], и сравнивались с использованием однофакторного дисперсионного анализа (ANOVA). Категориальные переменные представлены в виде абсолютных значений и процентов, и сравнивались с использованием χ²-критерия или критерия Фишера, в зависимости от применимости. За статистически значимое принималось значение p < 0,05. Все анализы проводились в SAS версии 9.4.
Удержание на терапии
Удержание оценивалось методом выживаемости Каплана-Мейера на временных точках 6, 12, 18, 24, 30 и 36 месяцев. Вычислялись медианные значения продолжительности удержания и 95% доверительные интервалы (CI). Сравнение между когортами секукинумаба и адалимумаба проводилось с использованием критерия лог-ранг (log-rank test).
Сопоставление по шкале склонности (Propensity Score Matching)
С целью уменьшения систематической ошибки включения и минимизации влияния ковариат, проводилось сопоставление по шкале склонности для когорт секукинумаба и адалимумаба22–24. Шкала рассчитывалась с использованием логистической регрессии на основе следующих исходных переменных: возраст, пол, время от постановки диагноза PsA, сопутствующая патология, сопутствующее лечение и предшествующий опыт применения bDMARDs. Для каждого пациента из когорты секукинумаба подбирался сопоставимый пациент из когорты адалимумаба по ближайшему соседу в пределах каллиперы, изначально установленной как 0,2 стандартного отклонения логит-преобразованной шкалы склонности. Сопоставление применялось для анализа удержания и полезности, но не для анализа нежелательных явлений.
Подгрупповой анализ
Удержание оценивалось в заранее определенных подгруппах: по полу, предыдущему лечению (bDMARD-наивные или ранее леченные), времени с момента первой заявки, связанной с PsA, и по отделению учреждения, в которое обратился пациент.
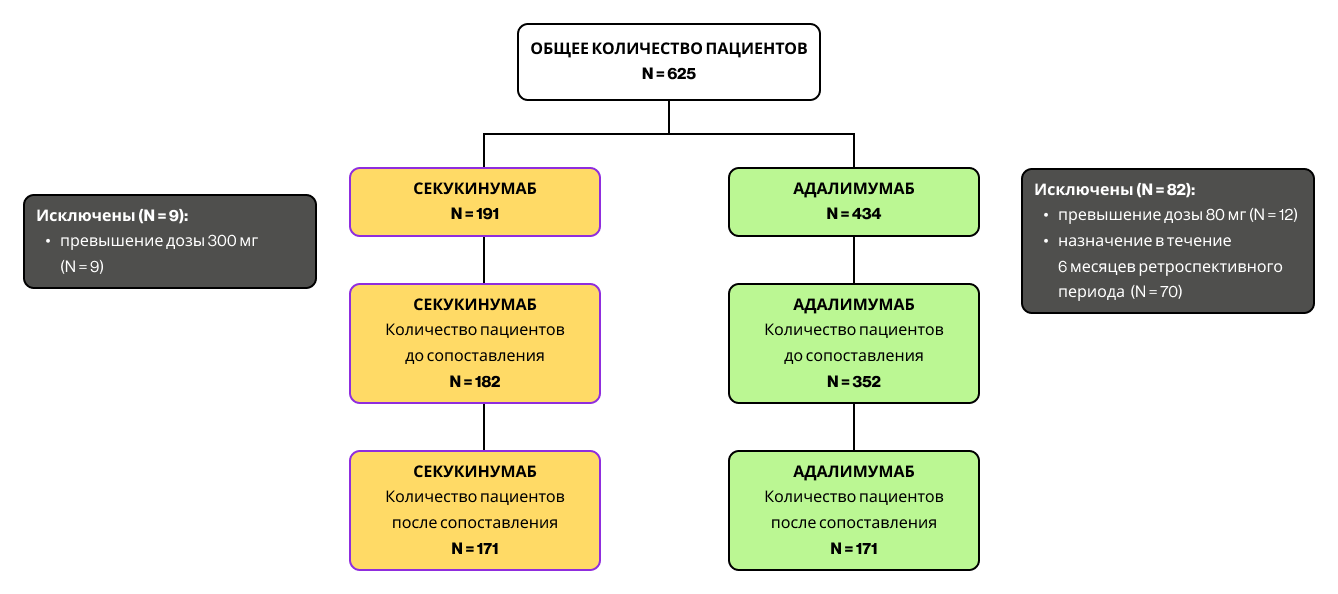
Рисунок 2. Диаграмма распределения пациентов
Этические аспекты
Исследование соответствовало всем применимым международным и японским нормативным актам в области медицинских исследований и защиты персональных данных, включая Хельсинкскую декларацию и Закон Японии о защите персональной информации. Согласно руководству Агентства по фармацевтике и медицинским изделиям Японии (PMDA) по фармакоэпидемиологическим исследованиям с использованием медицинских баз данных, этическое одобрение не требовалось, так как данные были анонимизированы и агрегированы поставщиком данных (в соответствии со статьей 2, пункт 6 Закона о защите персональной информации). Получение индивидуального согласия пациентов не требуется, так как база представляет собой административную систему с полностью анонимизированными данными, не позволяющими идентифицировать конкретных лиц.
Анализ «пограничных точек»
Для того, чтобы определить влияет ли время, прошедшее от начала лечения до редукции дозы рибоциклиба, на показатели ВБИЗ, был проведен анализ эффективности в нескольких временных точках: 3, 6 и 12 мес. В каждой точке из анализируемой популяции пациентов исключали тех, кто прекращал прием рибоциклиба, оставляя только тех, кто продолжал комбинированную терапию. Таких пациентов делили на две подгруппы — с редукцией дозы и без редукции дозы. В каждой подгруппе анализировали 3—летнюю ВБИЗ, рассчитывая этот показатель не от начала лечения, а от соответствующей пограничной точки. Анализ всех временных точек показал отсутствие отличий ВБИЗ в подгруппах с редукцией дозы и без редукции (табл. 3).
Результаты
Популяция исследования
В общей сложности в период включения были идентифицированы 625 пациентов с подтвержденным диагнозом псориатического артрита (PsA), получавших лечение секукинумабом или адалимумабом. Из них 534 пациента (85,4%) соответствовали критериям включения и вошли в основную популяцию анализа до сопоставления: 182 пациента получали секукинумаб, 352 — адалимумаб. Из этой выборки 171 пациент, начавший лечение секукинумабом, был сопоставлен с 171 пациентом, начавшим терапию адалимумабом. Диаграмма распределения пациентов приведена на Рисунке 2.
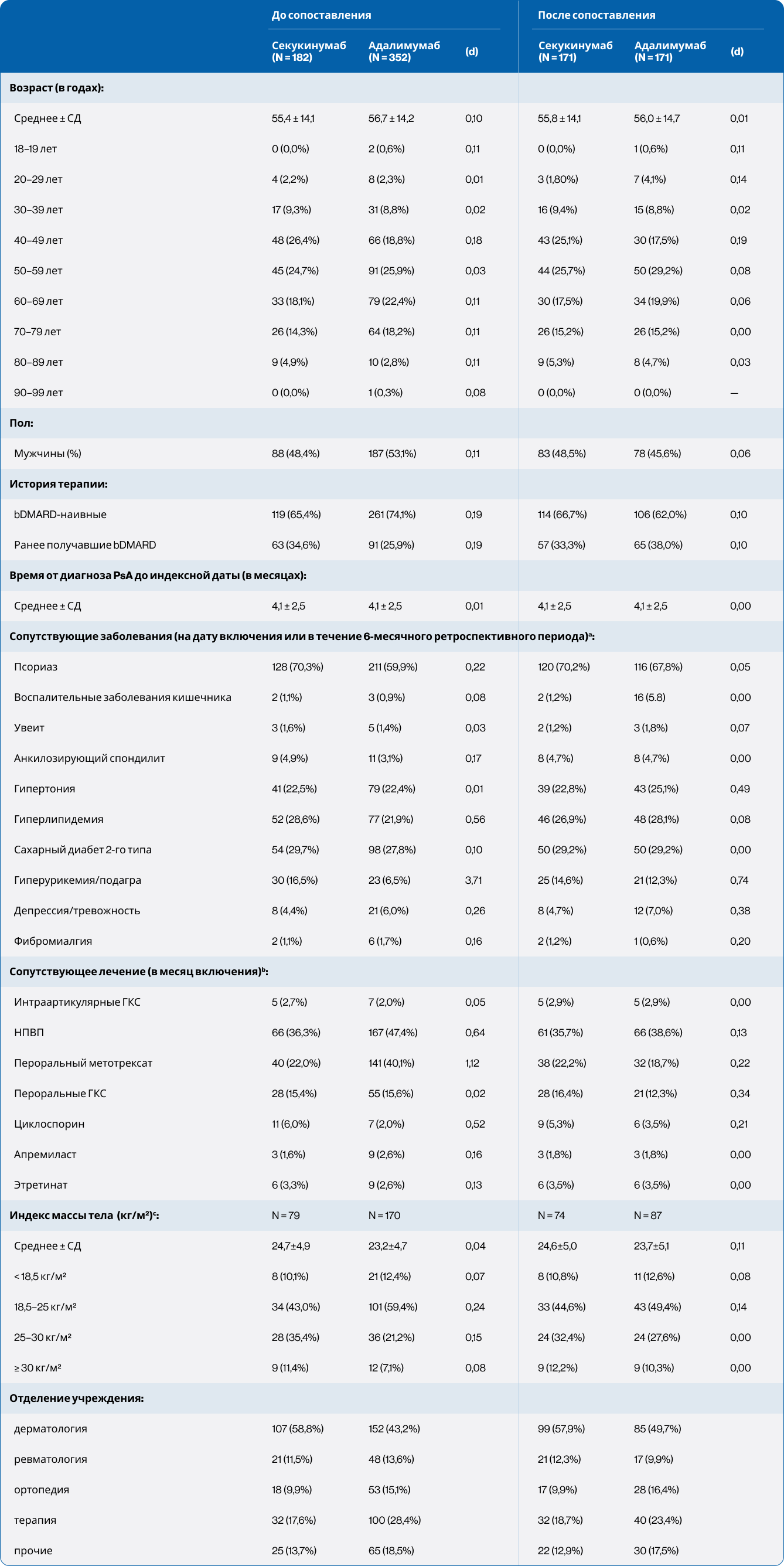
Характеристики пациентов на индексную дату до и после сопоставления представлены в Таблице 1. После сопоставления группы были сопоставимы (стандартизованное различие < 0,1) по большинству переменных, за исключением некоторых коморбидных состояний и сопутствующего лечения (см. Таблицу 1). Наблюдался некоторый дисбаланс по ИМТ, однако данный показатель не включался в расчет шкалы склонности ввиду значительного объема недостающих данных. Среднее время с момента первой заявки, связанной с PsA, составляло 4,1 ± 2,5 месяца; примерно две трети пациентов ранее не получали bDMARD, и около одной пятой одновременно получали метотрексат. Уровни С-реактивного белка (СРБ) на индексную дату были доступны менее чем у 10 пациентов в каждой когорте. Метотрексат назначался 70 пациентам: 38 в группе секукинумаба (22,2%) и 32 в группе адалимумаба (18,7%).
Таблица 1. Характеристики пациентов на индексную дату
bDMARD — биологические модифицирующие противоревматические препараты; (d) — стандартизованные различия; a — сопутствующие заболевания на индексную дату или в ретроспективный период; b — сопутствующее лечение в календарном месяце индексной даты; c — переменная не включена в сопоставление по шкале склонности из-за недостатка данных.
Удержание на терапии
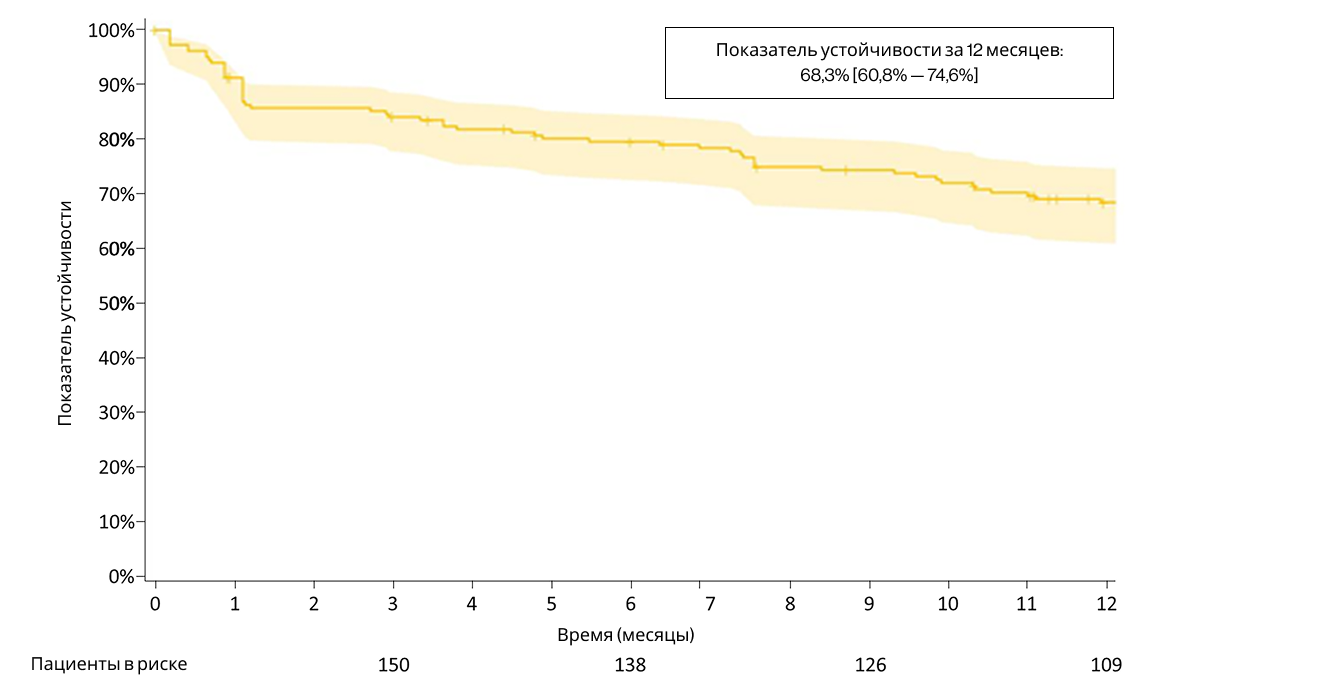
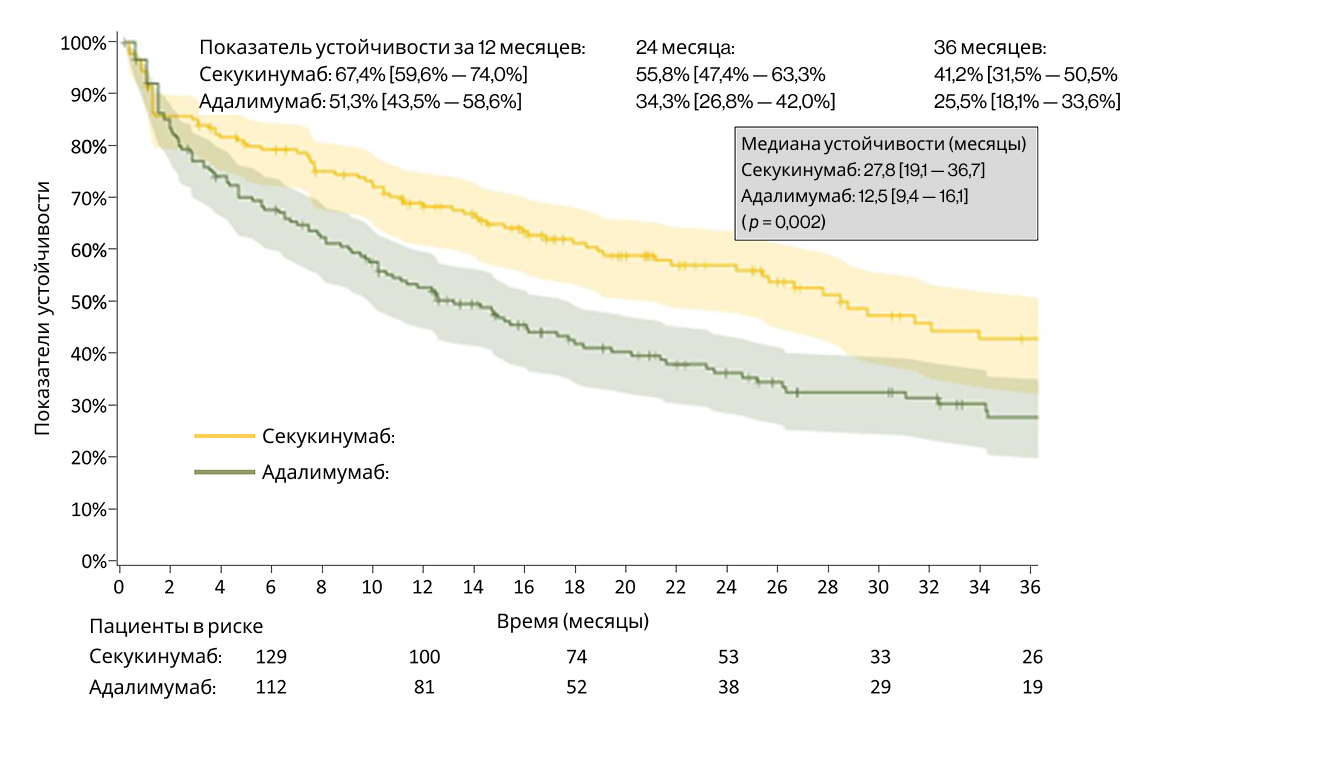
До сопоставления 12-месячное удержание в когорте секукинумаба составило 68,3% (95% ДИ: 60,8–74,6%) (Рисунок 3). После сопоставления 12-месячное удержание составило 67,4% (95% ДИ: 59,6–74,0%), а 36-месячное — 41,2% (95% ДИ: 31,5–50,5%) для секукинумаба. Для адалимумаба соответствующие показатели составили 51,3% (95% ДИ: 43,5–58,6%) и 25,5% (95% ДИ: 18,1–33,6%) соответственно (Рисунок 4). Удержание было достоверно выше в когорте секукинумаба по сравнению с когортой адалимумаба (p = 0,002; критерий лог-ранг). Анализ несопоставленных когорт дал схожие результаты: 12-месячное удержание на секукинумабе — 68,3% (95% ДИ: 60,8–74,6%), на адалимумабе — 51,3% (95% ДИ: 45,8–56,5%).
Рисунок 3. Удержание на терапии секукинумабом на 1 году (до сопоставления)
Данные представлены в виде кривой выживаемости по Каплану–Мейеру. Заштрихованная зона показывает 95% доверительный интервал оценки.
Удержание в подгруппах пациентов
Удержание и медианная продолжительность лечения были также оценены в ряде предопределенных подгрупп (Рисунок 5). Размеры выборок в некоторых подгруппах были ограничены. В большинстве подгрупп медианное удержание как для секукинумаба, так и для адалимумаба находилось в пределах 95% доверительных интервалов, рассчитанных для всей сопоставленной популяции.
Удержание было выше у пациентов, не получавших ранее bDMARD, по сравнению с теми, кто имел соответствующий опыт. Во всех подгруппах удержание в группе секукинумаба было выше, чем в группе адалимумаба, хотя не во всех случаях различия были статистически значимыми. Значимые различия (p < 0,05, лог-ранг тест) между группами наблюдались у женщин, у bDMARD-наивных пациентов, у bDMARD-наивных пациентов с первой заявкой по поводу PsA < 12 месяцев до индексной даты, а также у пациентов, наблюдавшихся в дерматологических или ревматологических отделениях. Следует отметить, что ни один из bDMARD-наивных пациентов не имел первой заявки по PsA более чем за 12 месяцев до индексной даты.
Рисунок 4. Удержание на секукинумабе и адалимумабе в течение 3 лет (после сопоставления)
Данные представлены в виде кривых выживаемости по Каплану–Мейеру. Заштрихованные зоны показывают 95% доверительные интервалы. Указаны медианные значения удержания с 95% доверительными интервалами.
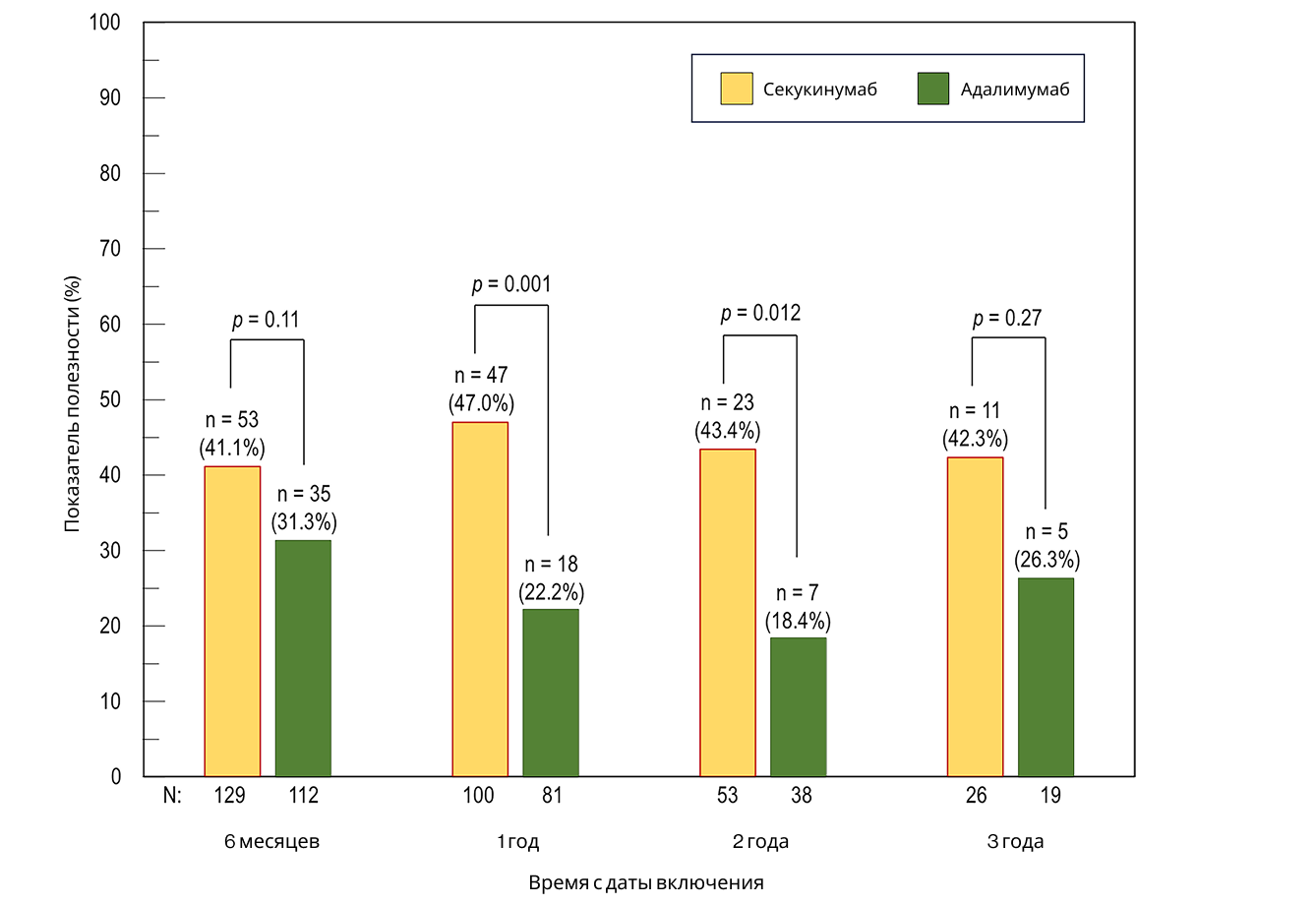
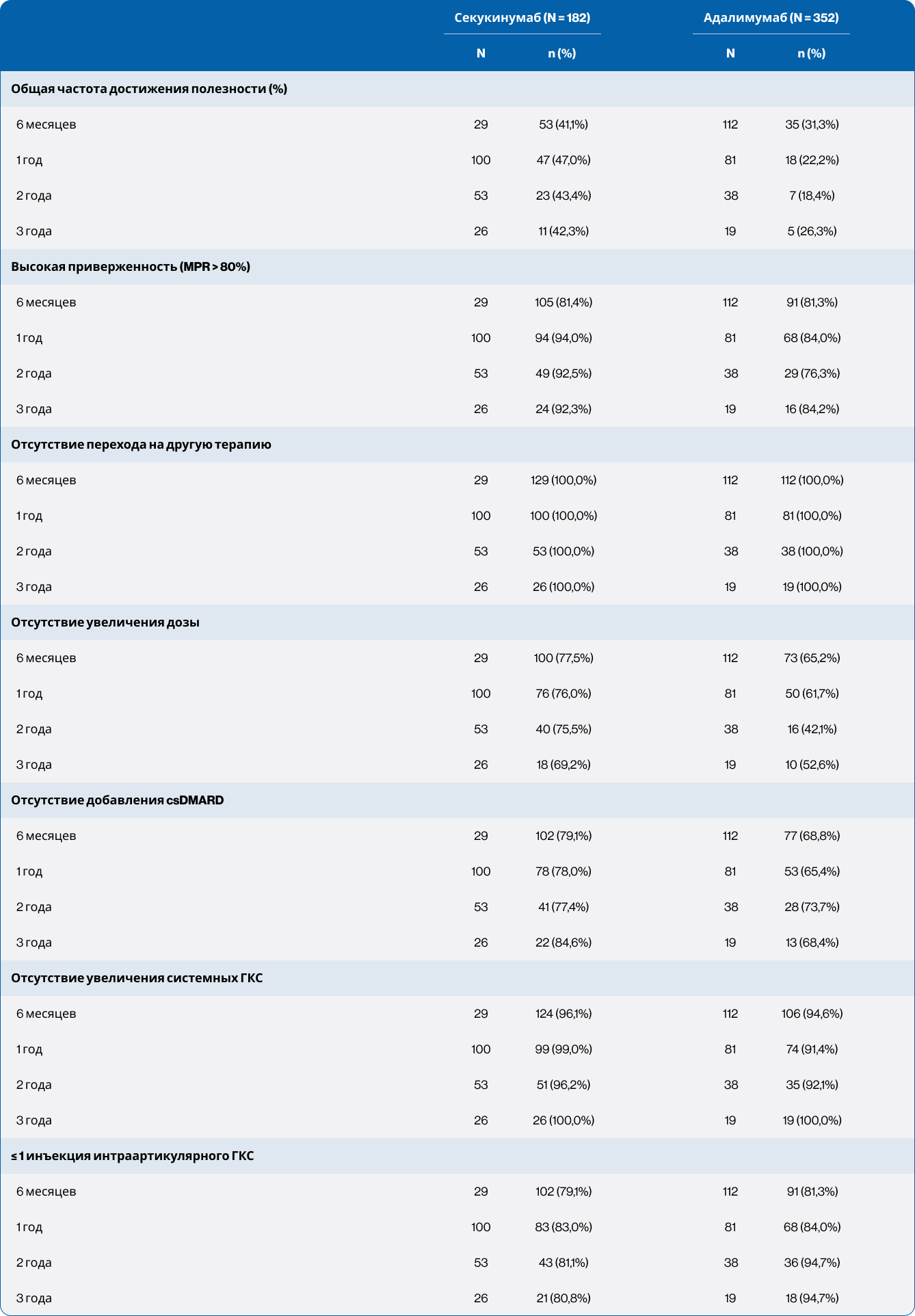
Полезность терапии
Доля пациентов, соответствующих определению полезности терапии (см. раздел «Методы»), варьировала от 41,1 до 47,0% в группе секукинумаба и от 18,4 до 31,3% в группе адалимумаба в зависимости от времени наблюдения (Рисунок 6). Существенные различия между группами наблюдались на 1-й и 2-й год после индексной даты. Информация по каждому из критериев полезности представлена в Таблице 2. Ни один пациент не переходил на альтернативную терапию PsA. В группе секукинумаба <5% пациентов (в группе адалимумаба <10%) увеличили дозу системных глюкокортикостероидов по сравнению с исходным уровнем на любом временном этапе; на 3-м году наблюдения увеличение не наблюдалось.
В каждый момент времени по меньшей мере треть пациентов, получавших адалимумаб, увеличивали дозу с 40 до 80 мг. Метотрексат был добавлен у 10 пациентов (5,8%) в группе секукинумаба и у 17 пациентов (9,9%) в группе адалимумаба в течение периода наблюдения.
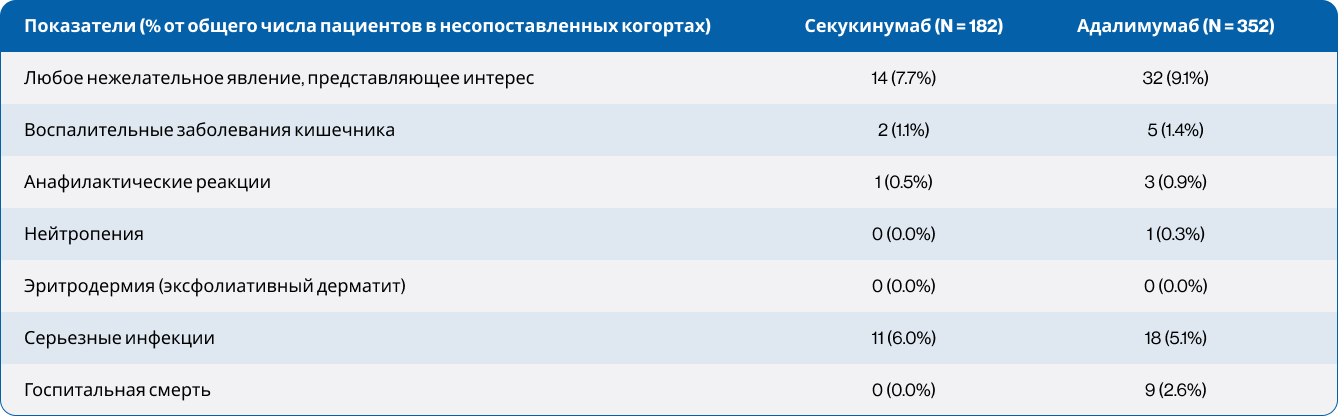
Нежелательные явления
В несопоставленных когортах 14 пациентов в группе секукинумаба (7,7%) и 32 пациента в группе адалимумаба (9,1%) сообщили о нежелательном явлении, представляющем интерес. Чаще всего это были серьезные инфекции (см. Таблицу 3).
Единственные серьезные инфекции, зафиксированные более чем у одного пациента, включали: сепсис, вызванный грамотрицательной палочкой (2 пациента в группе адалимумаба), бактериальная пневмония (по 1 пациенту в каждой группе), острые пневмонии (2 пациента в группе адалимумаба), и неспецифическая пневмония (3 пациента в группе адалимумаба).
При наличии идентификации возбудителя чаще всего выявлялись бактериальные инфекции; в одном случае отмечалась герпетическая инфекция (опоясывающий лишай).
У большинства пациентов (9 из 14 в группе секукинумаба и 12 из 32 в группе адалимумаба) нежелательные явления возникали в первые 6 месяцев лечения. Также в группе адалимумаба зарегистрировано 9 случаев госпитальной смерти по неуточненным причинам. В группе секукинумаба случаев смерти не зафиксировано.
Рисунок 5. Медианная продолжительность персистентности в подгруппах пациентов.
Медианные значения удержания указаны с 95% доверительными интервалами.
Желтые символы: секукинумаб
Зеленые символы: адалимумаб
Черные стрелки указывают, что верхняя граница доверительного интервала не может быть рассчитана
Светло-желтая зона — 95% ДИ медианного удержания на секукинумабе в общей популяции
Светло-зеленая зона — 95% ДИ медианного удержания на адалимумабе в общей популяции
Под точками указано количество пациентов в каждой подгруппе
bDMARD — биологические модифицирующие противоревматические препараты
Обсуждение
Настоящее исследование, выполненное на основании данных из базы данных Medical Data Vision Co., Ltd. (MDV) в Японии, позволило оценить 12-месячное удержание на терапии секукинумабом у пациентов с псориатическим артритом (PsA), которое составило 68,3% (95% ДИ: 60,8–74,6%). Было показано, что удержание на терапии секукинумабом была выше, чем при применении адалимумаба (p = 0,002, лог-ранг тест). Кроме того, частота достижения полезности терапии также была выше в группе секукинумаба по сравнению с группой адалимумаба.
К числу сильных сторон настоящего исследования относится сравнительно большое количество пациентов, получавших секукинумаб и адалимумаб, а также регистрация множества исходов (удержание, полезность и безопасность) в одной и той же популяции. Период наблюдения (3 года) был относительно продолжительным по сравнению с предыдущими исследованиями и охватывал весь период, в течение которого оба препарата находились в клиническом обращении в Японии. Кроме того, для формирования сопоставимых когорт лечения применялась методология сопоставления по шкале склонности, что позволило минимизировать систематическую ошибку, связанную с ковариатами при сравнении двух когорт.
Демографические характеристики и история терапии включенных пациентов соответствуют типичной популяции с псориатическим артритом. Более половины пациентов наблюдались в дерматологических отделениях, что отражает особенности клинической практики в Японии, где именно дерматологи, как правило, устанавливают диагноз PsA и ведут таких пациентов.
Рисунок 6. Полезность секукинумаба и адалимумаба в течение 3 лет (после сопоставления)
Определение полезности приведено в разделе «Методы» для определения полезности. Данные представлены в процентах на временных точках (6 мес., 1 год, 2 года, 3 года).
Полученные в настоящем исследовании данные об удержании на секукинумабе можно сопоставить с результатами других публикаций17, 18, 25–30, в которых 12-месячное удержание на секукинумабе составляло от 63,2% (в Израиле25 и Японии17) до 85,2% (в многонациональном проспективном когортном исследовании SERENA18). Несмотря на различия в дизайне исследований и определениях удержания, результаты из разных стран демонстрируют высокую степень согласованности. Все эти данные подчеркивают эффективность секукинумаба в широком географическом контексте и подтверждают его актуальность в лечении PsA по всему миру. Следует также отметить, что в предыдущем японском многоцентровом когортном исследовании RAILWAY у пациентов с псориазом 12-месячное удержание на секукинумабе составило 78,0% (95% ДИ: 69,6–84,4%)31.
Таблица 2. Критерии полезности на протяжении периода наблюдения (после сопоставления)
csDMARD — традиционные синтетические модифицирующие противоревматические препараты
Таблица 3. Нежелательные явления, представляющие интерес, на протяжении всего периода наблюдения (до сопоставления)
- Выявлено преимущество секукинумаба в удержании по сравнению с адалимумабом, что согласуется с результатами ряда других исследований при PsA25, 29, 32, 33, а также при псориазе в целом32–34, в которых сравнивались эти два bDMARD. Более того, в рандомизированном клиническом исследовании EXCEED, сравнивавшем секукинумаб и адалимумаб, также была показана более высокое удержание при применении секукинумаба (86% против 76%)35. Однако следует отметить, что не во всех исследованиях выявлены различия в удержании между этими препаратами14, 28, 36, 37.
- В настоящем исследовании оценивались только определенные нежелательные явления, уже ранее ассоциированные с bDMARD. Частота таких событий была относительно низкой (<10%) в обеих группах, что соответствует результатам исследования EXCEED35. Однако в группе адалимумаба были зафиксированы 9 случаев смерти в условиях стационара (в группе секукинумаба — ни одного). Возможно, меньшая смертность и более низкая частота нежелательных явлений при применении секукинумаба указывает на лучшую переносимость, что могло способствовать более высокого удержания. Однако из-за малой численности такие различия трудно интерпретировать. При этом нельзя считать, что переносимость — единственная причина различий в удержании. В исследовании EXCEED профили безопасности секукинумаба и адалимумаба были схожими. Следовательно, возможно, что снижение эффекта из-за образования нейтрализующих антител проявляется в различной степени между этими двумя моноклональными антителами в связи с их разной иммуногенностью38.
- Во многих проанализированных подгруппах уровень удержания соответствовал показателям в основной популяции, а у пациентов, получавших секукинумаб, он оставался выше, чем у пациентов на терапии адалимумабом. Однако различия не всегда были статистически значимыми, что, вероятно, связано с малыми размерами выборок и недостаточной статистической мощностью. Удержание было выше у bDMARD-наивных пациентов по сравнению с ранее леченными, что подтверждается другими публикациями по секукинумабу и другим bDMARD13, 17, 36, 39.
- В отличие от ряда предыдущих исследований33, 36, 39–41, не было выявлено различий в удержании между мужчинами и женщинами. Удержание было существенно ниже у пациентов, наблюдавшихся в отделениях, не относящихся к числу профильных по PsA (дерматология, ревматология, ортопедия, терапия). В недавнем перекрестном опросе врачей в Японии42 были выявлены различия в ведении PsA между различными клиническими отделениями. Таким образом, этот неожиданный результат может свидетельствовать о меньшей информированности врачей непрофильных специальностей о рисках нелечения PsA и важности удержания, по сравнению с отделениями, регулярно ведущими пациентов с PsA43.
- Полезность терапии также была выше в группе секукинумаба по сравнению с адалимумабом. Полезность представляет собой составной показатель приверженности и необходимости интенсификации терапии20, и может рассматриваться как суррогатный маркер эффективности и переносимости, что трудно оценить при анализе административных баз данных. В Японии допускается увеличение дозы адалимумаба с 40 мг до 80 мг при недостаточной эффективности. Через 3 года лечения увеличение дозы было выполнено у 47,4% пациентов. В случае с секукинумабом инструкция по применению в Японии рекомендует полную дозу 300 мг, за исключением пациентов с дефицитной массой тела, у которых допустима доза 150 мг.
- Основным ограничением, присущим таким исследованиям, является ограниченная клиническая информация, доступная в базе данных MDV. В частности, нет информации о тяжести заболевания или активности, которая позволила бы вычислить стандартные составные показатели, такие как индекс активности заболевания псориатического артрита (DAPSA) или статус минимальной активности заболевания (MDA). Наличие таких индексов было бы полезно, во‑первых, для включения в оценку склонности, чтобы гарантировать, что группы секукинумаба и адалимумаба были адекватно сопоставлены по активности заболевания, а во‑вторых, для оценки того, сколько пациентов фактически достигли ремиссии или низкой активности заболевания при лечении каждым из препаратов. Кроме того, не были документированы причины прекращения приема bDMARD. В предыдущих исследованиях отсутствие эффективности было основной причиной прекращения приема bDMARD7, 13, 16, но это невозможно оценить в настоящем исследовании. Смертность, вероятно, недооценена, поскольку документируются только случаи смерти в больницах, участвующих в MDV.
- Неблагоприятные события также могут быть недооценены, если пациенты лечились в другой больнице; например, пациенты, испытывающие анафилактический шок, скорее всего, будут лечиться в ближайшей больнице, которая может быть не той, где они лечатся от PsA. Напротив, если пациент лечится в двух разных больницах, существует риск того, что он будет включен в исследование дважды, или что дата первоначального диагноза PsA не будет указана правильно. Наконец, размер популяции исследования недостаточен для изучения удержания в определенных подгруппах пациентов (например, у пациентов с сопутствующим метотрексатом), а некоторые детерминанты удержания на bDMARD (включая тяжесть заболевания44) не задокументированы в базе данных MDV.
Заключение
Таким образом, проведенное исследование показало, что 12-месячное удержание на терапии секукинумабом у пациентов с PsA в условиях реальной клинической практики в Японии составило 68,3%, а медианная продолжительность удержания достигала 27,8 месяцев. После сопоставления когорт по шкале склонности выяснилось, что доля пациентов, сохранявших терапию секукинумабом, была в два раза выше, чем аналогичный показатель для адалимумаба.
Однако, с учетом того, что PsA представляет собой хроническое прогрессирующее заболевание, врачи должны прилагать усилия к тому, чтобы пациенты продолжали начатую терапию так долго, как она остается эффективной. Тем не менее, необходимо также обеспечить наличие альтернативных терапевтических опций, которые могут быть быстро назначены в случае необходимости прекращения лечения секукинумабом.
Список литературы
- FitzGerald O, Ogdie A, Chandran V, Coates LC, Kavanaugh A, Tillett W, et al. Psoriatic arthritis. Nat Rev Dis Prim. 2021;7(1):59.
- Gladman DD, Antoni C, Mease P, Clegg DO, Nash P. Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Ann Rheum Dis. 2005;64(Suppl 2):ii14–7.
- Sousa M, Lubrano E, Smolen JS, Gorlier C, de Wit M, Coates LC, et al. Patient-defined flares and disease activity worsening in 222 patients with psoriatic arthritis from 14 countries. Jt Bone Spine. 2023;90(3): 105511.
- Umezawa Y. Psoriatic arthritis. J Dermatol. 2021;48(6):741–9.
- Van den Bosch F, Coates L. Clinical management of psoriatic arthritis. Lancet. 2018;391(10136):2285–94.
- Tsuruta N, Imafuku S. Establishment of the Western Japan Psoriasis Registry and first cross-sectional analysis of registered patients. J Dermatol. 2021;48(11):1709–18.
- Menter A, Papp KA, Gooderham M, Pariser DM, Augustin M, Kerdel FA, et al. Drug survival of biologic therapy in a large, disease-based registry of patients with psoriasis: results from the Psoriasis Longitudinal Assessment and Registry (PSOLAR). J Eur Acad Dermatol Venereol. 2016;30(7):1148–58.
- Cao Z, Carter C, Wilson KL, Schenkel B. Ustekinumab dosing, persistence, and discontinuation patterns in patients with moderate-to-severe psoriasis. J Dermatol Treat. 2015;26(2):113–20.
- Araujo EG, Finzel S, Englbrecht M, Schreiber DA, Faustini F, Hueber A, et al. High incidence of disease recurrence after discontinuation of disease-modifying antirheumatic drug treatment in patients with psoriatic arthritis in remission. Ann Rheum Dis. 2015;74(4):655–60.
- Moverley A, Coates L, Marzo-Ortega H, Waxman R, Torgerson D, Cocks K, et al. A feasibility study for a randomised controlled trial of treatment withdrawal in psoriatic arthritis (REmoval of treatment for patients in REmission in psoriatic ArThritis (RETREAT (F)). Clin Rheumatol. 2015;34(8):1407–12.
- Costa L, Perricone C, Chimenti MS, Del Puente A, Caso P, Peluso R, et al. Switching between biological treatments in psoriatic arthritis: a review of the evidence. Drugs R&D. 2017;17(4):509–22.
- Merola JF, Lockshin B, Mody EA. Switching biologics in the treatment of psoriatic arthritis. Semin Arthritis Rheum. 2017;47(1):29–37.
- Gossec L, Siebert S, Bergmans P, de Vlam K, Gremese E, Joven-Ibáñez B, et al. Long-term effectiveness and persistence of ustekinumab and TNF inhibitors in patients with psoriatic arthritis: final 3-year results from the PsABio real-world study. Ann Rheum Dis. 2023;82(4):496–506.
- Inui K, Sato M, Esterberg E, Parikh RC, Kimura S, Torisu-Itakura H. Treatment practices and costs among patients with psoriatic arthritis: a Japanese hospital claims database analysis. Mod Rheumatol. 2021;31(6):1179–91.
- Ballegaard C, Hojgaard P, Dreyer L, Cordtz R, Jorgensen TS, Skougaard M, et al. Impact of comorbidities on tumor necrosis factor inhibitor therapy in psoriatic arthritis: a population-based cohort study. Arthritis Care Res. 2018;70(4):592–9.
- Bayaraa B, Imafuku S. Sustainability and switching of biologics for psoriasis and psoriatic arthritis at Fukuoka University Psoriasis Registry. J Dermatol. 2019;46(5):389–98.
- Wang C, Torisu-Itakura H, Hanada T, Matsuo T, Cai Z, Osaga S, et al. Treatment persistence of interleukin-17 inhibitor class drugs among patients with psoriasis in Japan: a retrospective database study. J Dermatol Treat. 2023;34(1):2229465.
- Kiltz U, Sfikakis PP, Gaffney K, Bounas A, Gullick N, Lespessailles E, et al. Interim 2-year analysis from SERENA: a real-world study in patients with psoriatic arthritis or ankylosing spondylitis treated with secukinumab. Rheumatol Ther. 2022;9(4):1129–42.
- Nakamura M. Utilization of MDV data and data quality control. Jpn J Pharmacoepidemiol. 2016;21(1):23–5.
- Zhang H, Wen J, Alexander GC, Curtis JR. Comparative effectiveness of biologics and targeted therapies for psoriatic arthritis. RMD Open. 2021;7(1).
- Andrade SE, Kahler KH, Frech F, Chan KA. Methods for evaluation of medication adherence and persistence using automated databases. Pharmacoepidemiol Drug Saf. 2006;15(8):565–74 (discussion 75–7).
- Granger E, Watkins T, Sergeant JC, Lunt M. A review of the use of propensity score diagnostics in papers published in high-ranking medical journals. BMC Med Res Methodol. 2020;20(1):132.
- Rosenbaum PR, Rubin DB. The central role of the propensity score in observational studies for causal effects. Biometrika. 1983;70(1):41–55.
- Stuart EA. Matching methods for causal inference: a review and a look forward. Stat Sci. 2010;25(1):1–21.
- Haddad A, Gazitt T, Feldhamer I, Feld J, Cohen AD, Lavi I, et al. Treatment persistence of biologics among patients with psoriatic arthritis. Arthritis Res Ther. 2021;23(1):44.
- Alegre-Sancho JJ, Núñez-Monje V, Campos-Fernández C, Balaguer-Trull I, Robustillo-Villarino M, Aguilar-Zamora M, et al. Real-world effectiveness and persistence of secukinumab in the treatment of patients with psoriatic arthritis. Front Med. 2023;10:1294247.
- Joven B, Manteca CF, Rubio E, Raya E, Pérez A, Hernández R, et al. Real-world persistence and treatment patterns in patients with psoriatic arthritis treated with anti-IL17 therapy in Spain: the PerfIL–17 Study. Adv Ther. 2023;40(12):5415–31.
- Perrone V, Losi S, Filippi E, Mezzetti M, Dovizio M, Sangiorgi D, et al. Analysis of the pharmacoutilization of biological drugs in psoriatic arthritis patients: a real-world retrospective study among an Italian population. Rheumatol Ther. 2022;9(3):875–90.
- Oelke KR, Chambenoit O, Majjhoo AQ, Gray S, Higgins K, Hur P. Persistence and adherence of biologics in US patients with psoriatic arthritis: analyses from a claims database. J Comp Effect Res. 2019;8(8):607–21.
- Ruscitti P, Pantano I, Perrotta FM, Celletti E, Volpe P, Ciliento MS, et al. The assessment of the drug retention rate of secukinumab in patients with psoriatic arthritis in a real-life multicentre cohort. Clin Exp Rheumatol. 2024;42(1):69–76.
- Tada Y, Morita A, Yamanaka K, Kono M, Imafuku S, Okubo Y, et al. Real-world retention rates and effectiveness of secukinumab in psoriasis: results from a multicenter cohort study (RAILWAY). J Dermatol. 2023;50(11):1415–26.
- Sruamsiri R, Iwasaki K, Tang W, Mahlich J. Persistence rates and medical costs of biological therapies for psoriasis treatment in Japan: a real-world data study using a claims database. BMC Dermatol. 2018;18(1):5.
- Oh S, Choi S, Yoon HS. Available alternative biologics and disease groups influence biologic drug survival in patients with psoriasis and psoriatic arthritis. Ann Dermatol. 2022;34(5):321–30.
- Yiu ZZN, Becher G, Kirby B, Laws P, Reynolds NJ, Smith CH, et al. Drug survival associated with effectiveness and safety of treatment with guselkumab, ixekizumab, secukinumab, ustekinumab, and adalimumab in patients with psoriasis. JAMA Dermatol. 2022;158(10):1131–41.
- McInnes IB, Behrens F, Mease PJ, Kavanaugh A, Ritchlin C, Nash P, et al. Secukinumab versus adalimumab for treatment of active psoriatic arthritis (EXCEED): a double-blind, parallel-group, randomised, active-controlled, phase 3b trial. Lancet. 2020;395(10235):1496–505.
- Geale K, Lindberg I, Paulsson EC, Wennerström ECM, Tjärnlund A, Noel W, et al. Persistence of biologic treatments in psoriatic arthritis: a population-based study in Sweden. Rheumatol Adv Pract. 2020;4(2):rkaa070.
- Lindstrom U, Glintborg B, Di Giuseppe D, Schjodt Jorgensen T, Gudbjornsson B, Lederballe Gron K, et al. Comparison of treatment retention and response to secukinumab versus tumour necrosis factor inhibitors in psoriatic arthritis. Rheumatology. 2021;60(8):3635–45.
- Strand V, Balsa A, Al-Saleh J, Barile-Fabris L, Horiuchi T, Takeuchi T, et al. Immunogenicity of biologics in chronic inflammatory diseases: a systematic review. BioDrugs Clin Immunother Biopharm Gene Ther. 2017;31(4):299–316.
- Harrold LR, Stolshek BS, Rebello S, Collier DH, Mutebi A, Wade SW, et al. Impact of prior biologic use on persistence of treatment in patients with psoriatic arthritis enrolled in the US Corrona registry. Clin Rheumatol. 2017;36(4):895–901.
- Stober C, Ye W, Guruparan T, Htut E, Clunie G, Jadon D. Prevalence and predictors of tumour necrosis factor inhibitor persistence in psoriatic arthritis. Rheumatology. 2018;57(1):158–63.
- Glintborg B, Ostergaard M, Dreyer L, Krogh NS, Tarp U, Hansen MS, et al. Treatment response, drug survival, and predictors thereof in 764 patients with psoriatic arthritis treated with anti-tumor necrosis factor alpha therapy: results from the nationwide Danish DANBIO registry. Arthritis Rheum. 2011;63(2):382–90.
- Asahina A, Minami Y, Kameda H. A cross-sectional questionnaire survey involving physicians for the clarification of the diagnosis and current status of therapeutic intervention of psoriatic arthritis in Japan. J Dermatol. 2024;51(2):261–70.
- Saeki H, Mabuchi T, Asahina A, Abe M, Igarashi A, Imafuku S, et al. English version of Japanese guidance for use of biologics for psoriasis (the 2022 version). J Dermatol. 2023;50(2):e41–68.
- Rida MA, Lee KA, Chandran V, Cook RJ, Gladman DD. Persistence of biologics in the treatment of psoriatic arthritis: data from a large hospital-based longitudinal cohort. Arthritis Care Res. 2023;75(10):2174–81.
11471628/SEC/web/07.25/0