Источник: Ruscitti P, et al. The assessment of the drug retention rate of secukinumab in patients with psoriatic arthritis in a real-life multicentre cohort. Clin Exp Rheumatol. 2024 Jan;42(1):69-76. doi: 10.55563/clinexprheumatol/tpp63h. Epub 2023 Jul 24. PMID: 37497733.
Введение
- Псориатический артрит (ПсА) — это хроническое заболевание, характеризующееся распространенными воспалительными поражениями опорно-двигательного аппарата у пациентов с псориазом1. ПсА отличается гетерогенной клинической картиной и разнообразием течения заболевания2,3. Однако у многих пациентов может развиваться деструктивная форма артрита, что приводит к выраженной заболеваемости и значительной инвалидизации1–5. Помимо особенностей самого заболевания, ПсА часто сопровождается сопутствующими состояниями, которые могут усиливать тяжесть болезни и ухудшать ее прогноз со временем6,7.
- Что касается патогенеза, механизмы, приводящие к развитию ПсА, до конца не выяснены8. Предполагается сложное взаимодействие индивидуальной генетической предрасположенности, факторов окружающей среды и нарушенного иммунного ответа в индукции заболевания9,10. В этом контексте многочисленные исследования недавно подчеркнули патогенную роль интерлейкина (IL)-17A при ПсА11,12. Это провоспалительный цитокин, функционирующий в рамках сложной сети цитокинов11,12. Сигнализация IL–17A приводит к продукции воспалительных цитокинов и хемокинов, а также к активации клеток-мишеней, несущих рецепторы IL–17, включая фибробласты, эпителиальные клетки и синовиоциты11,12.
- На основе этих данных в последнее время для лечения ПсА начали использовать ингибиторы IL–17A13. Среди этих препаратов секукинумаб, моноклональное антитело IgG1-κ против IL–17A, уже одобрен для лечения данной группы пациентов14,15. Убедительные доказательства, полученные в рандомизированных клинических исследованиях, продемонстрировали эффективность секукинумаба в отношении различных проявлений заболевания16–19. Поэтому как рекомендации EULAR, так и GRAPPA по ведению пациентов с ПсА в последнее время предлагают назначение ингибиторов IL–17 у пациентов, которые не отвечают на терапию первой линии20,21.
- Однако, хотя рандомизированные клинические исследования предоставляют объективную оценку сравнительной эффективности между группами лечения и контроля, строгие критерии включения могут ограничивать обобщение их результатов, так как популяции пациентов в рамках исследований часто не полностью представляют тех, кого врачи встречают в реальной клинической практике22. Поэтому исследования, основанные на реальной практике, могут дать важную информацию о влиянии терапии в более гетерогенных клинических условиях, где у многих пациентов имеются сопутствующие заболевания или иные особенности, влияющие на ведение23,24.
- Уровень удержания терапии (drug retention rate, DRR) является признанным методом для оценки эффективности лечения в когортах пациентов из клинической практики путем анализа продолжительности применения терапии с течением времени. В контексте ПсА лишь немногие исследования изучали эффективность секукинумаба в реальной клинической практике26–28. Кроме того, влияние сопутствующих заболеваний на DRR секукинумаба еще не было полноценно исследовано29–31.
- Исходя из этого, целью исследования было оценить DRR секукинумаба у пациентов с ПсА в когорте реальной клинической практики. Мы также изучили влияние сопутствующих заболеваний на DRR секукинумаба и стратифицировали результаты в зависимости от клинических характеристик пациентов.
Методы
Дизайн исследования, пациенты и условия проведения
Было проведено ретроспективное исследование с участием пациентов, наблюдавшихся проспективно, с целью оценки уровня удержания терапии (DRR) секукинумабом, а также влияния сопутствующих заболеваний и клинических характеристик пациентов. В анализ были включены пациенты с ПсА, соответствующие критериям CASPAR (32) и посещавшие амбулаторные клиники центров-участников, если они получали лечение секукинумабом в течение как минимум 3 месяцев в период с января 2016 года по июнь 2022 года.
Оцениваемые параметры
- Уровень удержания терапии секукинумабом оценивался по количеству месяцев лечения. Причины прекращения терапии секукинумабом регистрировались, включая неэффективность и/или побочные эффекты. На момент начала терапии секукинумабом собирались следующие демографические и клинические данные: возраст, пол, масса тела, рост, длительность заболевания и клинические проявления (например, периферическое, аксиальное, энтезное поражение, признаки дактилита, поражение кожи и/или ногтей, внесуставные проявления). Также фиксировалось наличие сопутствующих заболеваний, которые определялись как медицинские состояния, отличные от основного диагноза, по которому пациент был включен в исследование.
- Сопутствующие заболевания определялись на основе данных из медицинских карт, интервью и всесторонних медицинских обследований пациентов. Кроме того, сопутствующие состояния идентифицировались с учетом проводимой пациентам терапии, как это применялось в других исследованиях33,34. Пациент считался имеющим кардиометаболическую мультиморбидность, если у него выявлялись два или три из следующих факторов: артериальная гипертензия (АГ), сахарный диабет 2 типа (СД2) и/или дислипидемия. Этот подход использовался, поскольку кардиометаболическая мультиморбидность (≥2 из 3 факторов риска) может рассматриваться как клиническая особенность, отличающаяся от наличия одной кардиометаболической коморбидности, что было показано в других исследованиях35. Ожирение и тяжелое ожирение определялись как индекс массы тела (ИМТ) ≥30 и ≥35, соответственно.
- Наконец, фиксировались длительность терапии секукинумабом в месяцах, линии терапии биологическими болезньмодифицирующими противоревматическими препаратами (bDMARD), причины прекращения лечения (например, неэффективность, побочные эффекты), одновременное использование глюкокортикостероидов (ГКС), синтетических болезньмодифицирующих противоревматических препаратов (csDMARD) и нестероидных противовоспалительных препаратов (НПВП).
Источники данных, смещения и размер исследования
- Данные собирались ретроспективно путем анализа медицинских карт, зарегистрированных во время плановых визитов каждого пациента. Все клинические данные, записанные с января 2016 года по июнь 2022 года, были полностью анонимизированы до их использования. Сбор данных проводился с июня 2022 года по ноябрь 2022 года через анализ медицинских карт, хранившихся в каждом центре-участнике. Все результаты, полученные в ходе анализа, включены в настоящее исследование.
- Учитывая ретроспективный дизайн, исследование может быть подвержено ряду возможных смещений. Пациенты с существенными пробелами в данных, которые были сочтены значимыми для анализа, исключались из исследования. Кроме того, с учетом ретроспективного характера и целей «реальной практики», точный размер выборки не оценивался.
Статистические методы
В первую очередь был проведен описательный анализ собранных данных. Для оценки кумулятивного уровня удержания терапии секукинумабом была использована кривая Каплана-Мейера, где событием считалось прекращение терапии из-за неэффективности. Дополнительно кривые Каплана-Мейера использовались для оценки влияния сопутствующих заболеваний и клинических характеристик пациентов на DRR секукинумаба. Кривые выживаемости сравнивались с использованием теста лог-ранга. Статистическая значимость была установлена на уровне p<0,05, и все p-значения были двухсторонними. Для всех анализов использовалась программа GraphPad для Windows (v. 8.0, Сан-Диего, США).
Результаты
Клинические характеристики участвовавших в исследовании пациентов
- В исследовании было проанализировано 207 пациентов с ПсА (средний возраст 55,1±11,9 лет; мужчины — 40,1%), получавших лечение секукинумабом в период с января 2016 года по июнь 2022 года в центрах-участниках (Таблица 1).
- Большинство пациентов имели периферическое поражение суставов (80,2%) в сочетании с поражением кожи и/или ногтей (78,3%).
- У обследованных пациентов также отмечались аксиальные проявления (50,3%) или поражение энтезисов (40,1%).
- Признаки дактилита были зарегистрированы у 29,1% пациентов.
- Средняя длительность заболевания составила 8,4±5,5 лет (медиана 7,5 [IQR 10] лет).
Таблица 1. Описательная статистика пациентов с псориатическим артритом (ПсА)
Примечания:
ПсА: псориатический артрит, BMI: индекс массы тела, bDMARDs: биологические модифицирующие болезнь антиревматические препараты, csDMARDs: традиционные синтетические модифицирующие болезнь антиревматические препараты, MTX: метотрексат, NSAIDs: нестероидные противовоспалительные препараты, GCs: глюкокортикостероиды.
- В данной когорте у 57,2% пациентов выявлены сопутствующие заболевания, чаще всего артериальная гипертензия (38,9%) и дислипидемия (35,1%). Кроме того, 28,6% пациентов имели кардиометаболическую мультиморбидность, так как у них было диагностировано 2 или 3 сопутствующих заболевания (АГ, дислипидемия и/или сахарный диабет 2 типа, СД2). Ожирение также было распространено в данной выборке: у 38,7% пациентов индекс массы тела составлял ≥30, а у 18,3% — ≥35. Клинический атеросклероз был выявлен у 8,6% пациентов, а метаболический синдром — у 5,7%.
- Другие сопутствующие заболевания были зарегистрированы у 24,8% пациентов: фибромиалгия (15,1%), заболевания щитовидной железы (13,6%), остеопороз (6,4%), заболевания печени (5,7%), гастроинтестинальные заболевания (5,7%), хроническая обструктивная болезнь легких (5,3%), латентная инфекция микобактерий туберкулеза (5,1%), расстройства настроения (4,3%), неврологические заболевания (3,5%) и хроническая почечная недостаточность (2,1%).
- Секукинумаб в дозировке 300 мг/месяц назначался большинству пациентов (76,0%), что объясняется наличием бляшечного псориаза и/или предшествующей терапией ингибиторами ФНО (фактора некроза опухоли). Прекращение терапии секукинумабом из-за неэффективности было зарегистрировано у 21,4% пациентов, а у 2,3% терапия была прекращена из-за побочных эффектов. Опасных для жизни побочных эффектов не наблюдалось; также в ходе наблюдения не было зарегистрировано случаев нового или обострения воспалительного заболевания кишечника.
- Секукинумаб применялся как препарат первой линии bDMARD-терапии у 51,1% пациентов, тогда как остальные получали его после неудачного лечения хотя бы одним bDMARD. Наиболее часто предшествующими bDMARD были ингибиторы ФНО (89,6%). Реже применялись ингибиторы IL–17A (иксекизумаб) или ингибиторы IL–12/IL–23 (устекинумаб) — у 10,4% пациентов. Кроме того, 6,5% пациентов ранее получали апремиласт (ингибитор ФДЭ4).
- Секукинумаб назначался 31,2% пациентов после неудачного лечения одним bDMARD, а остальным — после неудачи 2 или более bDMARD. Сопутствующая терапия csDMARD была зарегистрирована у 37,4% пациентов, из которых наиболее часто использовался метотрексат (МТХ, 71,8%). НПВП и глюкокортикостероиды (ГКС) применялись реже (29,3% и 16,1% соответственно).
Уровень удержания терапии секукинумабом
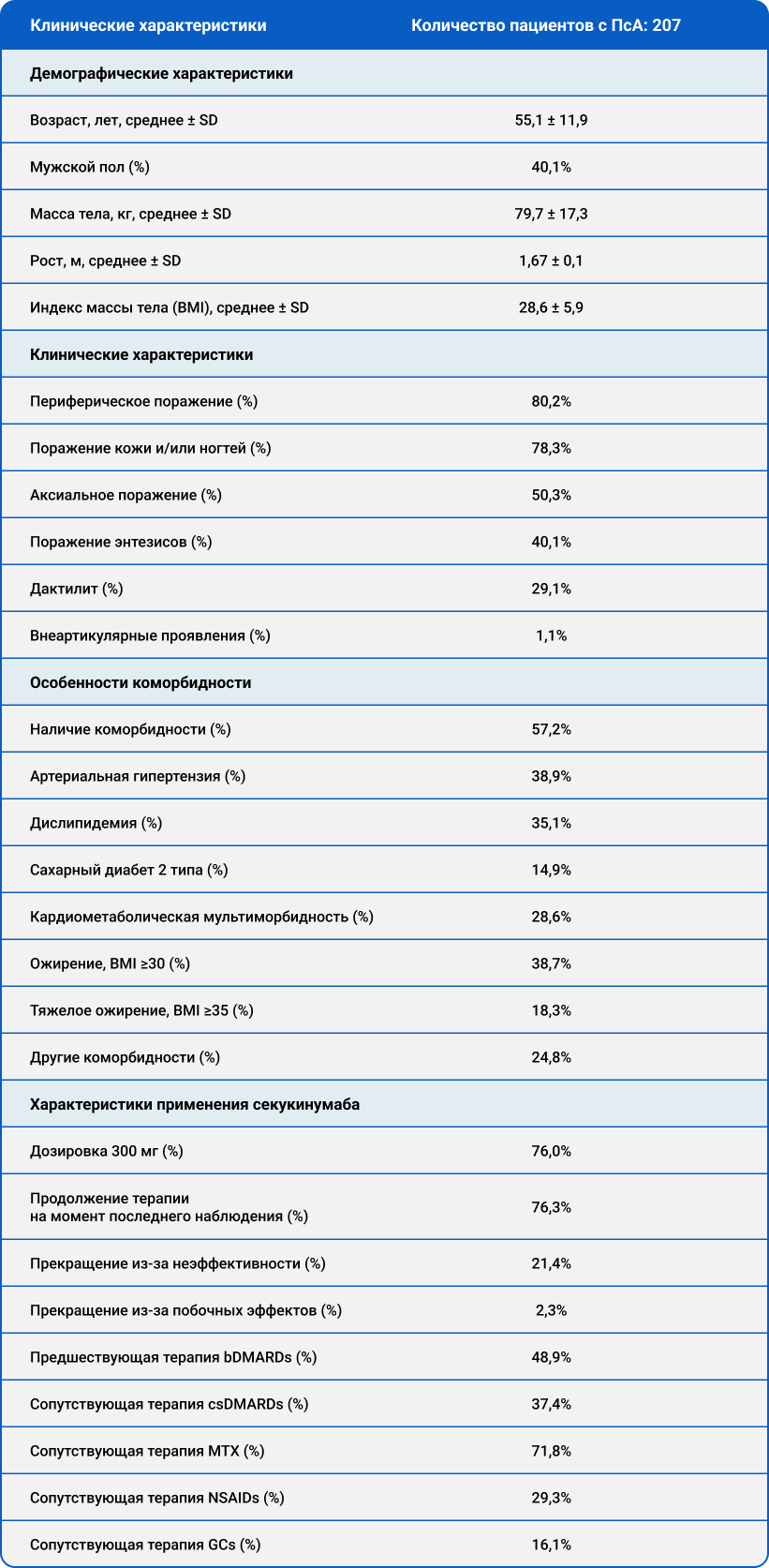
- Кумулятивный уровень удержания терапии секукинумабом составил 57,0% при среднем времени применения 21,5±17,1 месяца (медиана 18,0 [IQR 24] месяцев) в данной когорте пациентов с ПсА (Рис. 1).
Рисунок 1. Кумулятивный показатель продолжительности приема препарата (DRR) секукинумаба представлен за период наблюдения в 60 месяцев. В когорте был оценен кумулятивный DRR секукинумаба, составивший 57,0%, со средним временем приема 21,5±17,1 месяца (медиана 18,0 [IQR 24] месяца)
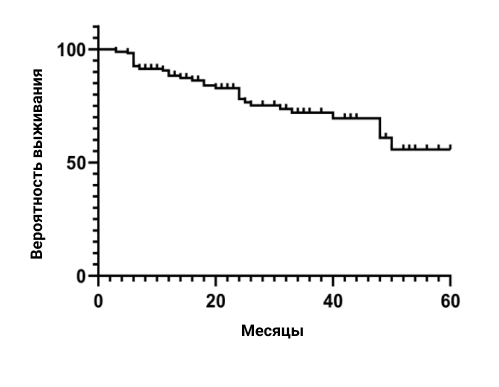
Рисунок 2. DRR секукинумаба стратифицирован по следующим показателям: мужчины/женщины (A), возраст ≥65 лет (B), длительность заболевания ≥5 лет (C) и длительность заболевания ≥10 лет (D), соответственно. Ни один из этих факторов не оказал значительного влияния на DRR секукинумаба
- Далее мы проанализировали DRR секукинумаба в зависимости от клинических характеристик пациентов. Пол (мужской, p=0,843) и возраст ≥65 лет (p=0,082) не оказывали влияния на DRR секукинумаба. Стратификация DRR по длительности заболевания также не выявила различий: пациенты с длительностью заболевания ≥5 лет (p=0,181) или ≥10 лет (p=0,223) не продемонстрировали снижения DRR по сравнению с другими (Рис. 2).
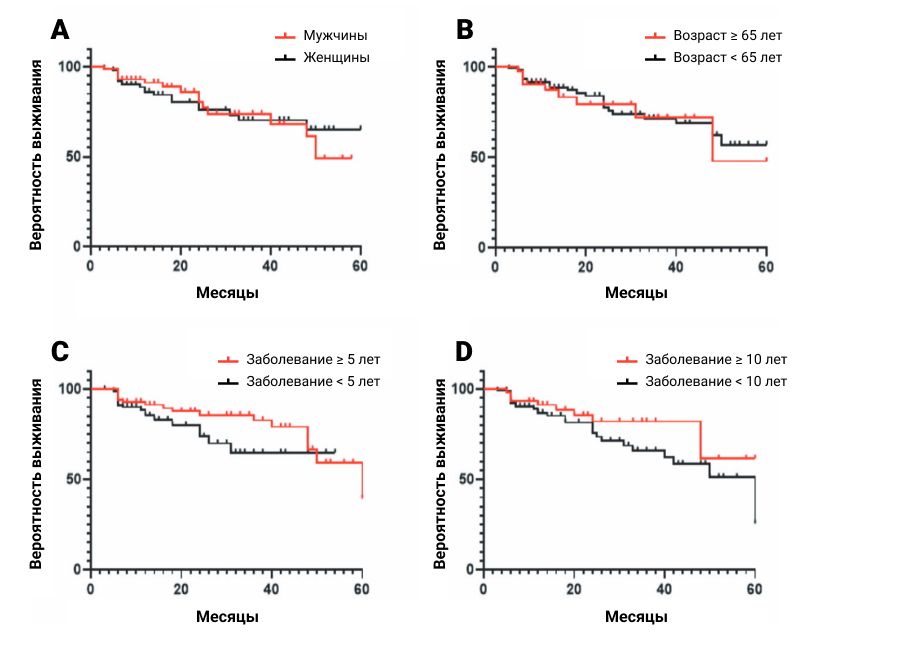
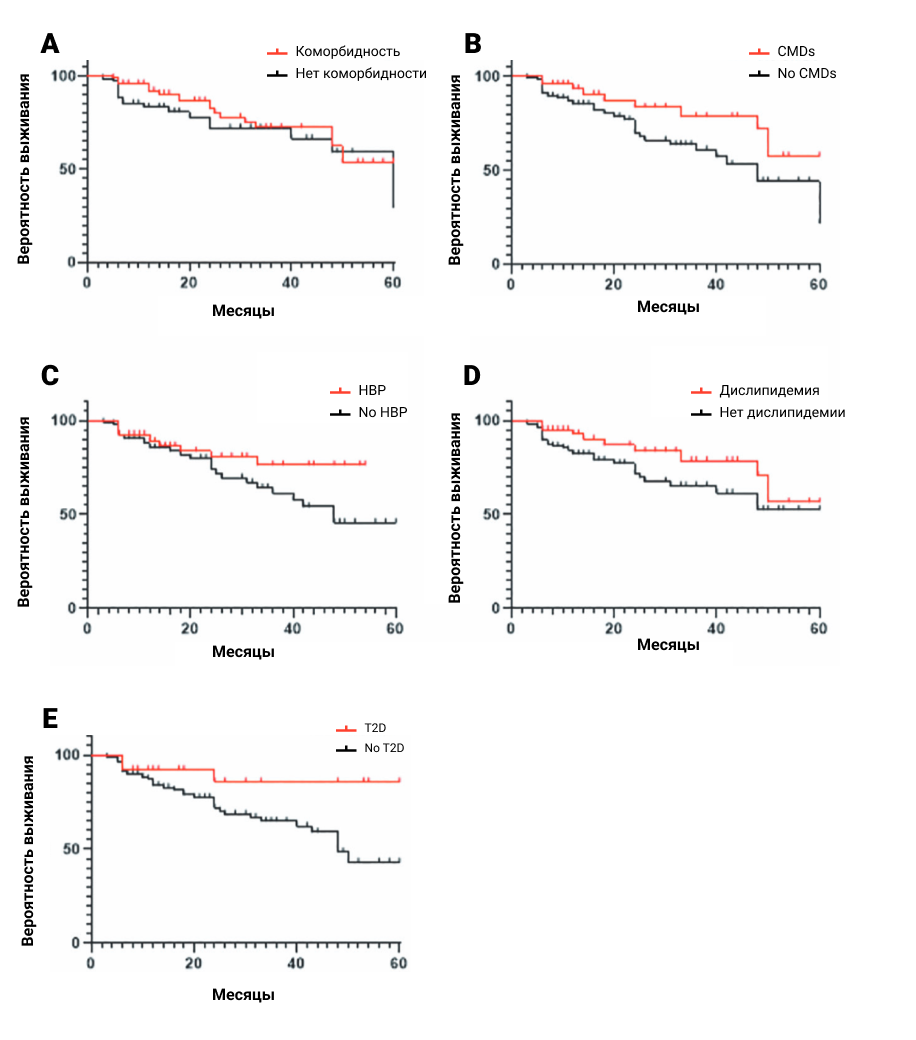
- Наличие любых сопутствующих заболеваний не влияло на DRR секукинумаба в нашей когорте (p=0,258) (Рис. 3). Однако у пациентов с кардиометаболической мультиморбидностью наблюдалась тенденция к лучшему DRR секукинумаба по сравнению с другими (p=0,042). Пациенты с АГ (p=0,062), дислипидемией (p=0,084) и СД2 (p=0,044) также демонстрировали тенденцию к повышенному DRR секукинумаба.
- Анализ DRR секукинумаба в зависимости от ожирения показал, что пациенты с ИМТ ≥30 не имели сниженного DRR (p=0,747), как и пациенты с ИМТ ≥35 (p=0,905) (Рис. 4).
- Стратификация DRR по характеристикам терапии (Рис. 5) показала, что различия в дозировке секукинумаба (300 мг/месяц и 150 мг/месяц) не влияли на DRR (p=0,098). Аналогично, применение секукинумаба как препарата первой линии bDMARD не показало различий в DRR по сравнению с пациентами, лечившимися ранее другими bDMARD (p=0,923). Сопутствующая терапия csDMARD (p=0,417) или МТХ (p=0,177) также не влияла на DRR секукинумаба в данной когорте.
Рисунок 3. DRR секукинумаба стратифицирован в зависимости от наличия сопутствующих заболеваний (A), кардиометаболических заболеваний (КМЗ) (B), гипертонии (ГБ) (C), дислипидемии (D) и сахарного диабета 2 типа (СД2) (E), соответственно. У пациентов с КМЗ и СД2 была зафиксирована тенденция к улучшенному DRR секукинумаба по сравнению с другими группами (p=0,042 и p=0,044, соответственно). Остальные параметры не оказали значительного влияния на DRR секукинумаба
Рисунок 4. DRR секукинумаба стратифицирован в зависимости от ИМТ ≥30 (A) и ИМТ ≥35 (B), соответственно. Ни один из этих факторов не оказал значительного влияния на DRR секукинумаба
Рисунок 5. DRR секукинумаба стратифицирован в зависимости от дозировки препарата (A), линии применения биологических БМАРП (bDMARDs) (B), комбинированной терапии с традиционными синтетическими БМАРП (csDMARDs) и секукинумабом (C), а также комбинированной терапии с метотрексатом (MTX) и секукинумабом (D), соответственно. Ни один из этих факторов не оказал значительного влияния на DRR секукинумаба
Обсуждение
- В данном исследовании была проведена оценка уровня удержания терапии (DRR) секукинумабом у пациентов с ПсА в реальной клинической практике в мультицентровой когорте. Также было показано, что наличие кардиометаболической мультиморбидности может быть связано с улучшением DRR секукинумаба, тогда как ожирение не влияло на этот показатель. Предшествующее применение bDMARD, сопутствующая терапия csDMARD и различные дозировки препарата не оказывали влияния на DRR секукинумаба с течением времени.
- В исследуемой когорте 60-месячный кумулятивный DRR секукинумаба составил 57% при среднем времени применения препарата 21,5 месяца. Хотя данное исследование имеет более длительный период наблюдения, результат соответствует предыдущему опыту, предполагающему хороший DRR данного препарата у пациентов с ПсА26–31. Кроме того, недавно было отмечено схожее удержание терапии между секукинумабом и ингибиторами ФНО27, хотя для окончательной ясности по этому вопросу необходимы дополнительные исследования.
- В исследовании также оценивалось возможное влияние демографических характеристик на DRR секукинумаба у пациентов с ПсА. В соответствии с предыдущими исследованиями26–28, мужской пол не оказал влияния на DRR данного препарата. Однако в других работах29,30 пол коррелировал с различиями в условиях исследования и дизайнах. Поэтому для полного понимания этой особенности требуются дополнительные исследования, принимающие во внимание возможные гендерные различия при ПсА36. Установлено, что пожилой возраст при назначении секукинумаба не влиял на DRR. Это важно, поскольку старший возраст обычно ассоциируется с полипрагмазией, увеличивающей риск ятрогенных эффектов и усложняющей лечение этих пациентов37. Лечение пожилых пациентов также может быть осложнено состоянием хрупкости, общим синдромом, связанным с возрастом, который характеризуется повышенным риском неблагоприятных исходов, включая инвалидизацию, госпитализацию и смертность38.
- Кроме того, была проведена стратификация результатов DRR секукинумаба с учетом наличия сопутствующих заболеваний у пациентов в исследуемой когорте. Клиническая картина ПсА может быть осложнена коморбидностями, что затрудняет лечение таких пациентов6,7. Независимо от основного заболевания, пациенты с сопутствующими заболеваниями могут быть подвержены более высокому риску осложнений и смертности, а также у них ниже отзыв на терапию по сравнению с пациентами с аналогичным заболеванием, но без этих состояний39. Напротив, в данной когорте наличие любых сопутствующих заболеваний не влияло на DRR секукинумаба. Более того, у пациентов с кардиометаболической мультиморбидностью наблюдалась тенденция к улучшению DRR секукинумаба. Например, у пациентов с артериальной гипертензией, дислипидемией и сахарным диабетом 2 типа отмечалось более длительное удержание терапии секукинумабом. В этом контексте IL–17A может играть центральную роль в воспалении, эндотелиальной дисфункции, инсулинорезистентности и сопутствующем кардиометаболическом бремени у пациентов с ПсА40–43. Таким образом, в исследовании было выявлено, что пациенты с этим кардиометаболическим воспалительным профилем, обусловленным наличием кардиометаболической мультиморбидности, могли иметь лучший DRR секукинумаба. На этом основании IL–17A может играть центральную роль в патогенезе этого клинического фенотипа у пациентов с ПсА и кардиометаболической мультиморбидностью.
- Была проведена оценка результатов с учетом ожирения. Интересно, что DRR секукинумаба, по‑видимому, не зависел от ИМТ выше 30 или 35 соответственно. Этот вывод важен, поскольку ожирение связано с неблагоприятным прогнозом Пс А. Например, пациенты с ожирением реже достигают минимальной активности заболевания, демонстрируют более низкие показатели очищения кожи и чаще прекращают лечение44,45. Однако, как было показано в предыдущем исследовании30, ожирение не влияло на DRR секукинумаба, что свидетельствует о его клинической полезности для этих пациентов. Кроме того, недавно было подтверждено, что эффективность секукинумаба не зависит от ИМТ у пациентов с ПсА46.
- В данной когорте было отмечено, что предшествующее использование bDMARD, сопутствующая терапия csDMARD и различные дозировки препарата не влияли на DRR секукинумаба с течением времени. Таким образом, эти результаты подтверждают эффективность секукинумаба, который может рассматриваться как подходящий вариант монотерапии и для пациентов, не ответивших на предшествующую терапию bDMARD. Последнее также может быть характерно для пациентов с длительным течением заболевания. В настоящем исследовании длительность заболевания не оказала влияния на DRR секукинумаба в когорте пациентов с ПсА. Эти результаты в основном согласуются с предыдущими исследованиями в данной области26–31, подтверждая идею о том, что секукинумаб может быть подходящим терапевтическим вариантом в реальных клинических условиях.
Подводя итоги, можно сделать несколько ключевых выводов относительно DRR секукинумаба у пациентов с ПсА.
- Удержание терапии, по‑видимому, не зависело от определенных клинических характеристик пациентов, включая мужской пол, пожилой возраст и длительность заболевания. Кроме того, наличие сопутствующих заболеваний, включая ожирение, не снижало DRR секукинумаба. В то же время у пациентов с кардиометаболической мультиморбидностью наблюдалась тенденция к улучшению DRR данного препарата. Наконец, различные дозировки, различные линии терапии и сопутствующая терапия csDMARD не оказывали влияния на DRR секукинумаба. Таким образом, можно предположить клиническую применимость секукинумаба в лечении пациентов с ПсА в реальных условиях.
- Несмотря на то, что данное исследование предоставляет дополнительную информацию о DRR секукинумаба у пациентов с ПсА, оно имеет некоторые ограничения, которые могут снизить достоверность результатов. Ретроспективный дизайн исследования действительно может ограничивать обобщаемость данных. Другим ограничением является отсутствие оценки активности заболевания в этой когорте. Однако целью исследования было оценить влияние характеристик пациентов и сопутствующих заболеваний на DRR секукинумаба, а не его эффективность, которая была подробно изучена и документирована в рандомизированных клинических испытаниях и других реальных исследованиях13–19,26–31. С учетом этих выводов необходимы дальнейшие исследования для полного выяснения этого вопроса, а полученные данные могут послужить основой для организации будущих подтверждающих исследований, направленных на более индивидуализированное управление этими пациентами с ПсА47–49.
- В заключение, кумулятивный 60-месячный DRR секукинумаба составил 57,0% у пациентов с Пс А. Наличие кардиометаболической мультиморбидности может быть связано с улучшением DRR секукинумаба, тогда как ожирение не оказывало влияния на этот показатель. Предшествующее использование bDMARD, сопутствующая терапия csDMARD и различные дозировки также не влияли на DRR секукинумаба с течением времени. Хотя для полного выяснения этого вопроса необходимы дополнительные исследования, клиническая применимость секукинумаба может быть рекомендована для лечения пациентов с ПсА в реальных условиях.
- GLADMAN DD: Early psoriatic arthritis. Rheum Dis Clin North Am 2012; 38(2): 373–86. https://doi.org/10.1016/j.rdc.2012.05.005
- RITCHLIN CT, COLBERT RA, GLADMAN DD: Psoriatic arthritis. N Engl J Med 2017; 376(10): 957–70. https://doi.org/10.1056/nejmra1505557
- RUSCITTI P, ESPOSITO M, GIANNERAMO C et al.: Nail and enthesis assessment in patients with psoriatic disease by high frequency ultrasonography: findings from a single-centre cross-sectional study. Radiol Med 2022; 127(12):1400–6. https://doi.org/10.1007/s11547–022–01568–4
- NAVARINI L, CURRADO D, CASO F et al.: Duration of clinical remission and low disease activity impacts on quality of life and its domains in psoriatic arthritis patients: results from an Italian multicentre study. Clin Exp Rheumatol 2022; 40(7):1285–92. https://doi.org/10.55563/clinexprheumatol/tgdj0p
- GIACOMELLI R, GORLA R, TROTTA F et al.: Quality of life and unmet needs in patients with inflammatory arthropathies: results from the multicentre, observational RAPSODIA study. Rheumatology (Oxford) 2015; 54(5): 792–7. https://doi.org/10.1093/rheumatology/keu398
- LUBRANO E, SCRIFFIGNANO S, PERROTTA FM: Multimorbidity and comorbidity in psoriatic arthritis — a perspective. Expert Rev Clin Immunol 2020; 16(10): 963–72. https://doi.org/10.1080/1744666X.2021.1825941
- NOVELLI L, LUBRANO E, VENERITO V et al.: Extra-articular manifestations and comorbidities in psoriatic disease: a journey into the immunologic crosstalk. Front Med (Lausanne) 2021; 8: 737079. https://doi.org/10.3389/fmed.2021.737079
- FITZGERALD O, OGDIE A, CHANDRAN V et al.: Psoriatic arthritis. Nat Rev Dis Primers 2021; 7(1): 59. https://doi.org/10.1038/s41572–021–00293-y
- SCHETT G, RAHMAN P, RITCHLIN C, MCINNES IB, ELEWAUT D, SCHER JU: Psoriatic arthritis from a mechanistic perspective. Nat Rev Rheumatol 2022; 18(6): 311–25. https://doi.org/10.1038/s41584–022–00776–6
- SCRIVO R, D’ANGELO S, CARRIERO A et al.: The conundrum of psoriatic arthritis: a pathogenetic and clinical pattern at the midpoint of autoinflammation and autoimmunity. Clin Rev Allergy Immunol 2022 Jan 18. https://doi.org/10.1007/s12016–021–08914-w
- TAAMS LS, STEEL KJA, SRENATHAN U, BURNS LA, KIRKHAM BW: IL–17 in the immunopathogenesis of spondyloarthritis. Nat Rev Rheumatol 2018; 14(8): 453–66. https://doi.org/10.1038/s41584–018–0044–2
- BERINGER A, MIOSSEC P: Systemic effects of IL–17 in inflammatory arthritis. Nat Rev Rheumatol 2019; 15(8): 491–501. https://doi.org/10.1038/s41584–019–0243–5
- GAO Q, ZHAO YX, WANG XJ, SHI J, WANG HM: Efficacy and safety of IL–17 inhibitors for patients with psoriatic arthritis: a systematic review and meta-analysis. Eur Rev Med Pharmacol Sci 2021; 25(7): 2958–70. https://doi.org/10.26355/eurrev_202104_25549
- LUBRANO E, PERROTTA FM: Secukinumab for ankylosing spondylitis and psoriatic arthritis. Ther Clin Risk Manag 2016; 12: 1587–92. https://doi.org/10.2147/tcrm.S100091
- BLAIR HA: Secukinumab: a review in psoriatic arthritis. Drugs 2021;81(4):483–494. https://doi.org/10.1007/s40265–021–01476–3
- MEASE PJ, McINNES IB, KIRKHAM B et al.: Secukinumab inhibition of interleukin-17A in patients with psoriatic arthritis. N Engl J Med 2015; 373(14): 1329–39. https://doi.org/10.1056/nejmoa1412679
- MEASE P, van der HEIJDE D, LANDEWÉ R et al.: Secukinumab improves active psoriatic arthritis symptoms and inhibits radiographic progression: primary results from the randomised, double-blind, phase III FUTURE 5 study. Ann Rheum Dis 2018; 77(6): 890–97. https://doi.org/10.1136/annrheumdis-2017–212687
- McINNES IB, BEHRENS F, MEASE PJ et al.: Secukinumab versus adalimumab for treatment of active psoriatic arthritis (EXCEED): a double-blind, parallel-group, randomised, active-controlled, phase 3b trial. Lancet 2020; 395(10235): 1496–505. https://doi.org/10.1016/S0140–6736(20)30564–X
- BARALIAKOS X, GOSSEC L, POURNARA E et al.: Secukinumab in patients with psoriatic arthritis and axial manifestations: results from the double-blind, randomised, phase 3 MAXIMISE trial. Ann Rheum Dis 2021; 80(5): 582–90. https://doi.org/10.1136/annrheumdis-2020–218808
- GOSSEC L, BARALIAKOS X, KERSCHBAUMER A et al.: EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis 2020; 79(6): 700–12. https://doi.org/10.1136/annrheumdis-2020–217159.
- COATES LC, SORIANO ER, CORP N et al.: Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol 2022; 18(8): 465–79. https://doi.org/10.1038/s41584–022–00798–0.
- BLONDE L, KHUNTI K, HARRIS SB, MEIZINGER C, SKOLNIK NS: Interpretation and impact of real-world clinical data for the practicing Clinician. Adv Ther 2018; 35(11): 1763–74. https://doi.org/10.1007/s12325–018–0805-y
- BARNISH MS, TURNER S: The value of pragmatic and observational studies in health care and public health. Pragmat Obs Res 2017; 8: 49–55. https://doi.org/10.2147/por.S137701
- FORTIN M, DIONNE J, PINHO G, GIGNAC J, ALMIRALL J, LAPOINTE L: Randomized controlled trials: do they have external validity for patients with multiple comorbidities? Ann Fam Med 2006; 4(2): 104–8. https://doi.org/10.1370/afm.516
- BATROUNI M, COMET D, MEUNIER JP: Real world studies, challenges, needs and trends from the industry. Value Health 2014; 17(7): A587–8. https://doi.org/10.1016/j.jval.2014.08.2006
- RAMONDA R, LORENZIN M, CARRIERO A et al.: Effectiveness and safety of secukinumab in 608 patients with psoriatic arthritis in real life: a 24-month prospective, multicentre study. RMD Open 2021; 7(1): e001519. https://doi.org/10.1136/rmdopen-2020–001519
- EVIATAR T, ZISMAN D, GENDELMAN O et al.: Secukinumab real world drug retention compared to TNF-alpha inhibitors in psoriatic arthritis. Clin Exp Rheumatol 2022; 40(1): 15–23. https://doi.org/10.55563/clinexprheumatol/1sx5yk
- VALERO-EXPÓSITO M, MARTÍN-LÓPEZ M, GUILLÉN-ASTETE C et al.: Retention rate of secukinumab in psoriatic arthritis: Realworld data results from a Spanish multicenter cohort. Medicine (Baltimore) 2022; 101(36): e30444. https://doi.org/10.1097/md.0000000000030444
- CHIMENTI MS, FONTI GL, CONIGLIARO P et al.: One-year effectiveness, retention rate, and safety of secukinumab in ankylosing spondylitis and psoriatic arthritis: a real-life multicenter study. Expert Opin Biol Ther2020; 20(7): 813–21. https://doi.org/10.1080/14712598.2020.1761957
- ALONSO S, VILLA I, FERNÁNDEZ S et al.: Multicenter study of secukinumab survival and safety in spondyloarthritis and psoriatic arthritis: secukinumab in Cantabria and ASTURias Study. Front Med (Lausanne) 2021; 8: 679009. https://doi.org/10.3389/fmed.2021.679009
- KILTZ U, SFIKAKIS PP, GAFFNEY K et al.: Interim 2-year analysis from SERENA: a realworld study in patients with psoriatic arthritis or ankylosing spondylitis treated with secukinumab. Rheumatol Ther 2022; 9(4): 1129–42. https://doi.org/10.1007/s40744–022–00460-x
- TAYLOR W, GLADMAN D, HELLIWELL P et al.: Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006; 54(8): 2665–73. https://doi.org/10.1002/art.21972
- RUSCITTI P, CIPRIANI P, LIAKOULI V et al.: Subclinical and clinical atherosclerosis in rheumatoid arthritis: results from the 3-year, multicentre, prospective, observational GIRRCS (Gruppo Italiano di Ricerca in Reumatologia Clinica e Sperimentale) study. Arthritis Res Ther 2019; 21(1): 204. https://doi.org/10.1186/s13075–019–1975-y
- RUSCITTI P, CIPRIANI P, LIAKOULI V et al.: Occurrence and predictive factors of high blood pressure, type 2 diabetes, and metabolic syndrome in rheumatoid arthritis: findings from a 3-year, multicentre, prospective, observational study. Clin Exp Rheumatol 2021; 39(5): 995–1002. https://doi.org/10.55563/clinexprheumatol/5r53em
- MADDALONI E, D’ONOFRIO L, ALESSANDRI F et al.: Cardiometabolic multimorbidity is associated with a worse Covid-19 prognosis than individual cardiometabolic risk factors: a multicentre retrospective study (CoViDiab II). Cardiovasc Diabetol 2020; 19(1): 164. https://doi.org/10.1186/s12933–020–01140–2
- TARANNUM S, LEUNG YY, JOHNSON SR et al.: Sex — and gender-related differences in psoriatic arthritis. Nat Rev Rheumatol 2022; 18(9): 513–26. https://doi.org/10.1038/s41584–022–00810–7
- SERHAL L, LWIN MN, HOLROYD C, EDWARDS CJ: Rheumatoid arthritis in the elderly: Characteristics and treatment considerations. Autoimmun Rev 2020; 19(6): 102528. https://doi.org/10.1016/j.autrev.2020.102528
- van ONNA M, BOONEN A: Challenges in the management of older patients with inflammatory rheumatic diseases. Nat Rev Rheumatol 2022; 18(6): 326–34. https://doi.org/10.1038/s41584–022–00768–6
- DUFFIELD SJ, ELLIS BM, GOODSON N et al.: The contribution of musculoskeletal disorders in multimorbidity: Implications for practice and policy. Best Pract Res Clin Rheumatol 2017; 31(2): 129–44. https://doi.org/10.1016/j.berh.2017.09.004
- BARTOLONI E, ALUNNO A, GERLI R: Hypertension as a cardiovascular risk factor in autoimmune rheumatic diseases. Nat Rev Cardiol 2018; 15(1): 33–44. https://doi.org/10.1038/nrcardio.2017.118
- ABDEL–MONEIM A, BAKERY HH, ALLAM G: The potential pathogenic role of IL–17/Th17 cells in both type 1 and type 2 diabetes mellitus. Biomed Pharmacother 2018; 101: 287–92. https://doi.org/10.1016/j.biopha.2018.02.103
- RUSCITTI P, DI BENEDETTO P, BERARDICURTI O et al.: Adipocytokines in rheumatoid arthritis: the hidden link between inflammation and cardiometabolic comorbidities. J Immunol Res 2018; 2018: 8410182. https://doi.org/10.1155/2018/8410182
- von STEBUT E, BOEHNCKE WH, GHORESCHI K et al.: IL–17A in psoriasis and beyond: cardiovascular and metabolic implications. Front Immunol 2020; 10: 3096. https://doi.org/10.3389/fimmu.2019.03096
- HØJGAARD P, GLINTBORG B, KRISTENSEN LE, GUDBJORNSSON B, LOVE TJ, DREYER L: The influence of obesity on response to tumour necrosis factor-α inhibitors in psoriatic arthritis: results from the DANBIO and ICEBIO registries. Rheumatology (Oxford) 2016; 55(12): 2191–99. https://doi.org/10.1093/rheumatology/kew326
- GALÍNDEZ E, CARMONA L: Is obesity in psoriatic arthritis associated with a poorer therapeutic response and more adverse effects of treatment with an anchor drug? Reumatol Clin 2016; 12(6): 307–12. https://doi.org/10.1016/j.reuma.2015.12.005
- PANTANO I, IACONO D, FAVALLI EG et al.: Secukinumab efficacy in patients with ПсА is not dependent on patients» body mass index. Ann Rheum Dis 2022; 81(3): e42. https://doi.org/10.1136/annrheumdis-2020–217251
- GIACOMELLI R, AFELTRA A, ALUNNO A et al.: International consensus: What else can we do to improve diagnosis and therapeutic strategies in patients affected by autoimmune rheumatic diseases (rheumatoid arthritis, spondyloarthritides, systemic sclerosis, systemic lupus erythematosus, antiphospholipid syndrome and Sjögren’s syndrome)?: The unmet needs and the clinical grey zone in autoimmune disease management. Autoimmun Rev 2017; 16(9): 911–24. https://doi.org/10.1016/j.autrev.2017.07.012
- GIACOMELLI R, AFELTRA A, ALUNNO A et al.: Guidelines for biomarkers in autoimmune rheumatic diseases — evidence-based analysis. Autoimmun Rev 2019; 18(1): 93–106. https://doi.org/10.1016/j.autrev.2018.08.003
- GIACOMELLI R, AFELTRA A, BARTOLONI E et al.: The growing role of precision medicine for the treatment of autoimmune diseases; results of a systematic review of literature and Experts» Consensus. Autoimmun Rev 2021; 20(2): 102738. https://doi.org/10.1016/j.autrev.2020.102738
11323286/SEC/DIG/12.2024