Наследственные дистрофии сетчатки (НДС) представляют собой группу редких заболеваний, вызванных мутацией в любом из более чем 270 генов и способных приводить к слепоте (рис. 1)1.
НДС включают в себя широкий спектр клинических диагнозов: палочко-колбочковые дистрофии (пигментный ретинит, врожденный амавроз Лебера, дистрофия сетчатки с ранним началом, тяжелая дистрофия сетчатки с началом в раннем детстве), болезнь Штаргардта, Х-сцепленный ретиношизис, болезнь Беста и прочие2–5.
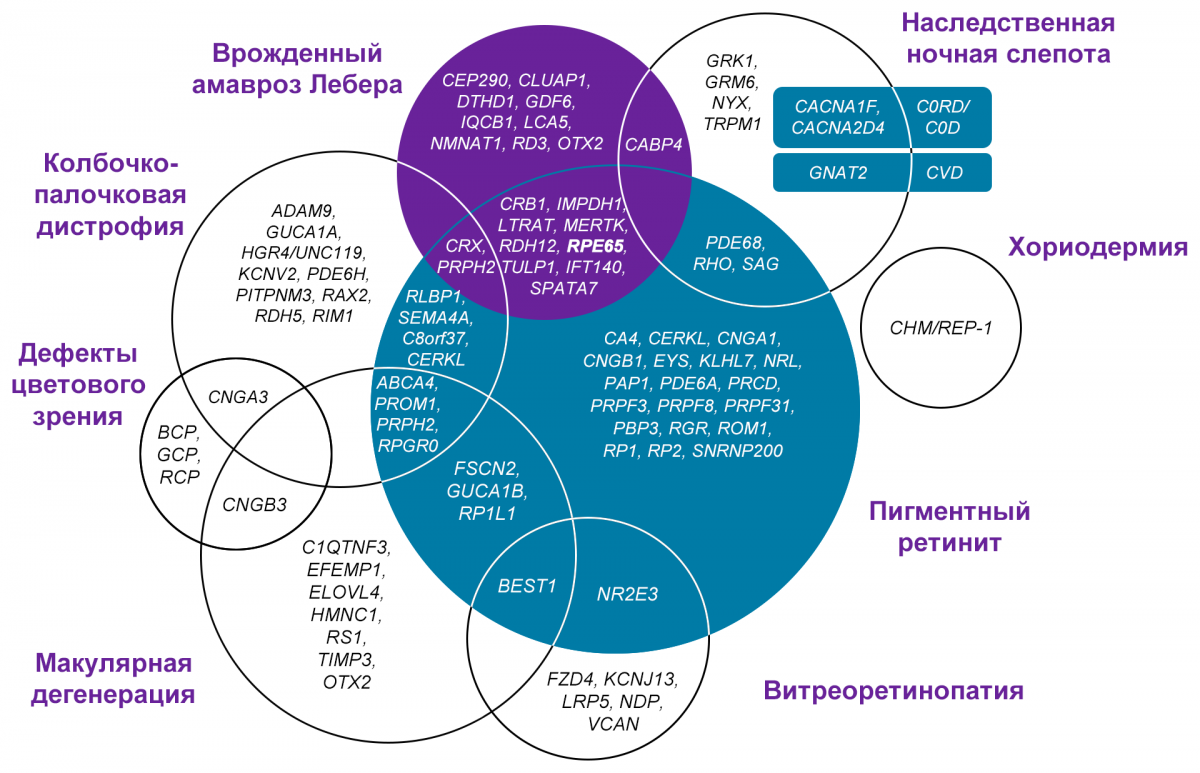
Рисунок 1 — Гены, задействованные в этиопатогенезе НДС (адаптировано из Berger W. et al., 2010)1
Дистрофии сетчатки вследствие мутаций в гене RPE65 обусловлены спектром мутаций этого гена, который располагается на коротком плече 1-й хромосомы (1p31) и кодирует активность фермента, необходимого для регенерации светочувствительного ретинального пигмента6. Эта группа заболеваний сетчатки нуждается в особом внимании, так как имеет склонность к прогрессированию, что ведет к снижению остроты зрения и слепоте7.
Группу заболеваний, ассоциированных с геном RPE65, объединяют некоторые клинические признаки: ночная слепота, прогрессирующее сужение полей зрения и потеря центрального зрения. Однако возраст начала заболевания, выраженность патологического процесса, скорость прогрессирования и начальные проявления могут отличаться.
Дистрофии сетчатки вследствие мутаций в гене RPE65 относятся к ультраредким заболеваниям, их распространенность составляет 1:200 000 человек6,8.
Анализ естественного течения RPE65-НДС
У большинства пациентов с НДС, ассоциированными с биаллельными мутациями в гене RPE65, нарушение зрения развивается в раннем детском возрасте и в дальнейшем прогрессирует (рис. 2).

Рисунок 2 — Естественное течение RPE65-НДС
Для оценки естественного течения RPE65-НДС было проведено ретроспективное исследование в 7 центрах из 6 стран с участием 70 пациентов7.
Критериями включения в исследование стали следующие параметры:
-
Дата рождения пациента с 1 января 1963 года по 31 декабря 2010 года.
-
Подтвержденные аутосомно-рецессивные мутации в гене RPE65.
-
Минимум 2 визита в клинику до включения в исследование или до проведения витреоретинальной хирургии.
Критерии включения и параметры оценки
Исключались из исследования пациенты с заболеваниями сетчатки или глаза, которые могли влиять на зрительные функции, или системными заболеваниями, вызванными мутациями в других генах. В итоге в исследование вошли истории болезни 70 пациентов. Учитывались показатели максимальной корригированной остроты зрения (МКОЗ) по шкале logMAR, поля зрения с использованием кинетического периметра Гольдмана и оптической когерентной томографии (ОКТ) с оценкой толщины сетчатки и наружного ядерного слоя, измеренных в фовеа (Heidelberg), также оценивалась возможная зависимость МКОЗ, поля зрения и данных ОКТ от возраста пациента.
Результаты наблюдения
В ходе исследования было выявлено, что острота зрения в течение первых десяти лет жизни была относительно стабильной. Постепенное ухудшение начиналось в возрасте около 15–20 лет, и после 20 лет значительно прогрессировало. Степень ухудшения зрения варьировала от 0,8 logMAR в самой молодой группе до 1,0 к 16 годам и 2,0 в возрасте 34–46 лет. Острота зрения во всех возрастных группах попадала под категорию слабовидения.
Исследование поля зрения
Исследование поля зрения проводилось с двумя типами стимулов — III4е и V4е, отличающихся по площади стимула (стандартный стимул — III4е площадью 4 мм2, стимул V4е площадью 64 мм2). Было выявлено их сужение до 85–90 градусов в возрасте 20 лет и старше, что на 90% меньше, чем у более молодых пациентов. К 28–34 годам среднее поля полей зрения при исследовании со стимулом V4е составило 70% по сравнению с более молодой возрастной группой.
Также в ходе исследования оценивалась толщина сетчатки и наружного ядерного слоя в макулярной области с помощью ОКТ. Изменений на ОКТ ни по одному исследуемому показателю в зависимости от возраста выявлено не было (было проведено небольшое количество повторных иследований).
Анализ клинических диагнозов
После оценки исходных данных был проведен анализ клинических диагнозов, поставленных пациентам. При первом обращении к офтальмологу могло быть поставлено более одного диагноза, и со временем диагнозы могли меняться, что объясняется появлением результатов дополнительных исследований, включая генетические тесты. Список поставленных диагнозов приведен на рисунке 3.

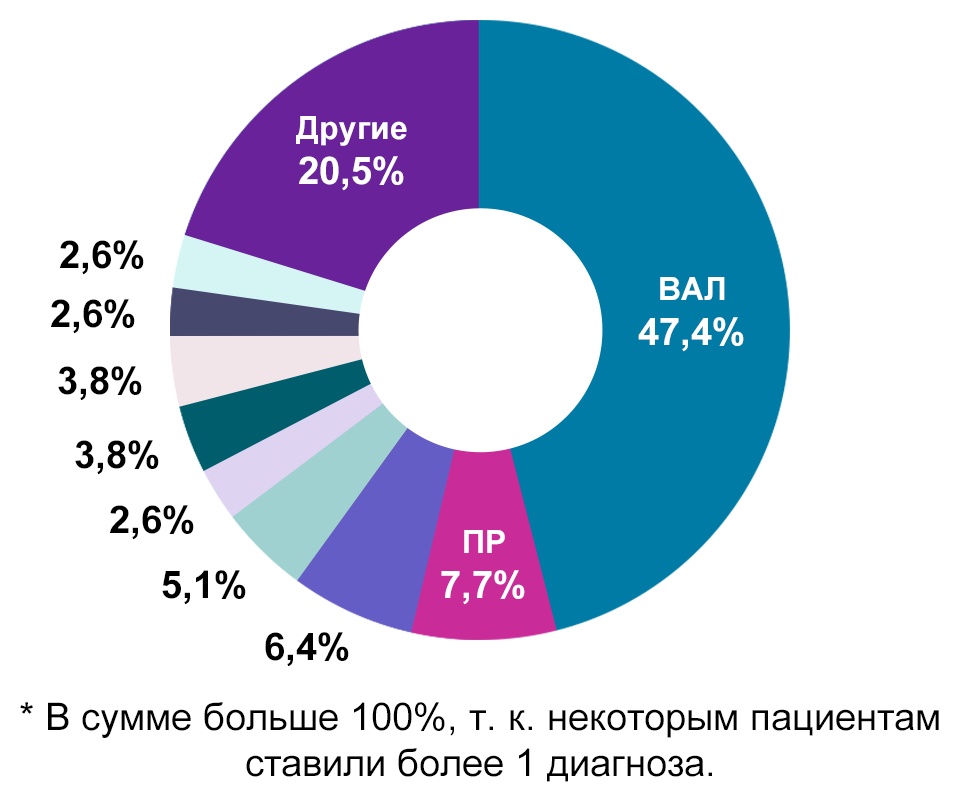
Рисунок 3 — Спектр клинических диагнозов, выставленных пациентам на первом визите (адаптировано из Chung D.C. et al., 2019)7
Клинические особенности заболевания
В исследовании также были отражены клинические особенности пациентов с заболеваниями, ассоциированными с мутациями в гене RPE657.
Почти у 80% пациентов был выявлен нистагм как минимум с одной стороны. Косоглазие было выявлено в 31,4% случаев; патология хрусталика, включая катаракту как минимум с одной стороны, — у 20% пациентов.
-
в 98,6% случаев были выявлены периферические изменения сетчатки: атрофия наружных слоев сетчатки и изменения пигментного эпителия;
-
в 85,7% — патология макулярной области, включая патологический рефлекс и атрофические изменения;
-
в 75,7% случаев была обнаружена бледность диска зрительного нерва (ДЗН).
Возраст пациентов при первом обнаружении патологии заднего отрезка глаза составил 12–13 лет. Этот возраст у большинства совпадает со временем первого визита к врачу, следовательно, описанные изменения могли возникнуть и ранее.
Сами пациенты в 74,3% случаев предъявляли жалобы на затруднения в ориентации в пространстве, а 80% к моменту первого визита использовали какие-либо вспомогательные средства (от очков и лупы до шрифта Брайля). Более половины пациентов жаловались на снижение ночного зрения, 88,6% — на светобоязнь.
Таким образом, возможность независимого функционирования у таких пациентов снижена — даже несмотря на то, что в первые десять лет жизни отклонений в остроте зрения может не наблюдаться3. Однако уже к 15–20 годам заболевание проявляет себя, и они попадают в категорию слабовидящих.
Похожая картина наблюдается и при оценке изменения поля зрения у пациентов с наследственными дистрофиями сетчатки вследствие мутаций в гене RPE65. В среднем к 14–15 годам уровень сужения поля зрения, выявленный по периметрии III4е, также соответствует тяжелому нарушению зрения или слепоте4.
Сравнительная характеристика признаков RPE65-НДС
С мутациями в гене RPE65 ассоциированы не только вышеописанные изменения, но и дистрофия сетчатки с ранним началом и тяжелая дистрофия сетчатки с ранним детским началом Severe early childhood onset retinal dystrophy (SECORD)9. Для этих заболеваний характерно прогрессирование вскоре после рождения.
Таблица 1 — Сравнительная характеристика различных признаков дистрофии сетчатки с ранним началом и тяжелой дистрофии сетчатки с ранним детским началом8
| Начало заболевания | Младенчество, первые месяцы жизни | Детство — юношество,
первая-вторая декада жизни
|
||||
| Жалобы |
Нистагм. Плохая фиксация на предметах. Поиск источника света. Некорригируемое снижение ОЗ. |
Никталопия. Сужение полей зрения. |
Потеря периферического поля зрения. Снижение темновой адаптации. |
|||
| Глазное дно |
Как правило, легкое перераспределение пигмента на периферии, но может и не быть каких-либо изменений. ДЗН в пределах нормы. |
От легкого перераспределения пигмента на периферии до «костных телец», сосуды сужены. Восковидный ДЗН на поздних стадиях. |
||||
| Данные инструментального обследования |
Периметрия: сужение периферических границ поля зрения, снижение световой чувствительности. Аутофлюоресценция: низкий уровень аутофлюоресценции. ОКТ: уменьшение толщины сетчатки, истончение слоя наружных слоев сетчатки, потеря внутреннего сегмента элипсоидной зоны. ЭФИ: угасающая/нерегистрируемая ЭРГ. |
|||||
| Клинический диагноз | Врожденный амавроз Лебера | Пигментный ретинит | ||||
| Подтверждение диагноза | Генетический анализ — биаллельные мутации в гене RPE65 | |||||
Значение генетического тестирования
Изучение естественного течения RPE65-НДС позволило выявить отсутствие четких корреляций между фенотипом и генотипом при мутациях в гене RPE657. При этом наблюдались следующие клинические проявления:
-
ночная слепота, сужение поля зрения;
-
рефракционные нарушения;
-
изменения на глазном дне;
-
снижение/нерегистрируемая электроретинография;
-
выраженное снижение или отсутствие аутофлюоресценции;
-
нистагм, страбизм.
Таким образом, широкий спектр клинических диагнозов и отсутствие конкретной корреляции «мутация — фенотип» подчеркивают важность генетического типирования.
Список источников:
- Berger W. et al. The molecular basis of human retinal and vitreoretinaldiseases. Prog Retin Eye Res. 2010 Sep;29(5):335-75.
- Sahel J.A. et al. Cold Spring Harb Perspect Med. 2015;5(2): a017111.
- Nash B.M. et al. Transl Pediatr. 2015; 4(2): 139-163.
- Vaidya A., Vaidya P. Int J Ophthalmol Clin Res. 2015; 2:3.
- Kumaran N. et al. Br J Ophthalmol. 2017;101(9): 1147-1154.
- Morimura H., Fishman G.A., Grover S.A. еt al. Mutations in the RPE65 gene in patients with autosomal recessive retinitis pigmentosa or leber congenital amaurosis. Proc Natl Acad Sci U S A. 1998;95(6):3088-3093.
- Chung D.C., Bertelsen M., Lorenz B. et al. The Natural History of Inherited Retinal Dystrophy Due to Biallelic Mutations in the RPE65 Gene. Am J Ophthalmol. 2019;199:58-70.
- Wang F. et al. Hum Genet. 2014:133:331-345.
11412341/VORNEP/dig/05.25/0
