Возрастная макулярная дегенерация (ВМД) является значимой медико-социальной проблемой из-за характерного быстрого снижения зрительных функций и резкого ухудшения качества жизни пациентов. Одним из ключевых звеньев патогенеза неоваскулярной возрастной макулярной дегенерации (нВМД) является скопление жидкости в сетчатке. Современные данные свидетельствуют о возможности использования этого симптома в качестве маркера при диагностике, лечении и мониторинге заболевания.
Физиологические механизмы функционирования сетчатки в норме
Поддержанию нормальной струтуры и функции сетчатки в дегидратированном состоянии способствует целый ряд физиологических механизмов1. Ведущая роль принадлежит гематоретинальному барьеру (ГРБ) и осмотическому градиенту.
Поступление жидкости в сетчатку контролирует внутренний ГРБ. Структурно он представляет собой плотно соединенные эндотелиальные клетки капилляров, питающих сетчатку, элементы ретинальной нейроглии и мюллеровы клетки. В формировании внутреннего ГРБ также косвенно участвуют перициты и гладкомышечные клетки.
Клетки эндотелия ретинальных капилляров характеризуются отсутствием фенестр, низкой активностью пиноцитоза и способностью образовывать очень плотные межклеточные контакты за счет особых трансмембранных, каркасных и сигнальных белков (окклюдины, семейство клаудинов и др.). Это создает физический барьер высокого сопротивления для воды и растворенных в ней молекул2.
По данным литературы, на сегодняшний день нет исследований кинетических процессов при субмакулярном введении воды и макромолекул у человека — предполагается, что они могут значительно отличаться от таковых в эксперименте1.
Часть жидкости, продуцируемой цилиарным телом, в процессе дренирования в сосуды хориоидальной оболочки проходит через пигментный эпителий сетчатки (ПЭС). Этот процесс подчиняется законам осмоса. Основное значение в поддержании осмотического градиента принадлежит белковым молекулам (в основном гликопротеинам) и гликозаминогликанам интерфоторецепторного матрикса. Концентрация протеинов в сосудистой оболочке гораздо выше, чем в сетчатке и стекловидном теле. Это способствует «транзитному» транспорту жидкости через сетчатку. Белковые молекулы также транспортируются, но не через фенестры, а путем трансцитоза за счет образования кавеол3.
Нарушения гидрогомеостаза сетчатки
При некоторых заболеваниях может повышаться количество жидкости в сетчатке, что ведет к отеку макулы и снижению остроты зрения. Среди патофизиологических механизмов повышения проницаемости ГРБ выделяют:
-
нарушение фосфорилирования трансмембранных белков и менее плотные межклеточные контакты;
-
повышение активности трансэндотелиального транспорта;
-
гибель клеток ГРБ (перицитов, эндолиоцитов, макроглии).
В частности, накопление жидкости в сетчатке встречается у пациентов с неоваскулярной возрастной макулярной дегенерацией (нВМД). Данная форма ответственна за 90% случаев потери зрения при ВМД5. Экссудация при ВМД сопровождается неоангиогенезом хориоидальной оболочки, появлением в мембране Бруха патологических фенестраций, в которые под ПЭС или нейроэпителий прорастают вновь образованные капилляры. Это может сопровождаться отеком сетчатки, отслойкой пигментного и нейроэпителия, появлением точечных кровоизлияний, прогрессирующим снижением зрения и, соответственно, качества жизни пациентов6.
Диагностика накопления жидкости в сетчатке
Согласно Консенсусу по визуализации заболеваний сетчатки, в настоящее время для визуализации жидкости в сетчатке рекомендуется мультимодальный подход — использование двух и более технологических систем, дополняющих друг друга.
Для этого проводят офтальмоскопию, флуоресцентную ангиографию, оптическую когерентную томографию (ОКТ), ОКТ-ангио, ангиографию с индоцианином зеленым. Однако ключевым методом первичной диагностики и последующего мониторинга является ОКТ8.
ОКТ позволяет визуализировать:
-
интраретинальную жидкость (ИРЖ) — в виде интраретинальных кист, интраретинального отека, макулярного отека (в т. ч. кистозного), ретинального отека, ретинальных экссудатов, ретинальных геморрагий, интраретинальных геморрагий;
-
субретинальную жидкость (СРЖ) — в виде серозной отслойки сетчатки/макулы, геморрагической отслойки сетчатки/макулы, субретинальных геморрагий или экссудатов;
-
жидкость под ПЭС в виде геморрагий и отслойки пигментного эпителия (рис. 1).
В исследовании CATT (число участников 1105) показано, что у пациентов с нВМД исходно в 82% глаз по ОКТ регистрируется жидкость в фовеолярном центре сетчатки, в 30% жидкость выявляется во всех слоях сетчатки, а жидкость под ПЭС обнаруживается в 49% наблюдений10.
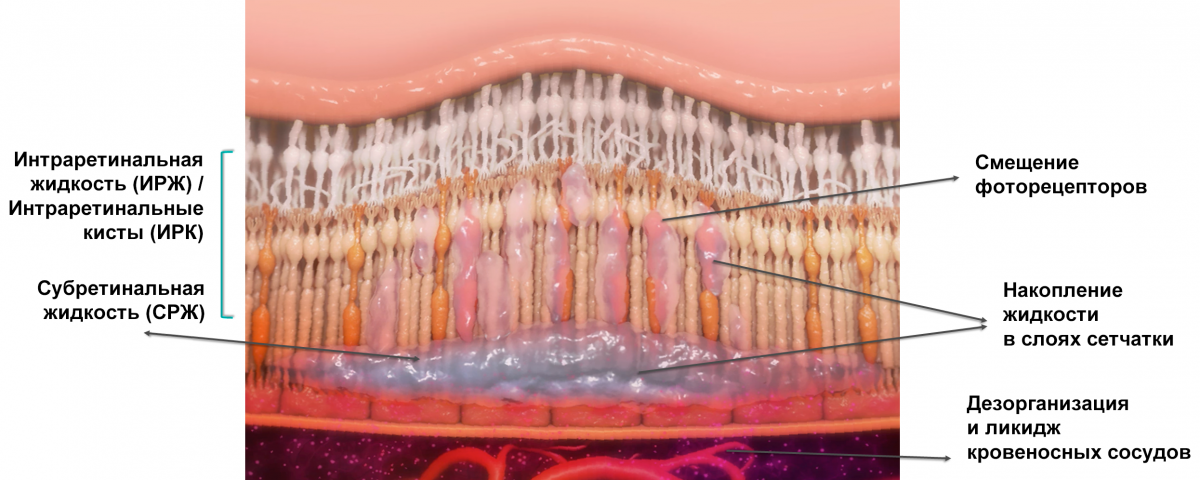
Рисунок 1. Виды жидкости в сетчатке27
Индикатор активности ВМД
Количество и характер накопления жидкости в сетчатке имеют определяющее значение не только в диагностике нВМД, но и при выборе тактики лечения. Это подкреплено обширной доказательной базой.
Так, в исследовании PrONTO показано, что качественная оценка ОКТ в режиме В-сканирования способствует более эффективному обнаружению жидкости в макуле, чем выжидательная тактика с регистрацией начала изменений остроты зрения11.
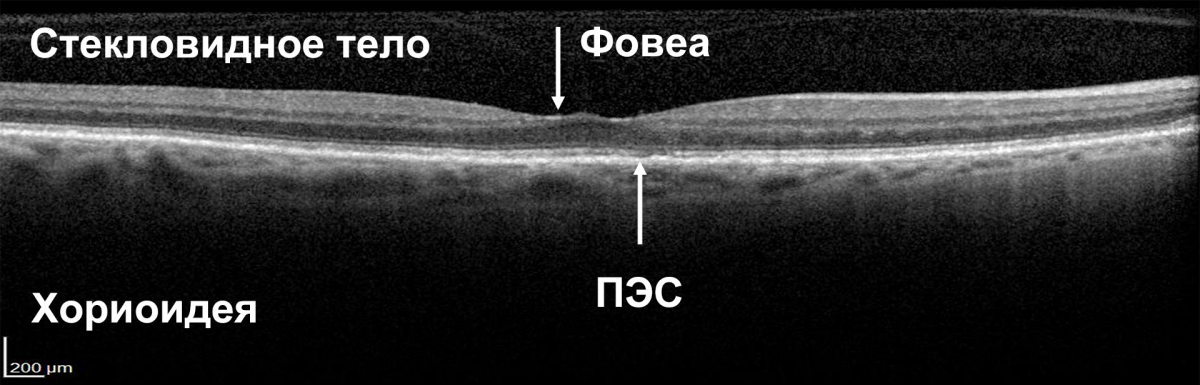
Обнаружение жидкости под сетчаткой и ПЭС (СРЖ, жидкость под ПЭС) может рассматриваться как ранний признак активности заболевания (рис. 2)12. Согласно действующим рекомендациям, она считается свидетельством активности хориоидальной неоваскуляризации и служит отправной точкой для принятия решения о начале/возобновлении лечения пациента с влажной ВМД13.
Сетчатка без жидкости
Пациент с активной нВМД
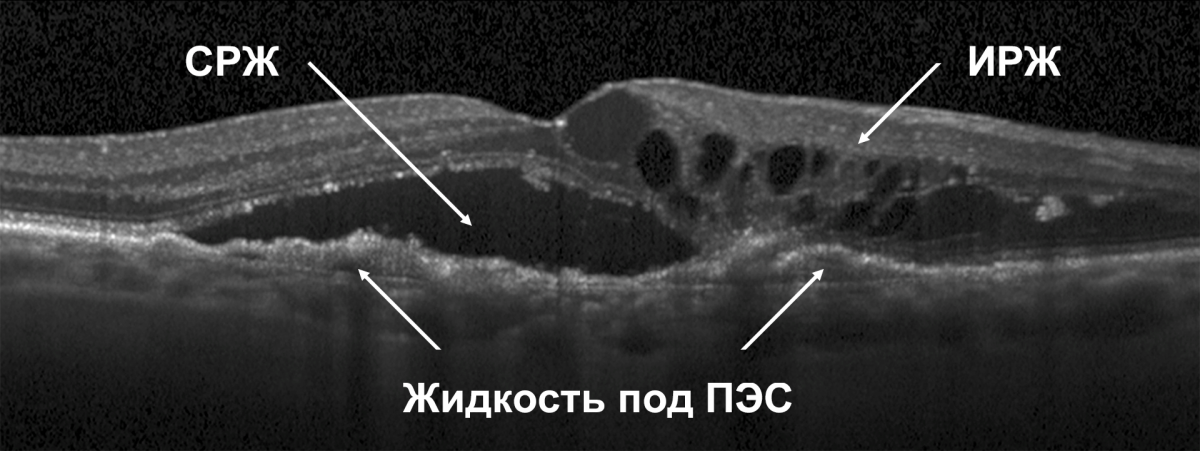
Рисунок 2. ОКТ в норме и при наличии жидкости в сетчатке15
На следующих стадиях заболевания жидкость проникает в сетчатку из субретинальной зоны, где происходит пролиферация хориокапилляров13, а жидкость в сетчатке (например, ИРЖ) вызывает нейросенсорный функциональный дефицит. Он может быть связан с кистозной дегенерацией сетчатки и влечет за собой потерю зрения12,14,15. Учитывая данную последовательность событий, все типы жидкости в сетчатке могут рассматриваться как патологические. Это, в свою очередь, указывает на необходимость применения адекватных терапевтических методик для предотвращения необратимой утраты зрения.
И, напротив, разрешение жидкости коррелирует с улучшением зрения (рис. 3), однако выраженность улучшения варьирует в зависимости от индивидуальных особенностей15,20. Несмотря на вариабельность результатов по остроте зрения, более стабильная толщина сетчатки, отражающая разрешение жидкости и являющаяся индикатором лучшего контроля заболевания, ассоциирована с более оптимальными результатами по остроте зрения10,16.
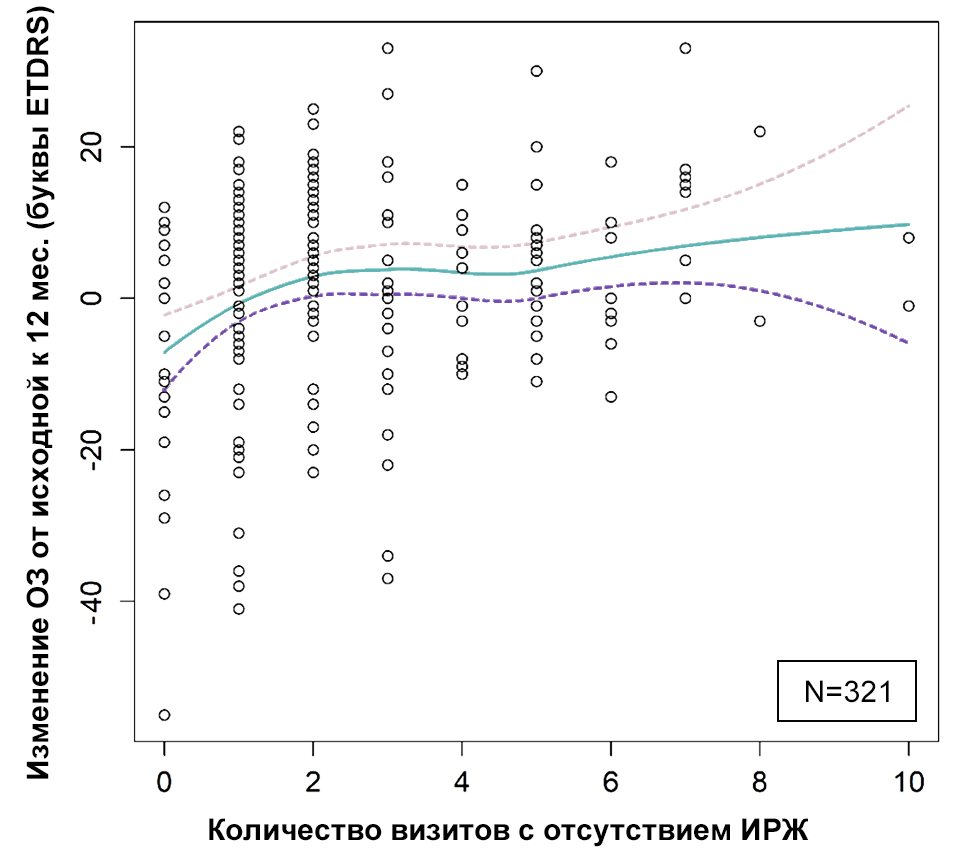
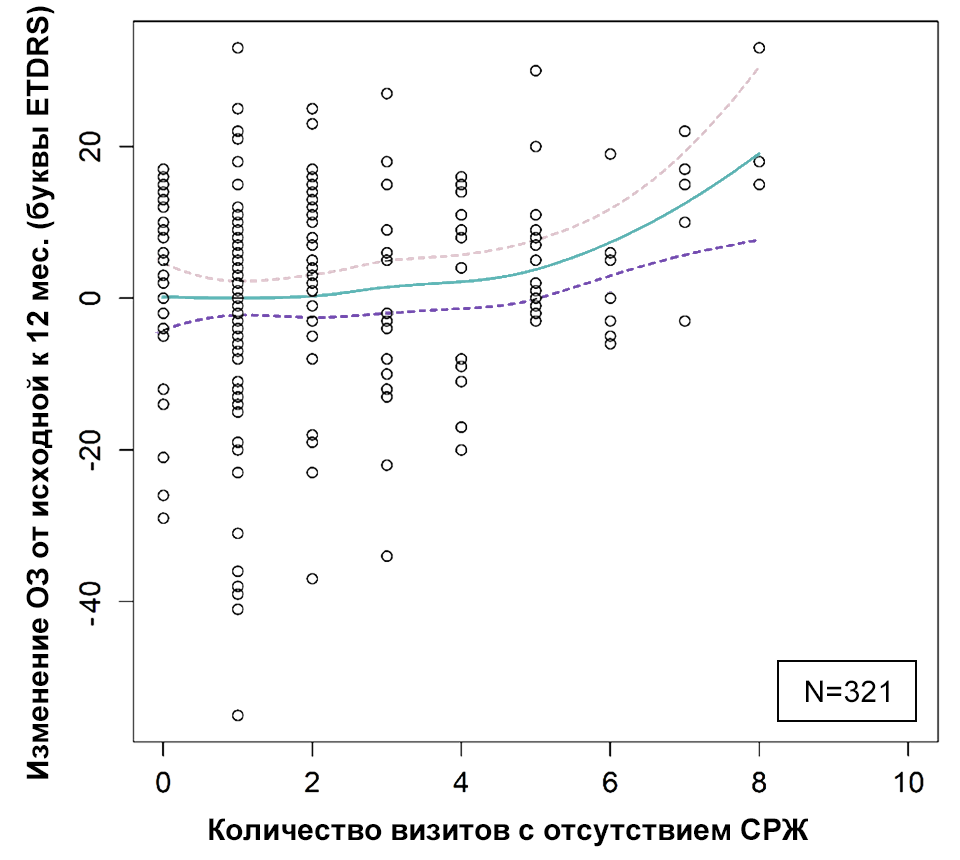
Рисунок 3. Положительная корреляция между отсутствием жидкости в сетчатке и улучшением зрения26
Морфологические критерии при принятии клинических решений
В многочисленных исследованиях нВМД9,10,16–22 наличие жидкости (в частности, любой ИРЖ или СРЖ, определяемой по результатам ОКТ) являлось ключевым критерием активности заболевания и показанием к терапии.
Рекомендации международных офтальмологических сообществ по проведению повторных инъекций также базируются на наличии жидкости в сетчатке12,23,24.
Исследование фазы IIIb OCTAVE показало необходимость комплексной оценки активности заболевания с учетом морфологических критериев, в частности, при принятии решений об анти-VEGF-терапии. При сравнительном анализе оказалось, что через год терапии более значимое улучшение зрения достигалось у пациентов, которым инъекции проводились на основании не только снижения остроты зрения, но и регистрации признаков морфологической реактивации ВМД (рис. 4)25. Мониторинг наличия жидкости в сетчатке также может служить ориентиром для установления интервалов между инъекциями20.
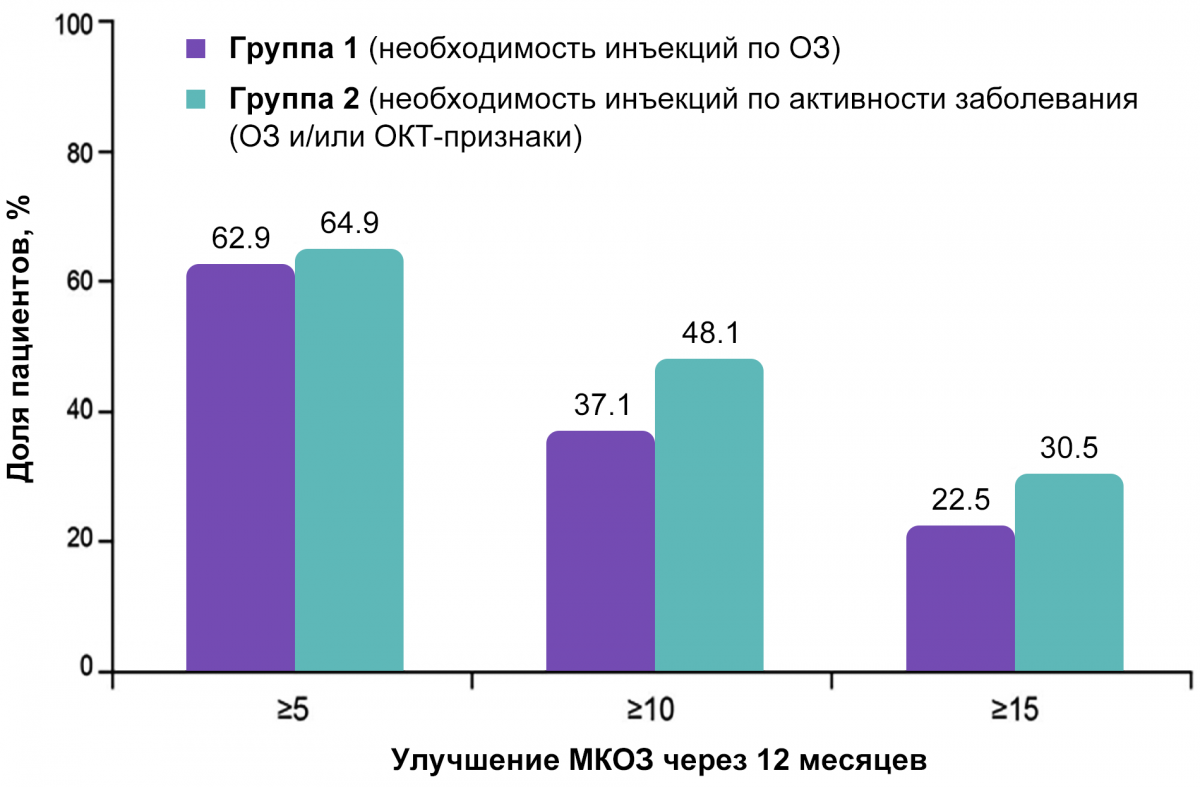
Рисунок 4. Исследование OCTAVE
Принятие решения на основании параметров активности заболевания (функциональные + морфологические исходы) приводит к численно большему повышению максимально корригированной остроты зрения через 12 месяцев терапии по сравнению с пациентами, у которых в качестве критерия использовались только функциональные исходы25.
Таким образом, принятие во внимание такого важного морфологического фактора, как жидкость в сетчатке, позволяет улучшить лечебную тактику при нВМД благодаря возможности более ранней и объективной диагностики и, следовательно, своевременному началу терапии.
Источники:
- Daruich A, Matet A, Moulin A et al. Mechanisms of macular edema: Beyond the surface. Prog Retin Eye Res. 2018 Mar;63:20-68.
- Sorrentino, F.S., Allkabes, M., Salsini, G., Bonifazzi, C., Perri, P., 2016. The importance of glial cells in the homeostasis of the retinal microenvironment and their pivotal role in the course of diabetic retinopathy. Life Sci. 162, 54–59.
- Nakanishi, M., Grebe, R., Bhutto, I.A., Edwards, M., McLeod, D.S., Lutty, G.A., 2016. Albumen transport to Bruch's membrane and RPE by choriocapillaris caveolae. Invest. Ophthalmol. Vis. Sci. 57, 2213–2224.
- Klaassen, I., Van Noorden, C.J.F., Schlingemann, R.O., 2013. Molecular basis of the inner blood-retinal barrier and its breakdown in diabetic macular edema and other pathological conditions. Prog. Retin. Eye Res. 34, 19–48.
- Королева И.А., Гветадзе А.А., Романова Т.Б. Фармакотерапия ВМД: обзор новых тенденций. РМЖ «Клиническая Офтальмология» №2 от 27.05.2019, стр. 105-109.
- Silvester A. Age-related macular degeneration and its effect on quality of life. J R Soc Med. 2009;102(8):310.
- Novais EA, et al. Multimodal Imaging in Retinal Disease: A Consensus Definition. Ophthalmic Surg Lasers Imaging Retina. 2016;47(3):201-5.
- Holz FG et al. Ophthalmology. 2017;124:464-478.
- Busbee BG, Ho AC, Brown DM, Heier JS, Suñer IJ, Li Z, Rubio RG, Lai P; HARBOR Study Group. Twelve-month efficacy and safety of 0.5 mg or 2.0 mg ranibizumab in patients with subfoveal neovascular age-related macular degeneration. Ophthalmology. 2013 May;120(5):1046-56.
- CATT Research Group. New Engl J Med. 2011;364(2):1897-1908.
- Lalwani G et al. Am J Ophthalmol. 2009;148:43-58.
- Schmidt-Erfurth U, et al. Ophthalmology. 2015;122:822-32.
- Клинические рекомендации. Макулярная дегенерация возрастная. Эл.ресурс [Обращение 17.01.2020].
- Waldstein SM, et al. Ophthalmology. 2016;123:1521-1529.
- Schmidt-Erfurth U & Waldstein SM. Prog Retin Eye Res. 2016;50:1–24.
- IVAN Study Investigators. Ophthalmology. 2012;119:1399-1411.
- Kodjikian L, et al. Ophthalmology. 2013;120:2300-2309. 4. Busbee BG, et al. Ophthalmology. 2013;120:1046-1056.
- Berg K, et al. Ophthalmology. 2015;122:146-152.
- Richard G, et al. Ophthalmology. 2015;122(12):2497-503.
- Wykoff CC, et al. Ophthalmology. 2015;122(12):2514-2522.
- Kertes PJ, et al. Ophthalmology. 2019;S0161-6420(18)31779-2.
- Gillies MC et al. JAMA Ophthalmol, 2019; doi: 10.1001/jamaophthalmol.2018.6776.
- Royal College of Ophthalmologists. Age-Related Macular Degeneration: Guidelines for management. 2013.
- American Academy of Ophthalmology. Age-Related Macular Degeneration Preferred Practice Patterns. 2015.
- Staurenghi G, Garweg JG, Gerendas BS, et al. Functional versus functional and anatomical criteria-guided ranibizumab treatment in patients with neovascular age-related macular degeneration — results from the randomized, phase IIIb OCTAVE study. BMC Ophthalmol. 2020;20(18):1–11.
- Chakravarthy U, et al. Eye (Lond.) 2020 Feb 17. doi: 10.1038/s41433-020-0799-y. Figures reproduced with the permission of Springer Nature.
- Wykoff CC, et al. J Manag Care Spec Pharm. 2018;24(2-a Suppl):S3-S15.
11439956/BRO/DIG/06.25/0
