Лечение пациентов с метастатическим немелкоклеточным раком легкого (НМРЛ) исторически состояло из системной цитотоксической химиотерапии. Лучшее понимание молекулярных путей, которые управляют злокачественными новообразованиями при НМРЛ, привело к разработке лекарственных препаратов, нацеленных на специфические молекулярные пути в злокачественных клетках, начиная с начала 2000-х годов.
Идентификация онкогенной активации определенных тирозинкиназ, в первую очередь мутаций рецептора эпидермального фактора роста (EGFR) или перестройки гена киназы анапластической лимфомы (ALK) или гена ROS1, мутации в гене BRAF, привела к сдвигу парадигмы в молекулярных методах лечения пациентов. Выделение этих подгрупп пациентов связано с идентификацией биомаркеров и методов лечения.
Предиктивными биомаркерами для прогнозирования эффективности таргетной терапии при распространенном НМРЛ являются соматические изменения генома, известные как «драйверные активирующие мутации» (рис. 1).
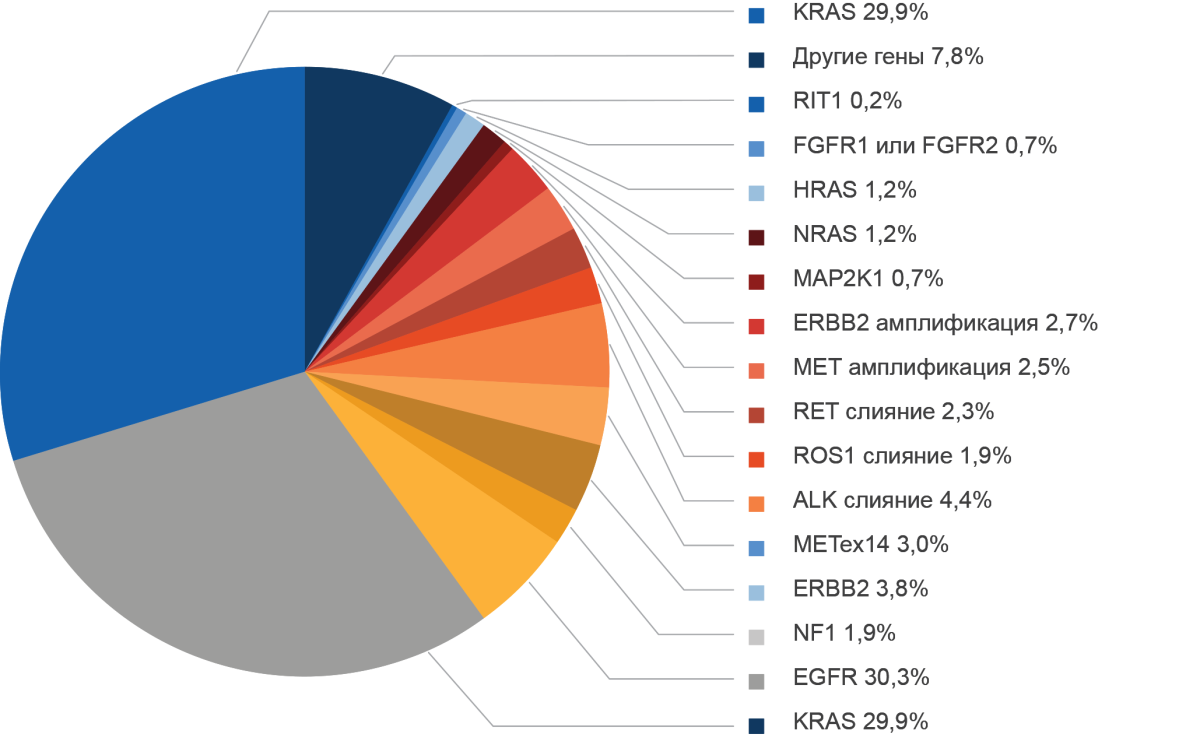
Рисунок 1. Молекулярно-генетические нарушения при распространенном/метастатическом раке легкого
Эти мутации происходят в опухолевых клетках, в генах, кодирующих белки, важные для роста и выживания клеток. Существуют другие повторяющиеся мутации при НМРЛ, которые менее важны для поддержания онкогенного фенотипа, и их часто называют «мутациями-пассажирами».
Драйверные мутации обычно не обнаруживаются в геноме зародышевой линии и не передаются по наследству, являются взаимоисключающими (т. е. маловероятно, что карцинома имеет более одной драйверной мутации). Драйверные мутации обычно являются трансформирующими, что означает, что они инициируют эволюцию клетки в злокачественную. Кроме того, эти мутации часто придают трансформированной клетке биологическую зависимость от онкогенов, а это означает, что мутировавший белок требует сигнала от драйвера для выживания.
При НМРЛ, как и при других злокачественных новообразованиях, сопоставление конкретного таргетного препарата с выявленной мутацией-драйвером для отдельного пациента привело к значительному повышению терапевтической эффективности, часто в сочетании со снижением токсичности. Выявление мутаций в этих генах становится стандартной частью диагностического исследования НМРЛ, и полученная информация необходима при выборе между химиотерапией в отсутствие мутации и таргетной терапией.
Примерно в 50 процентах опухолей легкого обнаружены генетические мутации, что приводит к использованию таргетного препарата в качестве терапии первой линии1.
У пациентов с распространенным НМРЛ следует оценивать опухоль на предмет наличия драйверных мутаций2. Рекомендации Колледжа американских патологов (CAP), Международной ассоциации по изучению рака легких (IASLC) и Ассоциации молекулярных патологов (AMP) рекомендуют анализ первичной опухоли или метастазов на драйверные мутации в гене, кодирующем рецептор эпидермального фактора роста (EGFR), киназу анапластической лимфомы (ALK) для всех пациентов, опухоль которых содержит элемент аденокарциномы, независимо от клинических характеристик пациента3,4.
Методы определения мутаций
Методы скрининга пациентов с НМРЛ на драйверные мутации постоянно развиваются, и не существует единой стандартной платформы для тестирования. Возможности, которые делают платформу клинически полезной, — это быстрое время выполнения работ (две недели или меньше). Для недавно диагностированных пациентов с неплоскоклеточным НМРЛ рекомендуется тестирование на EGFR (методом полимеразной цепной реакции [ПЦР], который занимает менее 2 недель); ALK иммуногистохимическим (ИГХ) или флуоресцентным in-situ тестированием (FISH) и ROS1 (FISH). Секвенирование следующего поколения (NGS) может быть выполнено вместо этих тестов или параллельно с этими тестами. Молекулярное тестирование может быть выполнено на отдельных пациентах с плоскоклеточным НМРЛ — например, у тех, кто мало курил или никогда не курил. ИГХ-тестирование выполняется для запрограммированного лиганда смерти 1 (PD-L1) для всех пациентов с неплоскоклеточным или плоскоклеточным немелкоклеточным раком легкого.
-
Стимуляция под влиянием уратных кристаллов синтеза провоспалительных медиаторов (циклооксигеназные и липоксигеназные метаболиты арахидоновой кислоты, фосфолипаза А2, ИЛ-1, ИЛ-8, ФНО, ИЛ-6, анафилатоксины, кинины и др.) фагоцитами, синовиальными клетками и другими компонентами сустава.
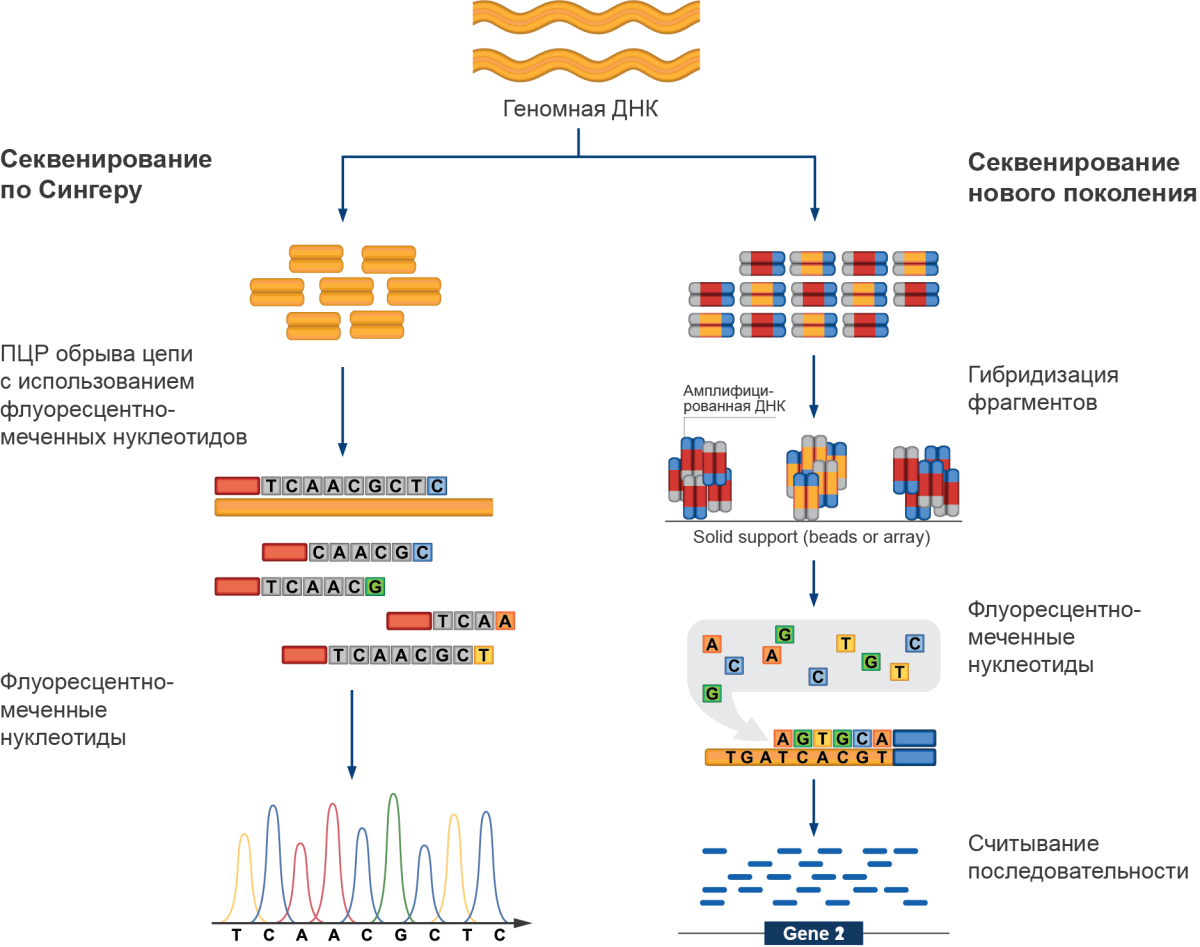
Рисунок 2. Метод секвенирования нового поколения
-
Аллель-специфическое тестирование. Аллель-специфическое тестирование анализирует ДНК с помощью полимеразно-цепной реакции (ПЦР) на предмет заранее известной мутации и в значительной степени заменяет прямое секвенирование. Это мультиплексный тест, который, как правило, быстрее и дешевле, чем секвенирование каждого гена по отдельности. Однако может идентифицировать только известные мутации и не может использоваться для выявления новых генетических альтераций.
-
Жидкостная биопсия. Молекулярная диагностика традиционно выполнялась на солидной опухоли. Жидкостная биопсия предоставляет возможность генотипирования менее инвазивным и менее дорогостоящим способом и дает возможность отслеживать молекулярные особенности в процессе лечения или прогнозировать рецидив после адъювантной терапии5,6. В настоящее время существует два одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) теста циркулирующей опухолевой ДНК (ctDNA) для пациентов с раком легкого, оба для драйверных мутаций в гене EGFR. Ограничение состоит в том, что чувствительность составляет от 60 до 80 процентов9,10. Например, в одном исследовании у 58 пациентов с EGFR-мутированным НМРЛ, которые приобрели устойчивость к ингибитору тирозинкиназы EGFR, оценивалось наличие мутации T790M в плазме. Чувствительность жидкостной биопсии к T790M составила 70 процентов9. Второе ограничение жидкостной биопсии — более высокая вероятность получения ложноотрицательных результатов по сравнению с традиционной биопсией, учитывая небольшое и переменное количество ДНК, которое опухоли могут выделять в кровоток (рис. 3).
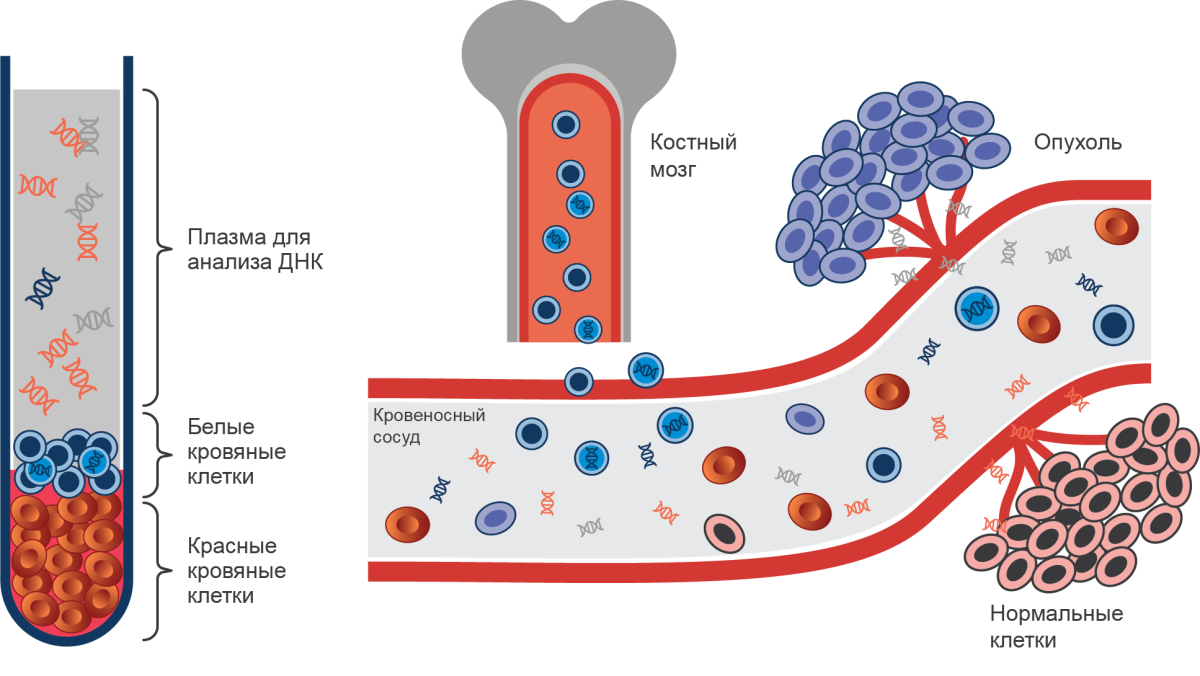
Рисунок 3. Метод жидкостной биопсии для определения генетических нарушений
Мутации, определяемые при НМРЛ
При НМРЛ выделяют разнообразные генетические нарушения, которые имеют определенные молекулярные особенности, включая лигандрецепторное взаимодействие, формирование сигнального каскада и др. (рис. 4).
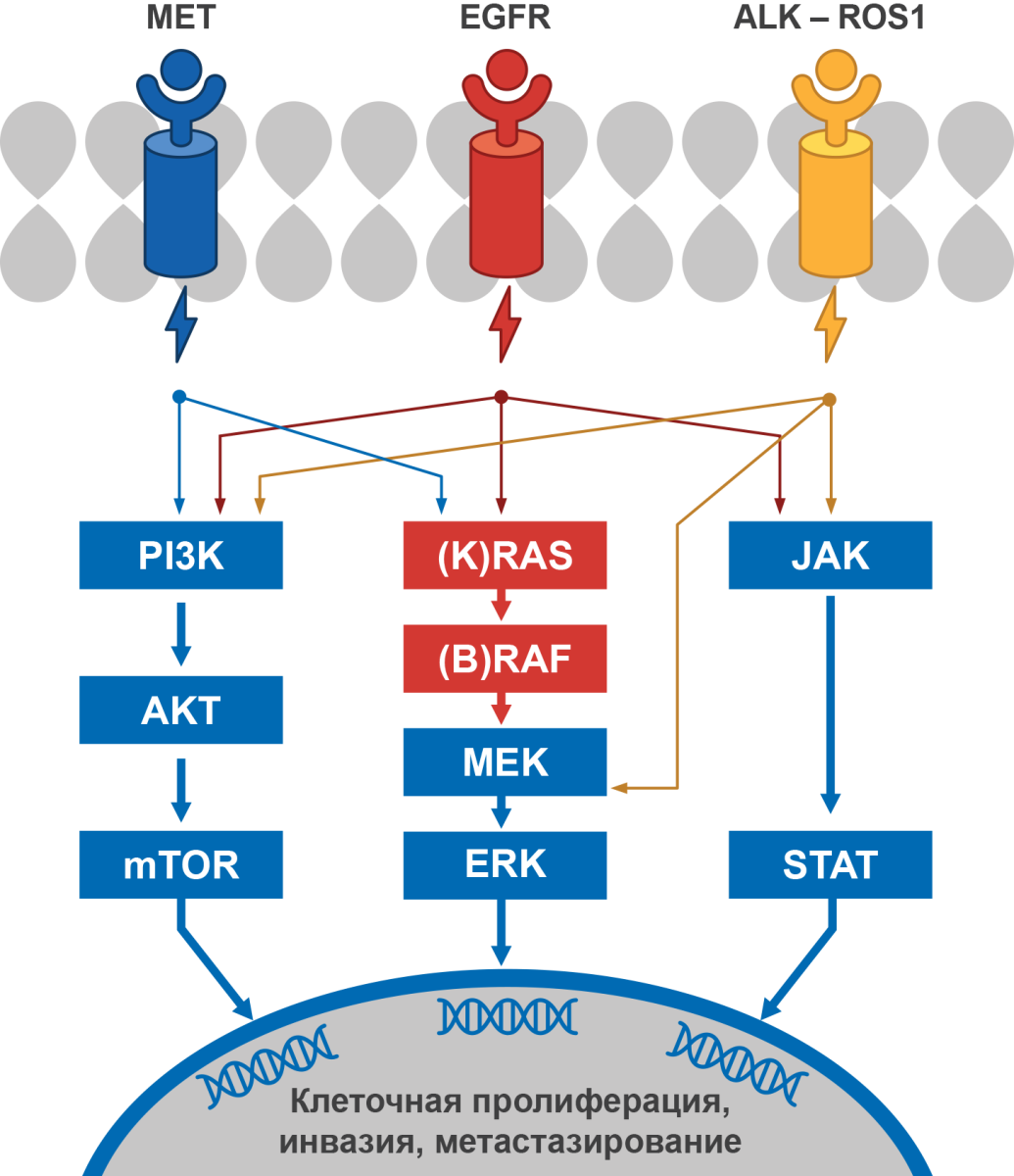
Рисунок 4. Варианты генетических нарушений при НМРЛ
Мутация в гене EGFR. Мутации в EGFR наблюдаются примерно в 15% НМРЛ и чаще встречаются у некурящих. В азиатских популяциях частота мутаций EGFR значительно выше, до 62 процентов11. При распространенном НМРЛ наличие мутации EGFR дает более благоприятный прогноз и предсказывает чувствительность к ингибиторам тирозинкиназы (TKI) EGFR, таким как эрлотиниб, гефитиниб, афатиниб и осимертиниб. Использование TKI EGFR основано на обнаружении этих мутаций в биоптате опухоли либо в материале жидкостной биопсии12. Утвержденные Управлением по контролю за продуктами и лекарствами США (FDA) тесты — это тест на мутацию Cobas EGFR для общих активирующих мутаций или тест на мутацию Cobas EGFR v2 для мутации T790M; любой результат мутации EGFR, выполненный сертифицированной лабораторией, приемлем для принятия клинических решений13.
Транслокация в гене ALK. Транслокации с участием тирозинкиназы анапластической лимфомы (ALK) присутствуют примерно в 4% НМРЛ в США и чаще встречаются у некурящих и более молодых пациентов. Транслокации ALK определяют с помощью FISH, ИГХ или большинства панелей секвенирования следующего поколения (NGS).
При НМРЛ на поздних стадиях наличие транслокации ALK прогнозирует чувствительность к TKI ALK (например, кризотиниб, церитиниб, алектиниб), и лечение этими препаратами значительно продлевает выживаемость без прогрессирования (ВБП)37.
Транслокация в гене ROS1. ROS1 представляет собой рецепторную тирозинкиназу, которая действует как онкоген-драйвер в 1–2% НМРЛ из-за генетической транслокации между ROS1 и другими генами, наиболее распространенным из которых является CD7414–20. Морфологические и клинические признаки, связанные с транслокациями ROS1, включают подтип аденокарциномы, чаще характерный для никогда не куривших молодых пациентов. Транслокации ROS1 определяют с помощью FISH, а также некоторых панелей NGS. Тирозинкиназа ROS1 очень чувствительна к кризотинибу из‑за высокой степени гомологии между доменами тирозинкиназы ALK и ROS14. Лечение кризотинибом одобрено FDA и рекомендовано пациентам с транслокацией ROS1, включая тех, кто прошел химиотерапию, и тех, кто не лечился ранее19.
Мутация в гене BRAF. BRAF является нижестоящим медиатором передачи сигналов KRAS, который активирует путь митоген-активируемой протеинкиназы (MAPK). Активирующие мутации BRAF наблюдались в 1–3% случаев НМРЛ и обычно связаны с курением в анамнезе22,23.
Они могут возникать либо в положении V600 экзона 15, как в меланоме, либо вне этого домена, и обычно выявляются с помощью ПЦР или методов NGS. Для пациентов с НМРЛ с мутациями BRAF V600E, у которых выявлен прогресс опухоли на химиотерапии, а также при отсутствии предшествующей терапии, может быть назначена комбинация дабрафениба и траметиниба, получившая одобрение для клинического применения. Ингибирование BRAF с помощью одиночных пероральных низкомолекулярных TKI (например, вемурафениб, дабрафениб) оказалось менее эффективной стратегией лечения прогрессирующего НМРЛ с наличием мутации в гене BRAF V600, по сравнению с комбинацией дабрафениба и траметиниба31–33.
В случае выявления других онкогенных драйверных мутаций при НМРЛ при отсутствии к ним препаратов направленного действия, зарегистрированных на территории РФ, в клинической практике возможно использование альтернативных опций лекарственной терапии33–36. Если опухоль экспрессирует PD-L1, назначают иммунотерапию33–36. Если химиотерапия уже проводилась, доступные варианты следующей линии включают таргетную терапию или иммунотерапию.
Список литературы:
- Barlesi F, Mazieres J, Merlio JP, et al. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet 2016; 387:1415.
- Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol 2013; 8:823.
- Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. Arch Pathol Lab Med 2013; 137:828.
- Leighl NB, Rekhtman N, Biermann WA, et al. Molecular testing for selection of patients with lung cancer for epidermal growth factor receptor and anaplastic lymphoma kinase tyrosine kinase inhibitors: American Society of Clinical Oncology endorsement of the College of American Pathologists/International Association for the study of lung cancer/association for molecular pathology guideline. J Clin Oncol 2014; 32:3673.
- Abbosh C, Birkbak NJ, Wilson GA, et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature 2017; 545:446.
- Jamal-Hanjani M, Wilson GA, McGranahan N, et al. Tracking the Evolution of Non-Small-Cell Lung Cancer. N Engl J Med 2017; 376:2109.
- Haber DA, Velculescu VE. Blood-based analyses of cancer: circulating tumor cells and circulating tumor DNA. Cancer Discov 2014; 4:650.
- Oxnard GR, Paweletz CP, Sholl LM. Genomic Analysis of Plasma Cell-Free DNA in Patients With Cancer. JAMA Oncol 2016.
- Oxnard GR, Thress KS, Alden RS, et al. Association Between Plasma Genotyping and Outcomes of Treatment With Osimertinib (AZD9291) in Advanced Non-Small-Cell Lung Cancer. J Clin Oncol 2016; 34:3375.
- Sacher AG, Paweletz C, Dahlberg SE, et al. Prospective Validation of Rapid Plasma Genotyping for the Detection of EGFR and KRAS Mutations in Advanced Lung Cancer. JAMA Oncol 2016; 2:1014.
- Shi Y, Au JS, Thongprasert S, et al. A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER). J Thorac Oncol 2014; 9:154.
- Merker JD, Oxnard GR, Compton C, et al. Circulating Tumor DNA Analysis in Patients With Cancer: American Society of Clinical Oncology and College of American Pathologists Joint Review. J Clin Oncol 2018; :JCO2017768671.
- http://www.fda.gov/medicaldevices/productsandmedicalprocedures/invitrodiagnostics/ucm301431.htm (Accessed on January 17, 2017).
- Bergethon K, Shaw AT, Ou SH, et al. ROS1 rearrangements define a unique molecular class of lung cancers. J Clin Oncol 2012; 30:863.
- Rimkunas VM, Crosby KE, Li D, et al. Analysis of receptor tyrosine kinase ROS1-positive tumors in non-small cell lung cancer: identification of a FIG-ROS1 fusion. Clin Cancer Res 2012; 18:4449.
- Chin LP, Soo RA, Soong R, Ou SH. Targeting ROS1 with anaplastic lymphoma kinase inhibitors: a promising therapeutic strategy for a newly defined molecular subset of non-small-cell lung cancer. J Thorac Oncol 2012; 7:1625.
- Lovly CM, Horn L, Pao W. ROS1 Fusions in Non-Small Cell Lung Cancer. My Cancer Genome https://www.mycancergenome.org/content/disease/lung-cancer/ros1/67/ (Updated March 25). 2016.
- Shaw AT, Ou SH, Bang YJ, et al. Crizotinib in ROS1-rearranged non-small-cell lung cancer. N Engl J Med 2014; 371:1963.
- Mazières J, Zalcman G, Crinò L, et al. Crizotinib therapy for advanced lung adenocarcinoma and a ROS1 rearrangement: results from the EUROS1 cohort. J Clin Oncol 2015; 33:992.
- Lim SM, Kim HR, Lee JS, et al. Open-Label, Multicenter, Phase II Study of Ceritinib in Patients With Non-Small-Cell Lung Cancer Harboring ROS1 Rearrangement. J Clin Oncol 2017; 35:2613.
- Drilon A, Somwar R, Wagner JP, et al. A Novel Crizotinib-Resistant Solvent-Front Mutation Responsive to Cabozantinib Therapy in a Patient with ROS1-Rearranged Lung Cancer. Clin Cancer Res 2016; 22:2351.
- Paik PK, Arcila ME, Fara M, et al. Clinical characteristics of patients with lung adenocarcinomas harboring BRAF mutations. J Clin Oncol 2011; 29:2046.
- Kinno T, Tsuta K, Shiraishi K, et al. Clinicopathological features of nonsmall cell lung carcinomas with BRAF mutations. Ann Oncol 2014; 25:138.
- Litvak AM, Paik PK, Woo KM, et al. Clinical characteristics and course of 63 patients with BRAF mutant lung cancers. J Thorac Oncol 2014; 9:1669.
- Villaruz LC, Socinski MA, Abberbock S, et al. Clinicopathologic features and outcomes of patients with lung adenocarcinomas harboring BRAF mutations in the Lung Cancer Mutation Consortium. Cancer 2015; 121:448.
- Planchard D, Kim TM, Mazieres J, et al. Dabrafenib in patients with BRAF V600-mutant advanced non- small cell lung cancer (NSCLC): A multicenter, open-label, phase II trial (BRF113928). Ann Oncol 2014; 25:1.
- Hyman DM, Puzanov I, Subbiah V, et al. Vemurafenib in Multiple Nonmelanoma Cancers with BRAF V600 Mutations. N Engl J Med 2015; 373:726.
- Fossella FV, DeVore R, Kerr RN, et al. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol 2000; 18:2354.
- Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol 2000; 18:2095.
- Planchard D, Kim TM, Mazieres J, et al. Dabrafenib in patients with BRAF(V600E)-positive advanced non-small-cell lung cancer: a single-arm, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17:642.
- Planchard D, Besse B, Groen HJ, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol 2016; 17:984.
- Planchard D, Besse B, Groen HJM, et al. An open-label phase II trial of dabrafenib (D) in combination with trametinib (T) in patients (pts) with previously treated BRAF V600E–mutant advanced non-small cell lung cancer (NSCLC; BRF113928). J Clin Oncol 2016; 34S: ASCO #107.
- Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 2017; 18:1307.
- Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med 2015; 373:1627.
- Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387:1837.
- Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387:1540.
- Ly AC, Olin JL, Smith MB. Am J Health Syst Pharm. 2018 Apr 15;75(8):515-522.
451369/TAB/WEB/052024/1
