Апластическая анемия (АА) — заболевание системы крови, характеризующееся панцитопенией (дефицит эритроцитов, лейкоцитов и тромбоцитов), обусловленной аплазией костного мозга, связанной с нарушением иммунных механизмов регуляции кроветворения, количественным дефицитом и функциональными дефектами стволовых кроветворных клеток1.
Ведущим механизмом развития АА считается аутоиммунная реакция, направленная на клетки — предшественницы гемопоэза. Костномозговая недостаточность при АА развивается в результате подавления пролиферации и стимуляции апоптоза гемопоэтических клеток-предшественниц активированными Т-лимфоцитами и Т-киллерами. Постепенно развивается аплазия костного мозга и значительное уменьшение пула гемопоэтических клеток1.
Уменьшение пула гемопоэтических клеток костного мозга сопровождается нарушением обмена железа и отложением железа в костном мозге, миокарде, печени, эндокринных и половых органах, что вызывает нарушение функции этих органов1.
Кроме того, течение АА может осложниться развитием таких клональных заболеваний, как пароксизмальная ночная гемоглобинурия (ПНГ), миелодиспластический синдром (МДС), острый миелоидный лейкоз (ОМЛ). Частота развития клональных осложнений может достигать 32% в течение 10 лет. Появление клонального кроветворения может быть выявлено и на более ранних этапах течения АА. Численность клеток ПНГ-клонов в процессе течения АА может меняться: увеличиваться вплоть до трансформации в классическую ПНГ или уменьшаться до полного исчезновения. Эволюция в классическую ПНГ составляет 11–17%1.
Первым клиническим проявлением АА, как правило, является геморрагический синдром различной интенсивности. Также могут наблюдаться более частые инфекции, симптомы анемии, повышенная утомляемость, одышка при физической нагрузке, зрительные расстройства в результате кровоизлияний в сетчатку1,2.
В отсутствие специфической терапии летальность АА превышает 70%3. При нелеченой тяжелой АА (ТАА) пациенты умирают в течение года4. У пациентов с ТАА наличие цитогенетических аномалий ухудшает прогноз5.
В европейских странах заболеваемость АА составляет 2 случая на 1 млн населения в год, в Восточной Азии заболеваемость АА в 2–3 раза выше6. АА может возникать в любом возрасте, однако пик заболеваемости наблюдается в возрасте от 10 до 25 лет и у пациентов старше 60 лет2. В РФ относится к орфанным заболеваниям.
Классификация заболевания
Самым распространенным вариантом приобретенной АА является идиопатическая АА (этиологический фактор не идентифицирован), на долю которой приходится порядка 80% случаев1.
Далее следуют вирус-ассоциированная АА, развивающаяся на фоне вирусного гепатита, вируса Эпштейна–Барр, вируса иммунодефицита человека, парвовируса В19 у пациентов с иммунодефицитом, и лекарственная или токсическая АА, развивающаяся как нежелательное явление при приеме хлорамфеникола, отравлении бензином и некоторыми другими агентами1.
В зависимости от наличия у пациента клонов стволовых клеток с мутацией в гене PIG-A — так называемый клон пароксизмальной ночной гемоглобинурии (ПНГ-клон) — выделяют1:
-
АА, протекающую без ПНГ-клона;
-
АА, протекающую с ПНГ-клоном;
-
АА, протекающую с синдромом ПНГ (субклинические признаки внутрисосудистого гемолиза).
В случае отсутствия эффекта от проводимой комбинированной иммуносупрессивной терапии (ИСТ) через 6 месяцев от начала лечения или после второго курса АТГ принято ставить диагноз рефрактерной АА1.
Диагностика АА
В соответствии с национальными клиническими рекомендациями по диагностике и лечению апластической анемии, диагноз АА устанавливается на основании клинических проявлений болезни и данных лабораторного обследования1.
Основными клиническими проявлениями АА являются1:
-
анемический синдром;
-
геморрагический синдром;
-
тяжелые инфекции.
Критерии постановки диагноза (рис. 1)1:
- Трехростковая цитопения: анемия (гемоглобин менее 110 г/л), гранулоцитопения (гранулоциты менее 2,0 × 109/л), тромбоцитопения (тромбоциты менее 100 × 109/л);
- Уменьшение клеточности костного мозга менее 25% (по отношению к возрастной норме), или клеточность более 25%, но менее 50% при содержании миелоидных элементов (т. е. исключая лимфоциты и плазматические клетки) менее 30% и отсутствие мегакариоцитов по данным пунктата костного мозга (стернальная пункция);
- Аплазия костного мозга (преобладание жирового костного мозга) в биоптате подвздошной кости (билатеральная трепанобиопсия).
В зависимости от уровня цитопении (выраженного сниженного числа клеток относительно нормы) выделяют следующие по тяжести формы АА1:
-
Нетяжелую АА — уровень нейтрофилов более 0,5 × 109/л;
-
ТАА — уровень нейтрофилов менее 0,5 × 109/л, тромбоцитопения менее 20 кл × 109/л;
-
Сверхтяжелую АА — уровень нейтрофилов менее 0,2 × 109/л.
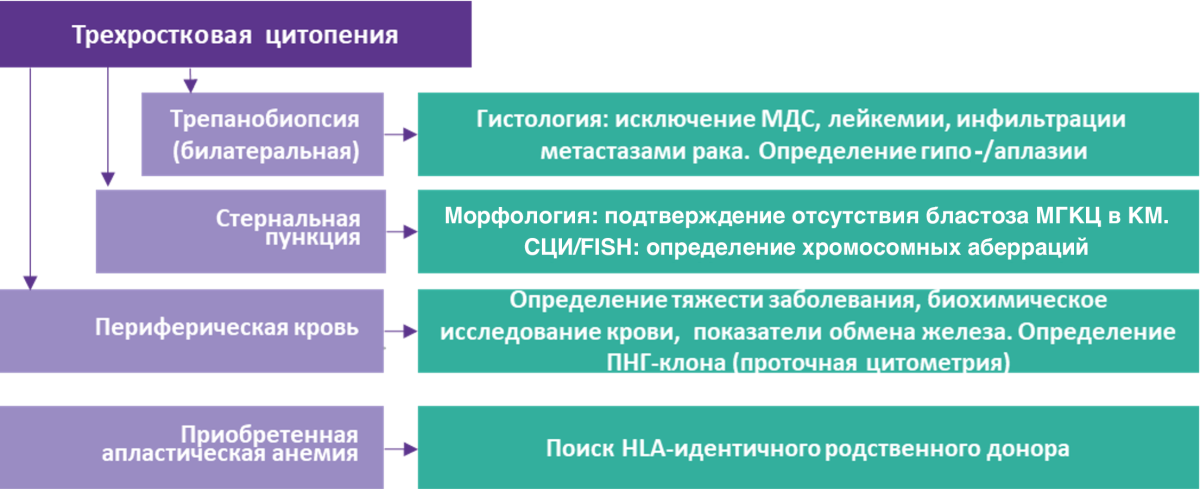
Рисунок 1. Алгоритм диагностики АА
Диагноз АА ставится методом исключения, таким образом, особое внимание следует уделить дифференциальной диагностике АА7. В ходе диагностики необходимо подтвердить диагноз и исключить возможные причины панцитопении и гипоцеллюлярного костного мозга, включая поздние проявления врожденных синдромов недостаточности костного мозга. На данный момент отсутствует единый метод, который позволил бы надежно установить диагноз приобретенной (идиопатической) АА1.
Изучение анамнеза
При сборе анамнеза пациента с подозрением на АА рекомендуется выявлять связь с возможными токсическими, лекарственными агентами или ассоциацию с вирусными гепатитами В и С. Необходим тщательный сбор семейного анамнеза для исключения врожденных аномалий, а также следует уточнять наличие сиблингов (родных братьев и/или сестер) для рассмотрения возможности проведения трансплантации гемопоэтических стволовых клеток (ТГСК)1.
Физикальный осмотр
При АА осмотр включает измерение и оценку1:
-
роста и массы тела;
-
температуры тела;
-
состояния костно-суставной системы;
-
наличия признаков геморрагического синдрома;
-
отсутствия гепатоспленомегалии, лимфоаденопатии;
-
наличия признаков дисфункции сердца, легких, печени, почек, органов эндокринной системы.
Рекомендуется обращать внимание на аномалии, характерные для врожденных форм АА: пигментацию кожных покровов, дистрофию ногтей, лейкоплакию слизистых, аномалии развития глаз, аномалии зубов, раннее поседение и выпадение волос, гипогонадизм1 и т. д.
Лабораторная диагностика
Рекомендуется выполнение следующих диагностических исследований1:
- Общий анализ периферической крови с определением абсолютного количества ретикулоцитов и подсчетом тромбоцитов «глазами». Для определения тяжести АА необходимо проведение 3 последовательных анализов крови;
- Биохимическое исследование крови;
- Исследование феррокинетики с целью выявления вторичного гемосидероза: железо сыворотки, ферритин сыворотки, общая железосвязывающая способность сыворотки, насыщение трансферрина железом, трансферрин;
- Цитологическое исследование костного мозга (стернальная пункция);
- Стандартное цитогенетическое и флуоресцентная гибридизация in situ (FISH) исследования клеток костного мозга (стернальный пунктат) с целью дифференциальной диагностики с миелодиспластическим синдромом (МДС);
- Гистологическое исследование костного мозга. Необходимо выполнение билатеральной трепанобиопсии передних или задних остей подвздошных костей с целью исключения гипопластического МДС;
- Цитохимическое исследование эритрокариоцитов. Выявление кольцевых сидеробластов в количестве более 5% требует дополнительного обследования для исключения МДС;
- Определение ПНГ-клона методом высокочувствительной проточной цитометрии. Выявление ПНГ-клона вне зависимости от процентного содержания ГФИ-дефектных клеток среди гранулоцитов, эритроцитов и моноцитов не исключает диагноз АА;
- Определение прямой пробы Кумбса. Наличие положительной пробы сомнительно для диагноза АА;
- Исключение системных коллагенозов у всех больных при диагностике АА: определение содержания в крови антител к кардиолипину, антител к бета-2-гликопротеину; исследование уровня антител фосфолипидов в крови (волчаночный антикоагулянт); определение содержания антинуклеарных антител, антител к двуспиральной (нативной) ДНК для исключения системных коллагенозов;
- При подозрении на врожденную АА — проведение теста на ломкость хромосом с использованием бифункционального алкилирующего агента (диэпоксибутан) для исключения анемии Фанкони;
- Секвенирование панели генов анемии Фанкони и врожденного дискератоза с целью исключения конституциональных форм АА при рефрактерном к ИСТ течении заболевания.
Лечение АА
Молодым пациентам и пациентам при наличии подходящего донора показано проведение трансплантации гемопоэтических стволовых клеток (ТГСК)1.
Патогенетическое лечение АА включает проведение комбинированной ИСТ (АТГ в комбинации с циклоспорином А), целью которой является уменьшение или устранение иммунной атаки на клетки-предшественницы1.
При наличии показаний назначается хелаторная терапия избыточного уровня железа, а также заместительная гемотрансфузионная терапия (эритроцитная масса, тромбоконцентраты, свежезамороженная плазма)1.
Сложности с терапией АА связаны с тем, что:
- Доноры для ТГСК находятся не более чем для 30% пациентов8;
- Трансплантация сопровождается потенциально жизнеугрожающими осложнениями, включая реакцию «трансплантат против хозяина»8;
- Порядка 30% пациентов с ТАА не отвечают на стандартную ИСТ9;
- Около 40% ответивших на ИСТ впоследствии рецидивируют5.
Причиной неэффективности ИСТ может быть доказанное снижение количества стволовых клеток и их неспособность воспроизвести гемопоэз в нужном объеме у пациентов с тяжелой АА10.
Общая схема лечения АА приведена на рис. 2.
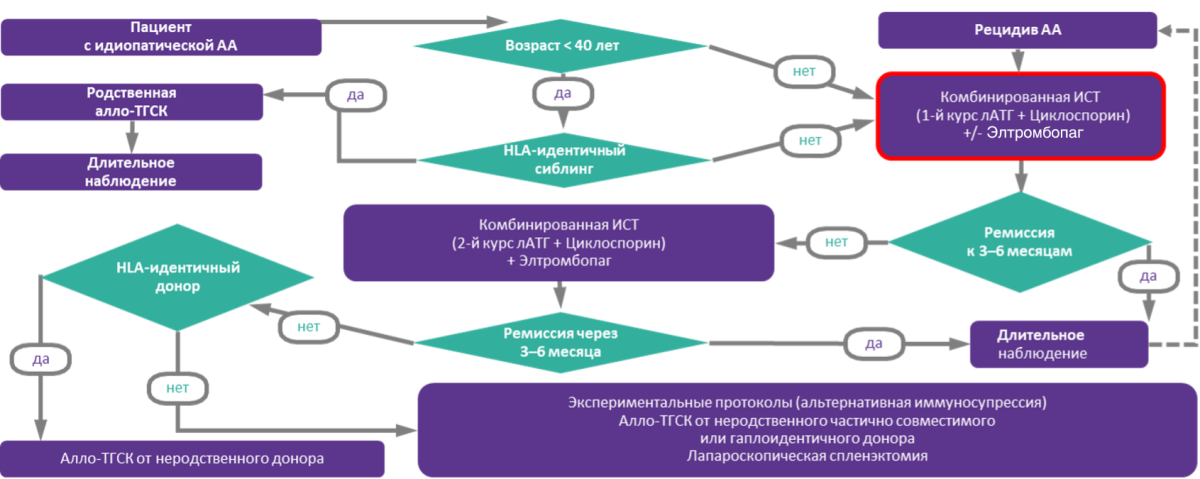
Рисунок 2. Алгоритм лечения АА
Список литературы:
- Михайлова ЕА, Фидарова ЗТ, Троицкая ВВ, и др. Клинические рекомендации по диагностике и лечению апластической анемии (редакция 2019 г.). Гематология и трансфузиология. 2020;65(2).
- Marsh JCW, Ball SE, Cavenagh J, и др. Guidelines for the diagnosis and management of aplastic anaemia. Br J Haematol. 2009;147(1):43–70.
- Montané E, Ibáñez L, Vidal X, и др. Epidemiology of aplastic anemia: a prospective multicenter study. Haematologica. 2008;93(4):518–523.
- Camitta BM, Thomas ED, Nathan DG, и др. A prospective study of androgens and bone marrow transplantation for treatment of severe aplastic anemia. Blood. 1979;53(3):504–514.
- Scheinberg P, Young NS. How I treat acquired aplastic anemia. Blood, J Am Soc Hematol. 2012;120(6):1185–1196.
- Peslak SA, Olson T, Babushok D V. Diagnosis and treatment of aplastic anemia. Curr Treat Options Oncol. 2017;18(12):70.
- Guinan EC. Diagnosis and management of aplastic anemia. Hematol Am Soc Hematol Educ Progr. 2011;2011:76–81. doi:10.1182/asheducation-2011.1.76
- Brodsky RA, Jones RJ. Aplastic anaemia. Lancet. 2005;365(9471):1647–1656.
- Desmond R, Townsley DM, Dumitriu B, и др. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood, J Am Soc Hematol. 2014;123(12):1818–1825.
- Maciejewski JP, Selleri C, Sato T, Anderson S, Young NS. A severe and consistent deficit in marrow and circulating primitive hematopoietic cells (long-term culture-initiating cells) in acquired aplastic anemia. 1996.
11213632/REV/WEB/07.24/0
