Источник: Kiltz U. et al. Secukinumab Retention and Effectiveness in Patients with Psoriatic Arthritis and Radiographic Axial Spondyloarthritis: 5-Year Final Results of a Prospective Real-World Study. Poster presented at the American College of Rheumatology (ACR) Convergence, Washington, D.C., United States, 14–19 November 2024. P2344.
Введение
- Секукинумаб — это полностью человеческое моноклональное антитело, которое избирательно блокирует интерлейкин-17А (IL-17A), играющий ключевую роль в патогенезе псориатического артрита (PsA) и рентгенологически подтвержденного аксиального спондилоартрита (r-axSpA)1-2.
- Секукинумаб продемонстрировал долгосрочную эффективность и благоприятный профиль безопасности в многочисленных клинических испытаниях, охватывающих различные аспекты псориатической болезни3-8.
- Данные реальной клинической практики о долгосрочном применении секукинумаба дополняют результаты клинических исследований, предоставляя информацию о пациентах с разнообразными характеристиками в условиях рутинной медицинской практики.
- Исследование SERENA (CAIN457A3403) — это неинтервенционное, проспективное исследование, проведенное в 19 странах, преимущественно европейских, с продолжительностью наблюдения до 5 лет у пациентов с умеренной или тяжелой хронической бляшечной формой псориаза, активным PsA или r-axSpA, которые получали секукинумаб в течение ≥16 недель до включения в исследование.
- Представлены окончательные 5-летние результаты по сохранению терапии и ее эффективности у пациентов с активным PsA или r-axSpA в рамках данного исследования.
Цель
Представить окончательные 5-летние результаты по сохранению терапии и эффективности секукинумаба у пациентов с активным псориатическим артритом (PsA) или рентгенологически подтвержденным аксиальным спондилоартритом (r-axSpA) в рамках исследования SERENA.
Методы
Дизайн исследования и пациенты
- Дизайн исследования SERENA был опубликован ранее9.
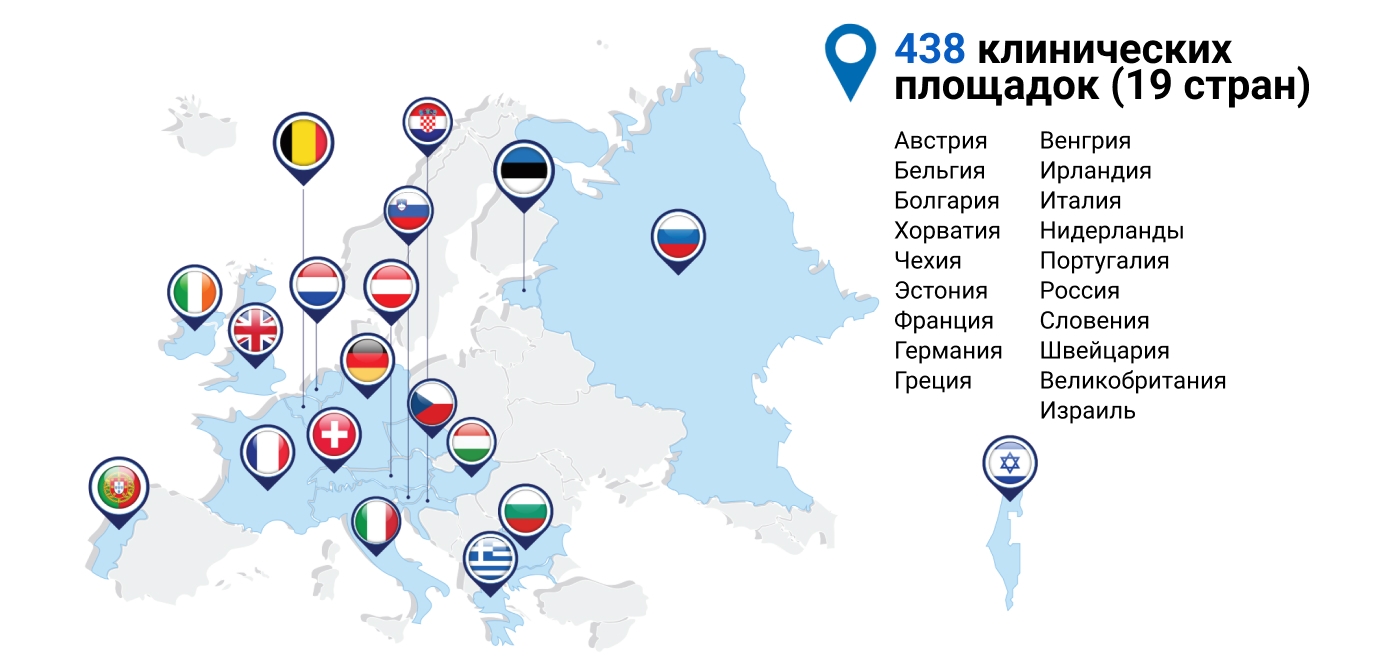
- Исследование SERENA проводилось на 438 клинических площадках в 19 странах (рисунок 1)9-10.
- Пациенты с умеренной или тяжелой хронической бляшечной формой псориаза, активным PsA или r-axSpA получали лечение секукинумабом в течение ≥16 недель до включения в исследование9.
- Данные собирались как ретроспективно, так и проспективно9.
Рисунок 1. Страны-участники исследования SERENA.
Дизайн исследования и пациенты
- Уровень удержания терапии секукинумабом на 1-м, 2-м, 3-м, 4-м и 5-м году наблюдения.
- Оценка эффективности включала:
- Подсчет опухших суставов (SJC) и болезненных суставов (TJC) у пациентов с PsA.
- Глобальную оценку активности заболевания пациентом (PtGA) с использованием числовой рейтинговой шкалы (NRS ≤2).
- Индекс активности болезни при анкилозирующем спондилите (BASDAI) у пациентов с r-axSpA на протяжении 5 лет.
Статистический анализ
- Уровень удержания терапии секукинумабом был рассчитан с использованием оценок Каплана-Мейера для пропорции пациентов, продолжающих лечение на 1, 2, 3, 4 и 5 годах наблюдения.
- Описание эффективности основано на данных, полученных непосредственно.
Результаты
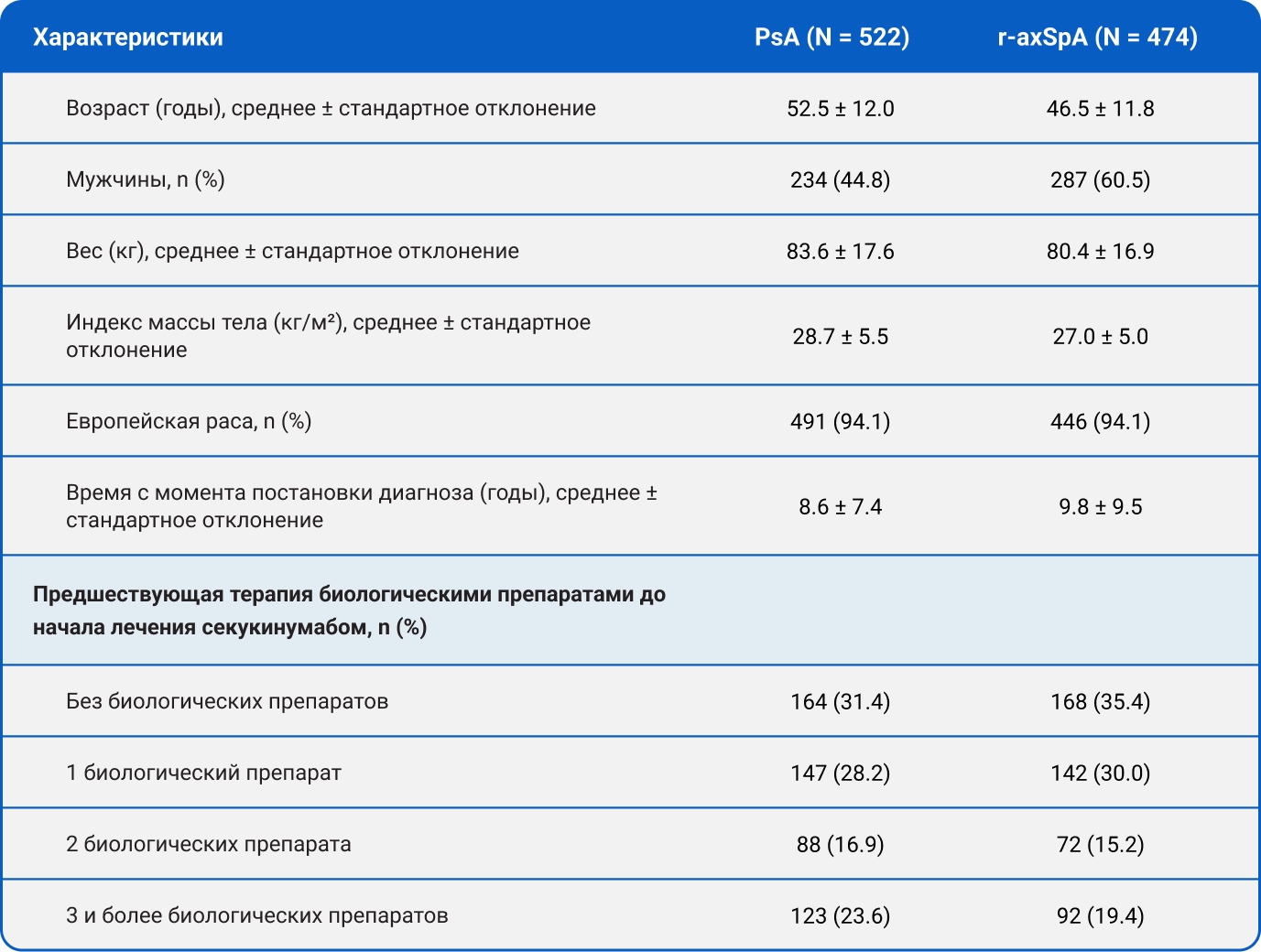
Демографические и исходные характеристики
- Всего в анализ были включены 522 пациента с PsA и 474 пациента с r-axSpA.
- Средний возраст участников на момент включения составил:
- 52,5 года в группе PsA,
- 46,5 года в группе r-axSpA.
- Мужчины составили:
- 44,8% в группе PsA,
- 60,5% в группе r-axSpA.
- Дополнительные исходные характеристики представлены в Таблице 1.
- До включения в исследование пациенты получали лечение секукинумабом в среднем в течение 1 года.
Таблица 1. Демографические и исходные характеристики.
N — общее число пациентов в группе; n — число пациентов с характеристикой; PsA — псориатический артрит; r-axSpA — рентгенологически подтвержденный аксиальный спондилоартрит; SD — стандартное отклонение.
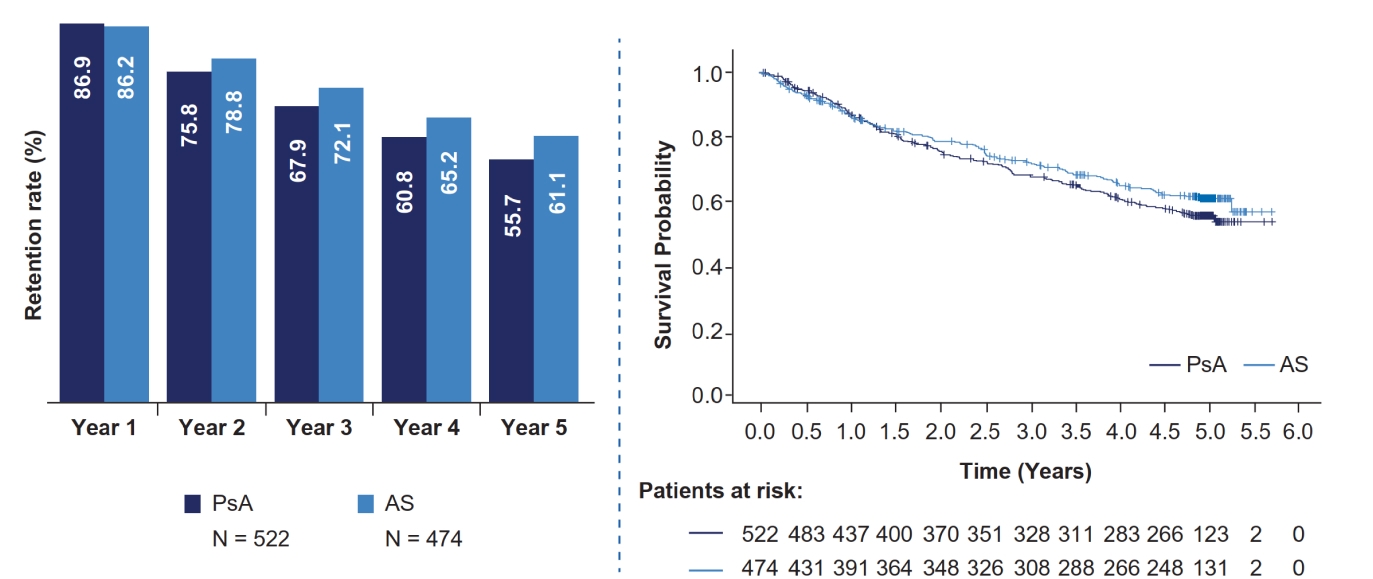
Уровень удержания терапии секукинумабом
- После включения в исследование уровень удержания терапии оставался высоким на протяжении всех 5 лет наблюдения как в группах с PsA, так и с r-axSpA (Рисунок 2).
Рисунок 2. Оценка удержания терапии секукинумабом у пациентов с PsA и r-axSpA с 1-го по 5-й год (оценки Каплана-Мейера).
PsA: псориатический артрит
r-axSpA: рентгенологически подтвержденный аксиальный спондилоартрит
Причины прекращения участия в исследовании
Наиболее распространенные причины прекращения терапии в группах PsA и r-axSpA:
- Отсутствие эффективности: 27,2% и 17,7% соответственно,
- Решение пациента: 11,9% и 8,6%,
- Утеря связи с пациентом: 5,7% и 6,1%,
- Нежелательные явления: 3,1% и 7,2%.
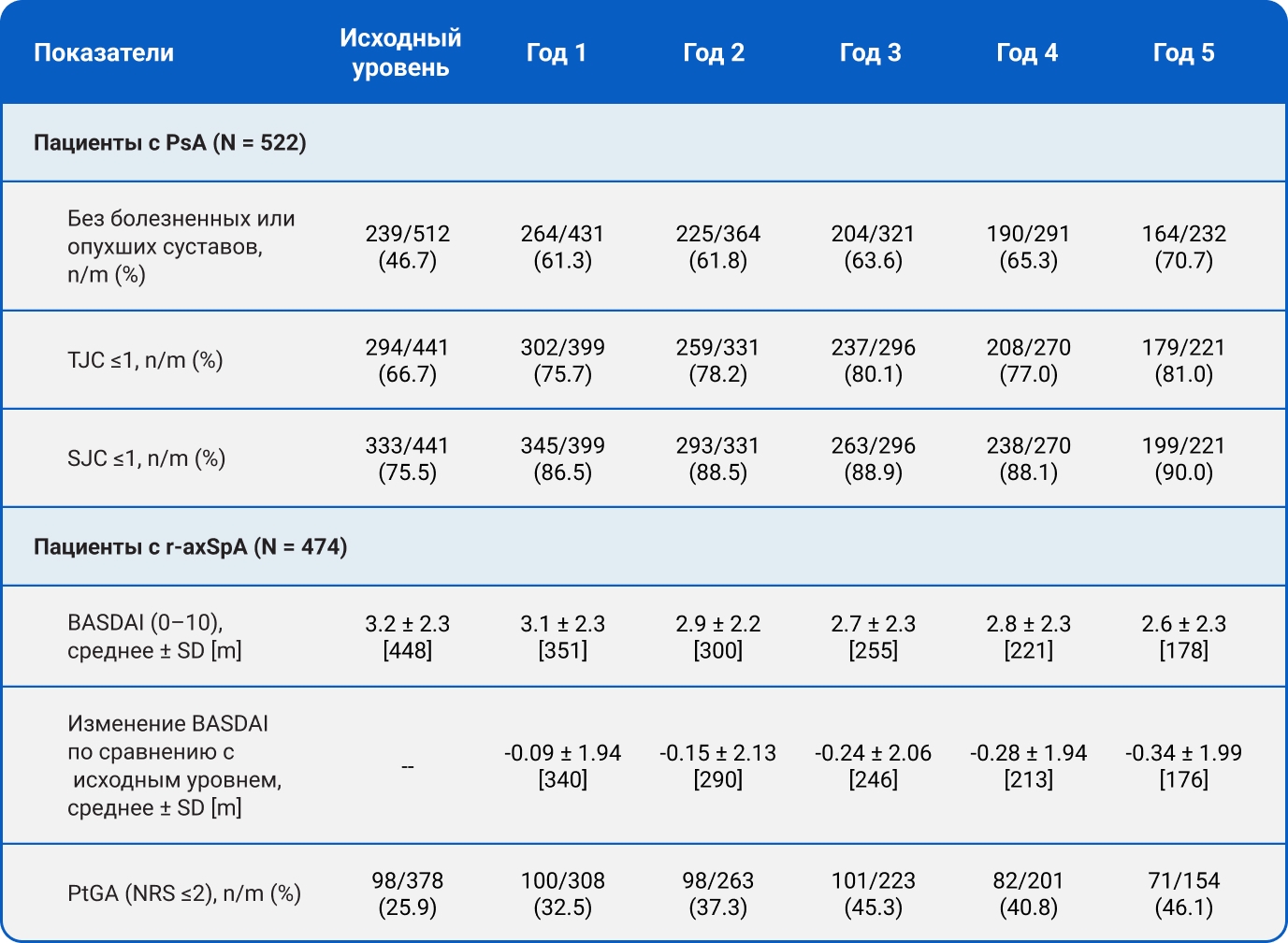
Эффективность
Количество болезненных и опухших суставов у пациентов с PsA, а также показатели BASDAI и глобальной оценки активности заболевания (PtGA) у пациентов с r-axSpA оставались стабильными на протяжении 5 лет терапии секукинумабом (Таблица 2).
Таблица 2. Эффективность секукинумаба у пациентов с PsA и r-axSpA с 1-го по 5-й год.
Выводы
- SERENA — одно из крупнейших наблюдательных исследований, проведенных в Европе, которое собирало данные реальной клинической практики на протяжении 5 лет у пациентов с псориатическим артритом (PsA) и рентгенологически подтвержденным аксиальным спондилоартритом (r-axSpA).
- Уровни удержания терапии были высокими, а эффективность сохранялась на протяжении 5 лет лечения секукинумабом у пациентов с PsA и r-axSpA в условиях проспективного наблюдения реальной практики.
Примечания:
BASDAI — индекс активности болезни при анкилозирующем спондилите;
BL — исходный уровень;
CFB — изменение по сравнению с исходным уровнем;
m — число пациентов с имеющимися данными;
N — общее число пациентов в группе;
n — число пациентов с ответом;
NRS — числовая рейтинговая шкала;
PtGA — глобальная оценка активности заболевания пациентом;
SJC — количество опухших суставов;
PsA — псориатический артрит;
r-axSpA — рентгенологически подтвержденный аксиальный спондилоартрит;
TJC — количество болезненных суставов.
Список литературы
- Mease PJ, et al. N Engl J Med. 2015;373:1329–1339.
- Baeten D, et al. N Engl J Med. 2015;373:2534–2548.
- Thaci D, et al. J Am Acad Dermatol. 2015;73:400–409.
- Langley RG, et al. N Engl J Med. 2014;371:326–338.
- Bissonnette R, et al. J Eur Acad Dermatol Venereol. 2018 Sep; 32(9):1507–1514.
- Bagel J, et al. J Am Acad Dermatol. 2017;77(4):667–674.
- Gottlieb AB, et al. Br J Dermatol. 2020;182(4):889–899.
- McInnes IB, et al. Rheumatol. 2017;56:1993–2003.
- Kiltz U, et al. Adv Ther. 2020;37(6):2865–2883.
- Augustin M, et al. J Eur Acad Dermatol Venereol. 2022;36(10):1796–1804.
- Mease PJ, et al. N Engl J Med. 2015;373:1329–1339.
- Baeten D, et al. N Engl J Med. 2015;373:2534–2548.
- Thaci D, et al. J Am Acad Dermatol. 2015;73:400–409.
- Langley RG, et al. N Engl J Med. 2014;371:326–338.
- Bissonnette R, et al. J Eur Acad Dermatol Venereol. 2018 Sep; 32(9):1507–1514.
- Bagel J, et al. J Am Acad Dermatol. 2017;77(4):667–674.
- Gottlieb AB, et al. Br J Dermatol. 2020;182(4):889–899.
- McInnes IB, et al. Rheumatol. 2017;56:1993–2003.
- Kiltz U, et al. Adv Ther. 2020;37(6):2865–2883.
- Augustin M, et al. J Eur Acad Dermatol Venereol. 2022;36(10):1796–1804.
11338905/SEC/DIG/01.25/0