Подагра — системное тофусное заболевание, характеризующееся отложением в различных тканях кристаллов моноурата натрия и развивающимся в связи с этим воспалением у людей с гиперурикемией1. Гиперурикемия может быть обусловлена внешнесредовыми и генетическими факторами1.
Этиология и патогенез
Подагра возникает из-за различных по происхождению нарушений метаболизма мочевой кислоты (синтеза и выведения) (рис. 1). Они приводят к стойкому повышению ее уровня в крови — гиперурикемии выше 420 мкмоль/л, при котором у части пациентов происходит образование кристаллов моноурата натрия. Чем выше сывороточный уровень мочевой кислоты, тем выше риск подагры1.
Основные причины гиперурикемии1:
-
генетические факторы, приводящие к повышению реабсорбции и снижению экскреции мочевой кислоты с мочой или к ее гиперпродукции;
-
избыточная масса тела и ожирение;
-
повышение артериального давления;
-
прием алкоголя, потребление большого количества животного белка;
-
прием мочегонных препаратов;
-
заболевания и состояния, характеризующиеся гиперурикемией.
С современных позиций подагра рассматривается как прототипное иммуновоспалительное заболевание, развивающееся в течение жизни человека вследствие активации врожденного иммунитета. С этой точки зрения подагру можно квалифицировать как приобретенное аутовоспалительное заболевание. При этом подагра имеет кардинальное отличие от моногенных аутовоспалительных заболеваний. Оно заключается в том, что непосредственно воспаление при подагре индуцируется отложением кристаллов моноурата натрия (рис. 1), которые в свою очередь стимулируют синтез одного из главных провоспалительных цитокинов. Речь идет об интерлейкине-1 (ИЛ-1)2.
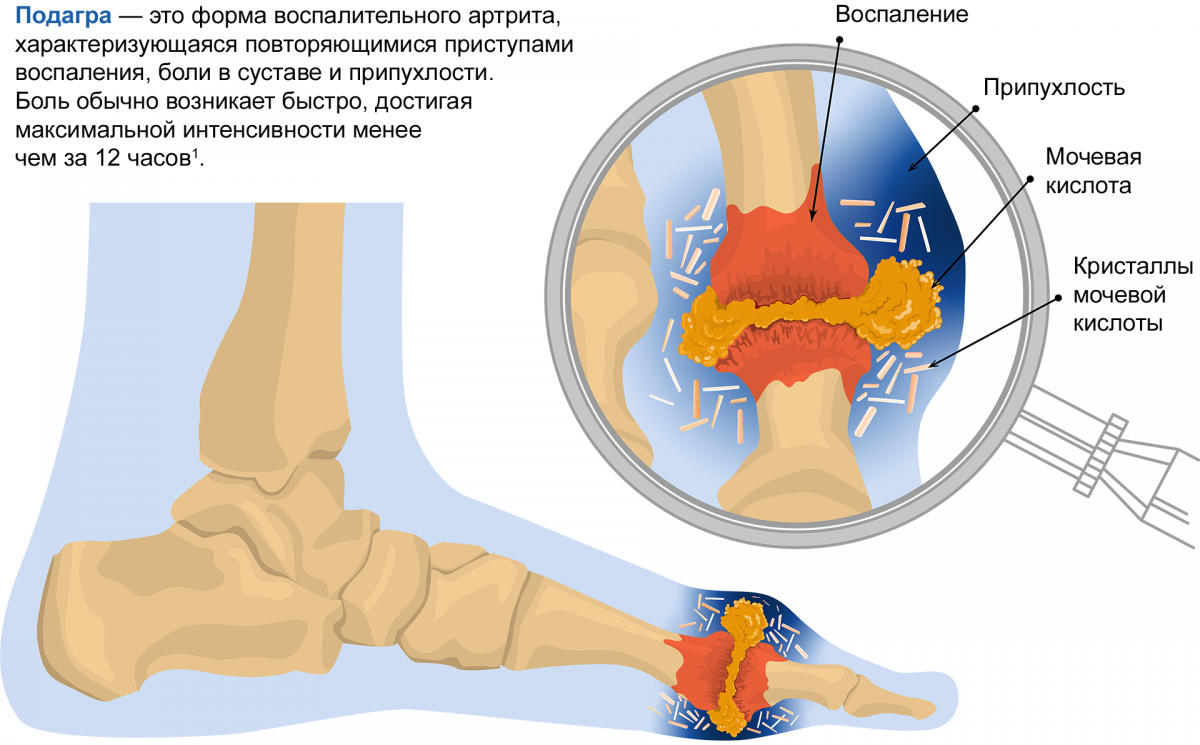
Рисунок 1. Отложение кристаллов моноурата натрия в области 1-го плюснефалангового сустава
Кроме ИЛ-1, в патогенезе подагры участвует целый ряд медиаторов воспаления, синтез и ингибирование которых определяют развитие, хронизацию и разрешение заболевания2. Клеточной основой запуска их синтеза является активация инфламмасомы в клетках, реализующих врожденный иммунитет: нейтрофилах, моноцитах/макрофагах, тучных клетках.
Активация инфламмасомы, в свою очередь, протекает в 2 этапа: праймирование и непосредственно активация. Сигналом для запуска первого этапа служит активация Toll-подобных рецепторов на мембране клеток, а результатом первого этапа является синтез компонентов, необходимых для сборки инфламмасомы. Второй этап запускается при участии кристаллов моноурата натрия, которые провоцируют нарушение баланса ионов и реализацию активных форм кислорода, что в конечном итоге приводит к разрушению клетки. Этому способствуют и эффекты каспазы-1, которая запускается при активации ИЛ-1 и других провоспалительных цитокинов. В последних исследованиях было показано, что в поддержании воспаления участвуют не только кристаллы моноурата натрия, но и растворимая мочевая кислота. Это объясняет тот факт, что чем больше длительность и тяжесть гиперурикемии, тем выше вероятность развития подагры3.
Основные этапы патогенеза подагры можно представить следующим образом4:
-
Стимуляция под влиянием уратных кристаллов синтеза провоспалительных медиаторов (циклооксигеназные и липоксигеназные метаболиты арахидоновой кислоты, фосфолипаза А2, ИЛ-1, ИЛ-8, ФНО, ИЛ-6, анафилатоксины, кинины и др.) фагоцитами, синовиальными клетками и другими компонентами сустава.
-
Адгезия нейтрофилов к эндотелию и поступление нейтрофилов в полость суставов.
-
Поступление провоспалительных медиаторов в кровяное русло.
-
Развитие системных проявлений, характерных для острого подагрического артрита.
Эпидемиология
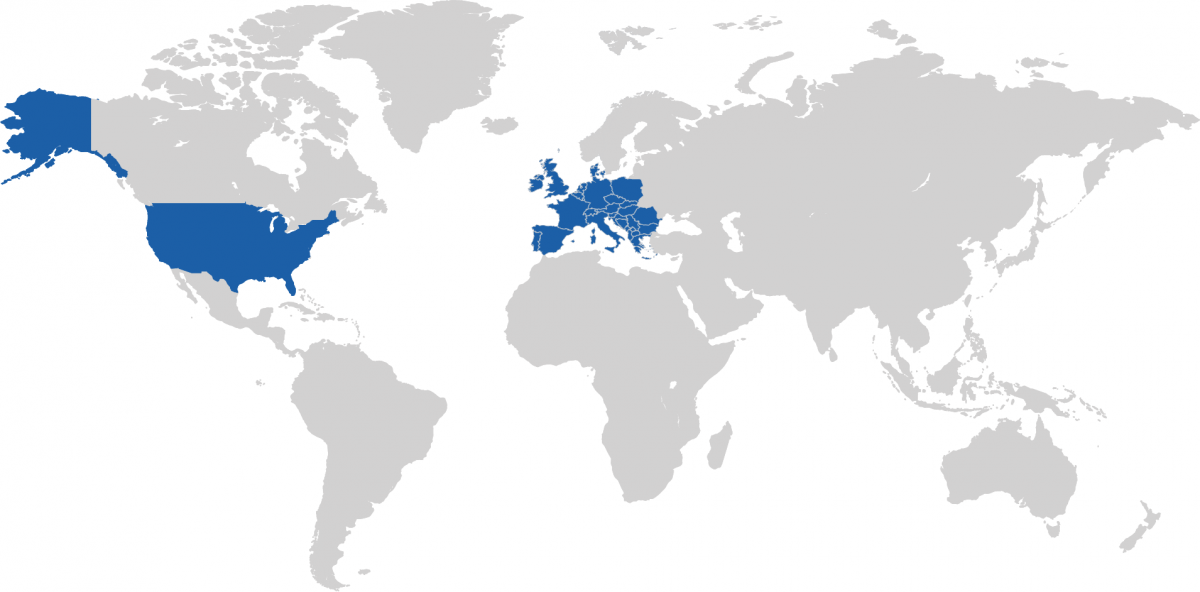
Распространенность подагры среди взрослого населения европейских стран колеблется от 0,9% до 2,5%; в США достигает 3,9%1.
Пик заболеваемости у мужчин регистрируют в возрасте 40–50 лет, у женщин — после 60 лет. Это объясняется воздействием эстрогенов на экскрецию мочевой кислоты. Подагра среди мужчин встречается в 6–7 раз чаще, в старческом возрасте — в 3 раза чаще5,6.
Острый приступ подагры у подростков и молодых людей наблюдают редко, обычно он опосредован первичным или вторичным дефектом синтеза мочевой кислоты5.
Основные клинические проявления подагры1:
-

рецидивирующие атаки острого артрита;
-

очаговое накопление кристаллов уратов с образованием тофусов в тканях (в области суставов, мягких тканей, различных органах);
-

нефролитиаз, подагрическая нефропатия.
В развитии подагры выделяют 4 стадии:
-
бессимптомная гиперурикемия с отсутствием депозитов моноурата натрия;
-
бессимптомная гиперурикемия с наличием депозитов моноурата натрия, но без симптомов или анамнеза подагры (отсутствие приступов артрита и тофусов);
-
депозиты моноурата натрия с текущим (острый подагрический артрит) или предшествующим эпизодом подагрического артрита (межприступный период при отсутствии артрита на текущий момент);
-
хроническая тофусная подагра (пациенты с тофусами, хроническим артритом, эрозиями по данным радиологических методов, функциональными нарушениями).
Диагностика
Для диагностики подагры в настоящий момент используют классификационные критерии7:
-
А.Наличие характерных кристаллов моноурата натрия в суставной жидкости.
-
Б.Наличие тофусов, в которых содержание кристаллов мочевой кислоты подтверждено химически или поляризационной микроскопией.
-
В.Наличие не менее чем 6 из 12 нижеперечисленных признаков:
-
1.Более одной атаки острого артрита в анамнезе.
-
2.Воспаление сустава достигает максимума в 1-й день болезни.
-
3.Моноартрит.
-
4.Гиперемия кожи над пораженным суставом.
-
5.Припухание и боль в первом плюснефаланговом суставе.
-
6.Одностороннее поражение первого плюснефалангового сустава.
-
7.Одностороннее поражение суставов стопы.
-
8.Подозрение на тофусы.
-
9.Гиперурикемия.
-
10.Асимметричный отек суставов.
-
11.Субкортикальные кисты без эрозий (рентгенография).
-
12.Отрицательные результаты при посеве синовиальной жидкости.
-
Диагноз считается достоверным при наличии критериев А и Б, являющихся самостоятельными. При отсутствии микроскопии предложено считать наличие 6 из 12 приведенных в пункте В признаков достаточным для диагностики подагры8.

Необходимо выявлять факторы риска подагры и сопутствующих заболеваний у каждого пациента, включая признаки метаболического синдрома (ожирение, гипергликемия, гиперлипидемия, гипертензия). Наиболее значимый фактор риска подагры — прием ряда лекарственных препаратов (диуретиков, циклоспорина А, салицилатов), а также почечная недостаточность, злоупотребление алкоголем, потребление сахаросодержащих напитков и продуктов питания9.
Пункция суставов для получения синовиальной жидкости для исследования
При подозрении на подагру следует выполнить артроцентез и анализ синовиальной жидкости1. При повторных атаках у больных с подтвержденной подагрой эта процедура не обязательна, но ее следует выполнить, если возникает подозрение на присоединение инфекционного артрита.
«Золотым стандартом» диагностики подагры служит поляризационная микроскопия (специфичность близка к 100%)1. Отсутствие кристаллов моноурата натрия в синовиальной жидкости не позволяет полностью исключить диагноз подагры (чувствительность только 70%).
Проще всего получить синовиальную жидкость из крупного сустава, как правило, коленного. Во-первых, этот сустав поражается почти при всех артропатиях; во-вторых, он самый крупный из синовиальных суставов; в-третьих, он «прост» для аспирации. Бессимптомные, но минимально воспаленные суставы обычно содержат большее, чем в норме, количество СЖ, что позволяет получить ее при пункции. Для исследования достаточно одной капли синовиальной жидкости на предметном стекле10.
Определение сывороточного уровня мочевой кислоты

Определение сывороточного уровня мочевой кислоты — также один из лабораторных методов диагностики подагры, однако его диагностическая значимость существенно меньше. Это связано с тем, что частота выявления гиперурикемии в популяции значительно превышает частоту подагры11.
Рентгенологическое исследование
Достаточно хорошо известен рентгенологический феномен, типичный для поздней подагры, — симптом «пробойника»12. Рентгенографически диагностируемые изменения развиваются в 10–40% случаев после повторных атак артрита и служат одним из поздних проявлений болезни. У большинства больных с рецидивирующим артритом и длительностью болезни 3–5 лет не удается идентифицировать какие-либо костные дефекты. Таким образом, рентгенологические изменения нельзя считать ранними для подагры12.
Ультразвуковое исследование в диагностике подагры
Ультразвуковое исследование (УЗИ) суставов при подагре позволяет визуализировать такой признак, как «двойной контур»1. Название «двойной контур» связано со способностью кристаллов моноурата натрия депонироваться на поверхности хряща, что при УЗИ выявляется как дополнительная светлая линия, параллельно линии перехода субхондральной кости в хрящ. Другой патологической находкой, которую можно идентифицировать с помощью УЗИ при подагре, является тофус. Выявление УЗИ-признаков заболевания способствует началу более раннего лечения.
Компьютерная и магнитно-резонансная томография
Компьютерную (КТ) и магнитно-резонансную томографию (МРТ) рекомендуется проводить только при подозрении на атипичное расположение тофусов1,13,14. С помощью КТ можно определить: мягкотканные депозиты промежуточной плотности, внутрикостные эрозии, тофусы. При МРТ на Т1 или Т2 последовательных изображениях регистрируют мягкотканные депозиты.
Медико-социальное бремя заболевания
Закономерным следствием хронического прогрессирующего поражения суставов и околосуставных структур является снижение качества жизни и исход в виде инвалидизации. Кроме того, показано, что присутствие у пациентов гиперурикемии и подагры ассоциируется с повышенной вероятностью развития и дальнейшего прогрессирования артериальной гипертензии, хронической болезни почек, метаболического синдрома, нарушениями липидного и углеводного обмена и, как следствие всего перечисленного, — с повышением общей и сердечно-сосудистой смертности15. Кроме того, в литературе есть описание развития вторичного амилоидоза с поражением почек у больных подагрой16.
Лечение и профилактика
Консервативное лечение подагры
Цель консервативной терапии — купирование острого или хронического артрита и дальнейшая профилактика приступов артрита, а также предупреждение образования и растворение имеющихся кристаллов моноурата натрия.
В качестве первой линии терапии острого артрита используют нестероидные противовоспалительные препараты, колхицин или глюкокортикоиды.
Выбор конкретного препарата должен определяться исходя из наличия и отсутствия противопоказаний, с учетом лекарственных взаимодействий. Лечение необходимо начинать как можно раньше от начала приступа артрита17.
Применение ингибиторов ИЛ-1 рекомендовано Европейской антиревматической лигой (EULAR) для лечения подагры у пациентов с частыми приступами артрита и противопоказаниями к назначению колхицина, НПВП и ГК, при этом во время терапии должна быть отрегулирована уратснижающая терапия18.
Уратснижающая терапия рекомендована всем пациентам со стойкой гиперурикемией и острыми атаками артрита (чаще двух раз в год), хроническим артритом, наличием тофусов18.
Хирургическое лечение
Хирургическое лечение подагры не является основным. Рекомендуется удаление тофусов, если они приводят к тяжелым осложнениям (туннельным синдромам, спинномозговой компрессии) и функциональным нарушениям1,19.
Профилактика
Рекомендуется обучение каждого пациента правильному образу жизни (уменьшение веса при ожирении, диета с ограничением пуринов животного происхождения, уменьшение приема алкоголя, особенно пива, подслащенных сахаром напитков)1.
Медикаментозная профилактика подагры (уратснижающие препараты) показана только пациентам, получающим химиотерапию по поводу злокачественных новообразований, прежде всего при лимфопролиферативных заболеваниях1.
Список литературы:
- Подагра. Клинические рекомендации Минздрава. 2018 г. URL: https://legalacts.ru/doc/klinicheskie-rekomendatsii-podagra-utv-minzdravom-rossii. (Дата доступа: 21.05.2024)
- Desai J, Steiger S, Anders HJ. Molecular Pathophysiology of Gout. Trends Mol Med. 2017;23(8):756-68.
- Ревматические болезни. Учебное пособие Ребров А.П., Скрябина Е.Н., Александрова О.Л., Никитина Н.М. – 2008.
- Choi, Hyon K.; Mount, David B.; Reginato, Anthony M. Pathogenesis of gout. Annals of Internal Medicine. 2005;143(7):499–516.
- Под ред. С.Л. Насонова. Клинические рекомендации. Ревматология. — ГЭОТАР-Медиа, 2008. — С. 112—119. — 288 с.
- Lisa K. Stamp, Tony R. Merriman, Nicola Dalbeth. Gout (англ.) // The Lancet. — 2016-10-22. — Т. 388, вып. 10055. — С. 2039–2052.
- Wallace S.L., Robinson H., Masi A.T. et al. Preliminary criteria for the classification of the acute arthritis of gout. Arthritis Rheum. 1977;(20): 895—900.
- Zhang W., Doherty M., Barskova V. et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics. Ann Rheum Dis 2006;65:1301–11.
- Kuo C.F., Grainge M.J., Zhang W., et al. Global epidemiology of gout: prevalence, incidence and risk factors. Nat Rev Rheumatol. 2015; №11:649–662.
- Барскова В.Г., Елисеев М.С., Владимиров С.А. Диагностика микрокристаллической патологии суставов методом поляризационной микроскопии (трактовка и методические рекомендации к исследованию). Совр ревматол 2010;1:86–7.
- Urano W., Yamanaka H., Tsutani H. et al. The inflammatory process in the mechanism of decreased serum uric acid concentrations during acute gouty arthritis. J Rheumatol 2002;29:1950–3.
- Борисенко Н.А., Шкиль Л.М. Подагра – болезнь старая и вечно новая. Внутренние болезни: Ревматология. Красноярск, 2002; 84 с.
- Shmerling R.H., Stern S.H., Gravallese E.M., Kantrowitz F.G. Tophaceous depsition in the finger pads without gouty arthritis. Arch Intern Med 1988;148:1830–2.
- Gerster J.C., Landry M., Duvoisin B., Rappoport G. Computed tomography of the knee joint as an indicator of intraarticular tophi in gout. Arthr Rheum 1996;39:1406–9.
- Bardin T, Richette P. Impact of comorbidities on gout and hyperuricaemia: an update on prevalence and treatment options. BMC Med. 2017;15(1):123. doi: 10.1186/s12916-017-0890-9.
- Никитина Н.М., Волошина Е.В., Лобанова О.С. и др. Случай АА-амилоидоза у больного с тофусной подагрой. Практическая медицина. 2011. 4(52). С. 195-197.
- Ruotsi A., Vainio U. Treatment of acute gouty arthritis with proquazone and indomethacin. A comparative, double-blind trial. Scand. J. Rheumatol. Suppl 1978;(21):15–17.
- Richette Р., Doherty М., Pascual Е. et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann. Rheum. Dis. 2016; (0):1–14.
- Iwona Słowińska, Radosław Słowiński, and Lidia Rutkowska-Sak. Tophi – surgical treatment. Reumatologia., 2016; 54(5): 267–272.
448695/CAN/DIG/05.24/0
