В последние годы заметно улучшились результаты лечения рака легкого. Главным образом это связано с возникновением знаний о молекулярных поломках, определяющих поведение опухоли, с одной стороны, и имеющихся таргетных препаратов — с другой. При этом именно гистологическая классификация опухолей остается основой для диагностики рака легких и ведения таких пациентов. По этой причине необходимым этапом верификации диагноза рака легкого и определения его разновидности является патологоанатомическое исследование1,2.
Эпидемиологическая картина
На сегодняшний день существует мировая статистика по заболеваемости раком легкого, которая учитывает показатели заболеваемости и смертности в популяции (рис. 1).
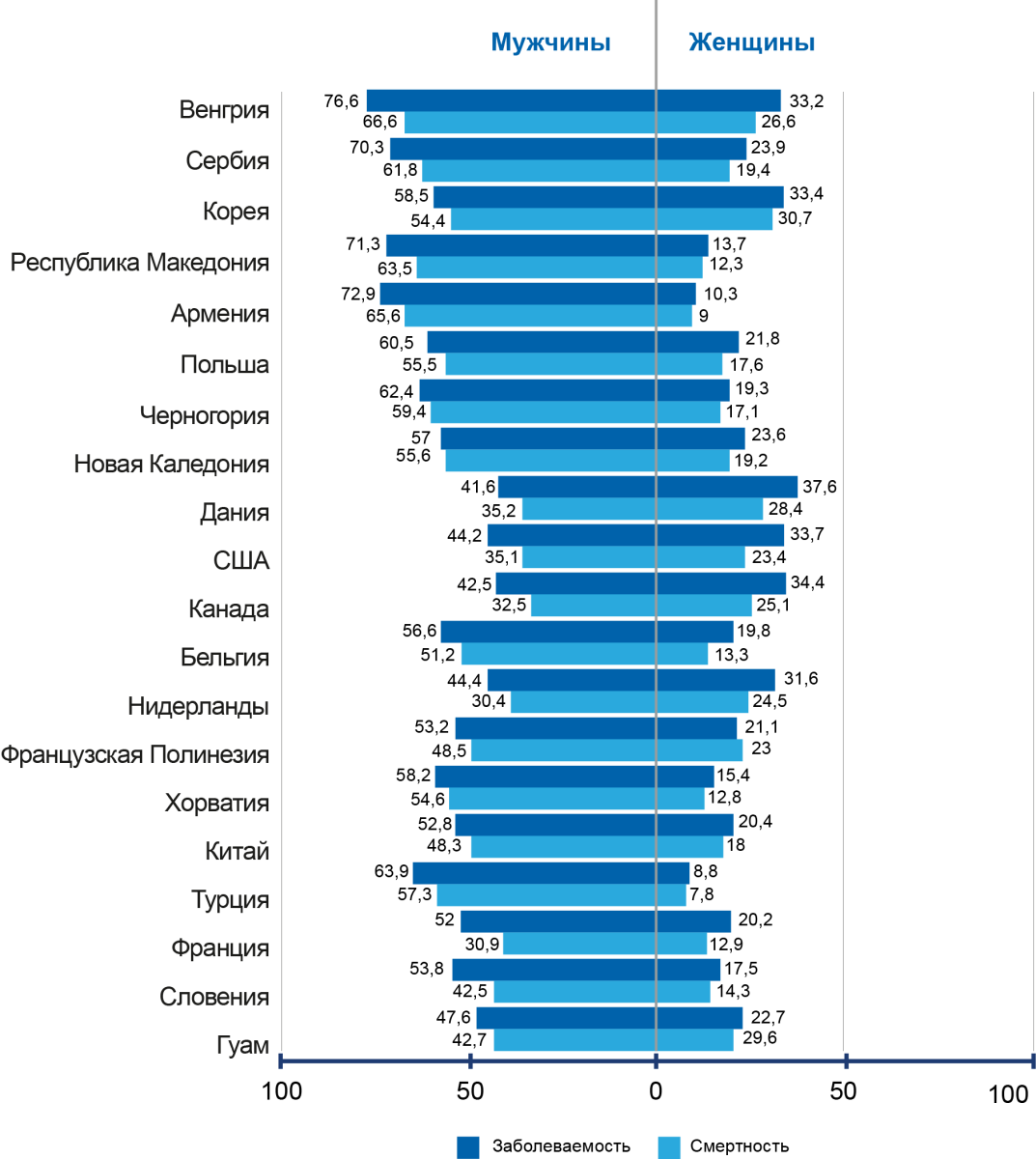
Рисунок 1. Мировая заболеваемость раком легкого (рис. 1)
на 100 000 человек во всех возрастах
В США заболеваемость раком легкого у мужчин достигла пика в 1980-х годах, после чего последовало снижение, с аналогичной картиной у женщин 20 лет спустя. С тех пор риск для женщин заметно вырос, став почти идентичным риску для мужчин. Смертность от рака легких у мужчин в настоящее время снижается в среднем на 2,9% ежегодно, причем процентное снижение примерно вдвое больше, чем у женщин (рис. 1).
В Великобритании наблюдаются аналогичные тенденции. Там распространенность курения среди мужчин достигла пика в 1940–1950-е годы, после чего последовал пик заболеваемости раком легких в 1970-х годах. Несмотря на снижение показателей у обоих полов, рак легких остается вторым по распространенности злокачественным новообразованием в Великобритании.
Иная картина наблюдается в Норвегии, Финляндии, Испании и Франции, где показатели заболеваемости раком легкого остаются стабильными.
В Японии же наблюдается высокий уровень заболеваемости и смертности от рака легкого, сравнимый с таковым в США и Европе1,2.
Этиология рака легкого
Одно из первых описаний рака легких было сделано в 1912 году Адлером в обширном обзоре отчетов о вскрытиях трупов в больницах США и Западной Европы, в которых было обнаружено 374 случая первичного рака легкого. Это составляло менее 0,5% всех случаев рака. Таким образом, Адлер пришел к выводу, что первичные злокачественные опухоли легкого являются одними из самых редких заболеваний. В 1920 году рак легкого составлял только 1% всех злокачественных новообразований в Соединенных Штатах. В течение следующих нескольких десятилетий исследователи в США и других странах отметили значительный рост заболеваемости первичным раком легкого.
В 1938 году Pear R. впервые показал, что степень неблагоприятного воздействия на продолжительность жизни увеличивается с ростом количества выкуриваемых сигарет. Наблюдения за пациентами и экспериментальные исследования на животных показали, что табачная смола, выделяющаяся при сжигании табака, является канцерогенным агентом. В 1941 г. Ochsner и DeBakey заявили о своей убежденности в том, что рост заболеваемости раком легкого во многом обусловлен увеличением курения3.
В проведенном в США исследовании по типу «опыт — контроль» Виндер и Грэм изучили 605 случаев рака легких у мужчин в сравнении с мужским населением без диагноза рака. Исследователи обнаружили, что 96,5% случаев рака легкого были у мужчин, которые в течение многих лет курили. Таким образом, авторы пришли к нескольким выводам: чрезмерное и продолжительное употребление табака было важным фактором в развитии рака легкого; рак легкого у некурящих встречался редко; период между прекращением курения и возникновением рака может составлять 10 и более лет (рис. 2).
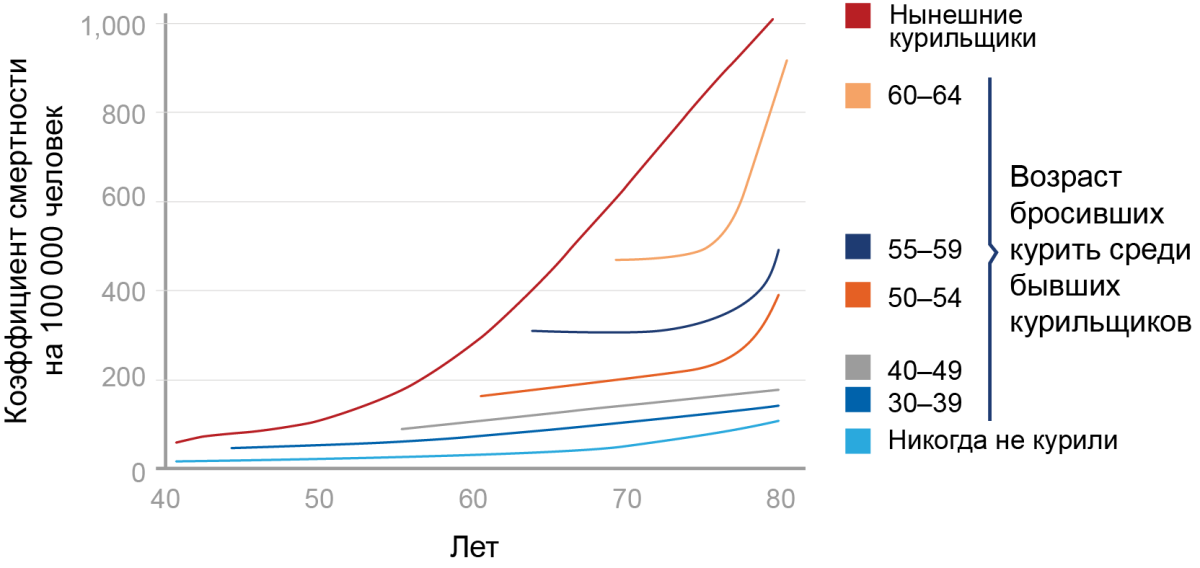
Рисунок 2. Связь возраста и анамнеза курения с риском смертей
Табачный дым содержит множество потенциальных канцерогенов, включая полициклические ароматические углеводороды, ароматические амины, N-нитрозамины, бензол, винилхлорид и другие соединения, в том числе неорганической природы, такие как мышьяк и хром. Стоит отметить, что полициклические ароматические углеводороды и N-нитрозамины сначала требуют метаболической активации, чтобы стать канцерогенами. При этом существует и метаболическая детоксикация этих соединений, в связи с чем можно сделать вывод, что риск развития рака, вероятно, определяется в том числе балансом между этими двумя процессами.
Радиоактивные элементы, такие как радон и продукты его распада (висмут и полоний), также присутствуют в табачном дыме3,4.
4-(метилнитрозамино)-1-(3-пиридил)-1-бутанон (NNK), который вызывает аденокарциному легких у экспериментальных животных, представляется наиболее важным индуктором рака легкого, оказывая канцерогенное действие как при местном, так и при системном применении.
Такие соединения, как NNK, могут ковалентно связываться с ДНК и создавать аддукты. Процессы репарации могут удалять эти аддукты и восстанавливать нормальную ДНК. Кроме этого, клетки, содержащие такую дефективную ДНК, могут подвергаться апоптозу. Нарушение работы механизмов репарации ДНК может привести к необратимым мутациям. NNK могут опосредовать активацию сигнального пути, который запускает модуляцию ряда онкогенов и генов-супрессоров опухолей, что в конечном итоге может привести к неконтролируемой клеточной пролиферации и онкогенезу.
Обнаружена связь NNK с мутациями, приводящими к активации онкогена K-ras. В свою очередь, активация онкогена K-ras была обнаружена в 24% аденокарцином легкого, в том числе в аденокарциномах легкого у бывших курильщиков. Этот факт позволяет предположить, что мутации могут не исчезать с прекращением курения. Это частично объясняет повышение риска рака легкого у бывших курильщиков, даже спустя годы после прекращения курения.
Метаболит бензопирена, в свою очередь, может повреждать различные локусы гена-супрессора опухолей p53, аномалии которых выявляются примерно в 60% случаев первичного рака легкого4.
Относительный риск рака легкого у длительных курильщиков в 10–30 раз выше, чем у некурящих на протяжении всей жизни.
Эффект от вдыхания дыма рекреационных наркотиков, таких как марихуана и кокаин, изучен меньше, однако в эпителии бронхов у курильщиков этих наркотиков были описаны метапластические и молекулярные изменения, подобные предраковым.
Исследования профилей генов на микрочипах показали, что аденокарциномы легких неоднородны, а профили рака у курильщиков и никогда не куривших индивидуумов различаются.
Воспаление как этиологический фактор рака легкого
Рак легкого может быть также и результатом хронического воспаления и фиброза в результате воздействия различных токсинов окружающей среды (например, асбеста, кремнезема или бериллия). Асбест является причиной примерно от 100 000 до 140 000 смертей от рака легкого в год во всем мире.
Асбест способен вызывать хроническое воспаление легких и плевры, выработку активных форм кислорода и, как следствие, повреждение ДНК, а затем и гибель бронхиальных и альвеолярных эпителиальных клеток, а также мезотелиоцитов. Аномальная репарация ДНК после повреждения активными формами кислорода может привести к генным и хромосомным мутациям, а затем и к опухолевой трансформации клеток3.
Различные раздражители окружающей среды, включая названные асбест и кремнезем, вызывают воспаление ткани легких и фиброз через активацию инфламмасом Nalp3, которые могут стимулировать каспазу-1. Nalp3 — это член семейства NLR, состоящего из более чем 20 белков. Формирование инфламмасомы Nalp3 происходит, когда активированный Nalp3 вовлекает в действие каспазу-1 и ASC, молекулу адаптера. Было обнаружено, что один из факторов, важных для активации инфламмасомы Nalp3, — это поглощение волокна асбеста фагоцитами. Таким образом, индуцированная асбестом и диоксидом кремния активация инфламмасом Nalp3 может быть новой терапевтической мишенью для лечения и профилактики основных причин рака, связанного с воспалением.
Клинические и эпидемиологические исследования показали тесную связь между воспалением при хронической инфекции и раком. Воспалительный компонент неопластического процесса включает разнородную популяцию лейкоцитов. Воспаление, ассоциированное с раком, влияет на многие стороны злокачественного процесса, включая пролиферацию и выживаемость опухолевых клеток, ангиогенез, а также метастазирование и ответ опухоли на химиопрепараты и гормоны. Более того, эпидемиологические исследования и метаанализ показали, что длительное использование нестероидных противовоспалительных препаратов снижает риск ряда солидных опухолей, включая рак легкого4.
Разновидности рака легкого
Большинство опухолей легкого — это карциномы. Основными гистологическими типами являются аденокарцинома, плоскоклеточный рак (ПКР), мелкоклеточный рак (МРЛ) и крупноклеточный нейроэндокринный рак (КНЭР) (рис. 3). Также встречаются преинвазивные поражения, доброкачественные опухоли, лимфопролиферативные процессы и различные другие, более редкие типы опухолей. Дифференциальная диагностика между всеми вариантами заболевания основана на гистологической картине.
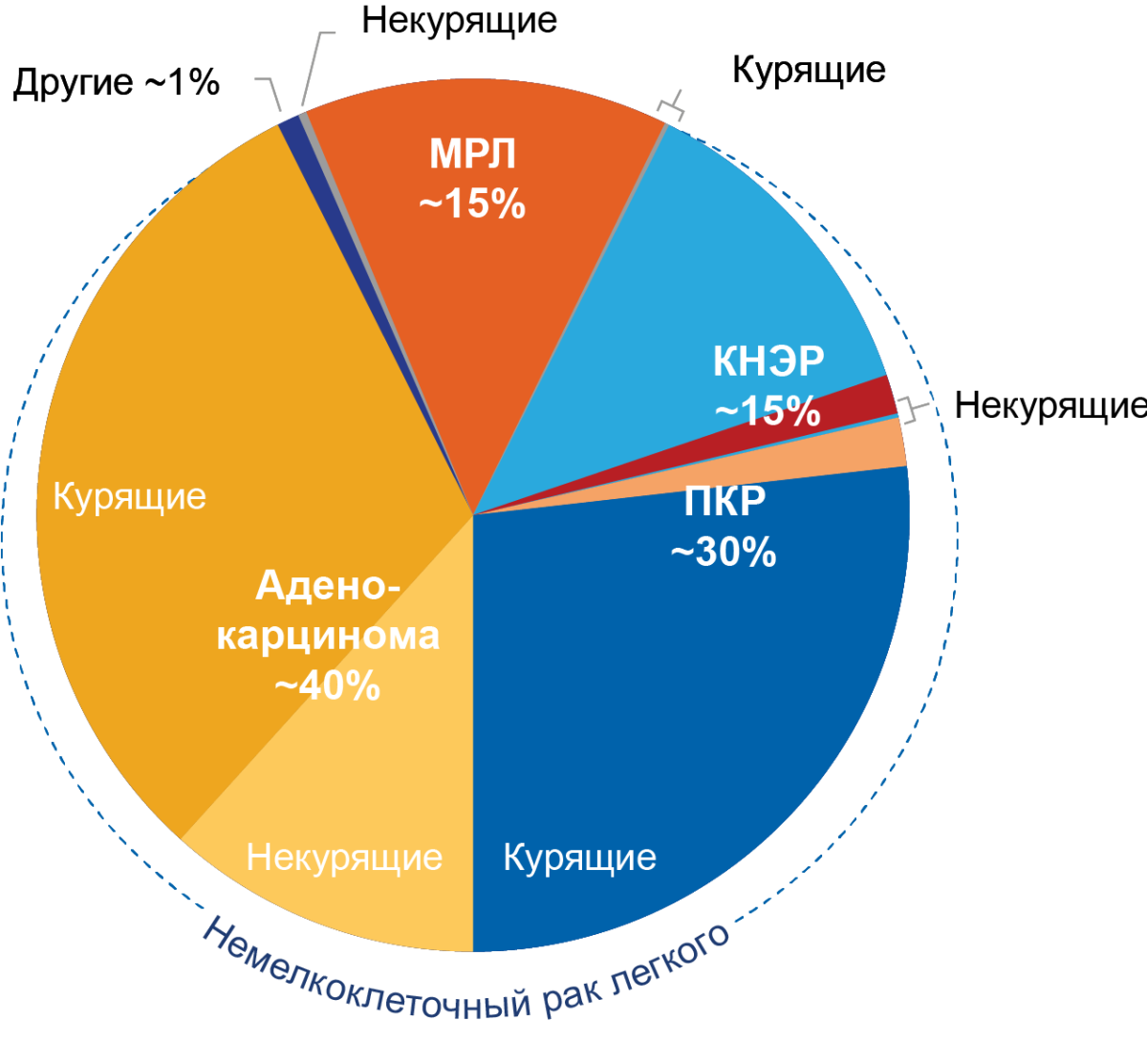
Рисунок 3. Гистологические варианты рака легкого
Пропорции различных гистологических типов значительно менялись с годами. В 1977–1981 гг. на плоскоклеточный рак приходилось 32% случаев в США, при этом к 2012–2016 гг. его доля снизилась до 22%. Аденокарцинома, наоборот, сначала составляла < 30% случаев, но к 2012–2016 гг. ее доля увеличилась до 50% и более. В свою очередь, доля мелкоклеточного рака снизилась с 17% до 13%. Изменение соотношений встречаемости может иметь не только биологические предпосылки, но и быть связано с изменением диагностических методов. Возникновение иммуногистохимии в контексте рутинной диагностики и таких специфичных маркеров, как TTF1 (для аденокарциномы) и p40 (для плоскоклеточного рака), также могло повлиять на распределение частот встречаемости нозологических единиц5.
Список литературы:
- Barta, J.A., Powell, C.A. and Wisnivesky, J.P., 2019. Global Epidemiology of Lung Cancer. Annals of Global Health, 85(1), p.8. DOI: http://doi.org/10.5334/aogh.2419
- Dela Cruz CS, Tanoue LT, Matthay RA. Lung cancer: epidemiology, etiology, and prevention. Clin Chest Med. 2011;32(4):605-644. doi:10.1016/j.ccm.2011.09.001.
- Kamp DW, Shacter E, Weitzman SA. Chronic inflammation and cancer: the role of the mitochondria. Oncology (Williston Park). 2011 Apr 30;25(5):400-10, 413. PMID: 21710835.
- Gomes M, Teixeira AL, Coelho A, Araújo A, Medeiros R. The role of inflammation in lung cancer. Adv Exp Med Biol. 2014;816:1-23. doi: 10.1007/978-3-0348-0837-8_1. PMID: 24818717.
- William D. Travis, Elisabeth Brambilla, Allen P. Burke, eds. WHO classification of tumours of the lung, pleura, thymus and heart. 4th ed. Lyon, France: IARC. 2015.
451308/TAB/WEB/052024/1
