Транслокация ALK определяется в НМРЛ, который содержит инверсию хромосомы 2, с 5’-концом гена EML4 (белка-подобного 4, ассоциированного с микротрубочками иглокожих), и 3’-концом гена киназы анапластической лимфомы (ALK), в результате чего образуется новый гибридный онкоген EML4-ALK1. Эта перестройка определяет отдельную клинико-патологическую подгруппу НМРЛ и обнаруживается примерно в 5% НМРЛ2.
Опухоли с транслокацией EML4-ALK или другими вариантами партнеров транслокации ALK связаны с клиническими особенностями, включая: отсутствие или легкое курение в анамнезе, более молодой возраст и морфологический подтип аденокарциномы (ацинарный паттерн роста) или муцинозной карциномы. Эта транслокация исключает мутации в EGFR и KRAS3.
Пациенты с аденокарциномой легких IV стадии должны быть обследованы на наличие перестройки гена ALK, независимо от курения в анамнезе. Перестройки гена ALK определяются с помощью тестов FISH, ИГХ (клон антитела D5F3) и ПЦР4. NGS также эффективно при обнаружении перестроек ALK5.
-
FISH. «Золотым стандартом» для диагностики ALK-положительного НМРЛ является FISH6–9. Коммерческие зонды включают два зонда разного цвета (красный и зеленый), которые ограничивают точку разрыва транслокации в ALK. В клетках без перестройки, перекрывающие друг друга красный и зеленый зонды дают желтый (слитый) сигнал; при транслокации ALK эти зонды разделены и наблюдается разделение красного и зеленого сигналов.
-
ИГХ. Моноклональные антитела были разработаны для ИГХ обнаружения транслокации ALK, и ИГХ с использованием этих антител является высокочувствительным и специфичным10. Тест Ventana ALK (D5F3) CDx был одобрен для использования в США FDA11. ПЦР с обратной транскрипцией была широко используемой стратегией скрининга для выявления перестройки гена ALK при НМРЛ, но больше не рекомендуется12. Был разработан ряд мультиплексных анализов для одновременного захвата всех возможных слияний в рамке считывания между EML4 и ALK, в которых киназный домен ALK сохранен13–15. Этот метод часто ограничен качеством РНК, которую можно выделить из архивной ткани.
По мере увеличения числа выявленных молекулярных аномалий были определены ключевые эпидемиологические, демографические и патологические особенности, связанные с транслокацией ALK. В неотобранных популяциях НМРЛ перестройка ALK является относительно редким событием, порядка 4 процентов7–9,13–17. Сходные частоты перестроек гена ALK были зарегистрированы в азиатских и западных популяциях18. Хотя общая частота слияния ALK в общей популяции НМРЛ невысока, знание клинико-патологических особенностей позволяет обогатить эту генетически определенную подгруппу.
Опухоли с транслокацией ALK очень чувствительны к ингибиторам тирозинкиназы (TKI) ALK. Лечение ALK TKI должно быть ограничено пациентами, опухоли которых содержат эту мутацию.
Результаты исследования фазы III, сравнивающего кризотиниб (ингибитор ALK первого поколения) с химиотерапией у не получавших лечения пациентов, продемонстрировали увеличение выживаемости без прогрессирования заболевания и качества жизни22.
Если требуется срочное системное лечение до получения результатов тестирования на наличие драйверных мутаций, показана системная химиотерапия, а не таргетная терапия23. В случае получения результатов молекулярного тестирования план лечения может быть пересмотрен. Нет клинических исследований, которые бы напрямую рассматривали оптимальное время приема ингибиторов ALK у пациентов, которые уже начали химиотерапию.
Предпочтительная таргетная терапия первой линии — на основании доступных клинических данных, включая исследование ALEX, подразумевает использование алектиниба в качестве первой линии терапии для пациентов с впервые диагностированным ALK-положительным НМРЛ. Для тех, у кого нет доступа к алектинибу, подходящие альтернативы включают кризотиниб или церитиниб.
В исследовании J-ALEX 207 японских ALK-позитивных пациентов с НМРЛ, ранее не получавших кризотиниб, были случайным образом распределены на группы алектиниба и кризотиниба24. При запланированном промежуточном анализе результаты демонстрируют улучшение ВБП на фоне приема алектиниба; медиана ВБП не была достигнута в группе алектиниба и составила 10,2 месяца в группе кризотиниба (отношение рисков [ОР] 0,34, 99,7% ДИ 0,17–0,70).
Несмотря на то, что алектиниб показан в первую очередь для тех, у кого обнаружен ALK-положительный распространенный НМРЛ, многие пациенты будут лечиться кризотинибом, который был первым доступным ингибитором ALK. Также доступен ингибитор нового поколения церитиниб, который демонстрирует повышенную эффективность по сравнению с кризотинибом. Оба препарата демонстрируют лучшие результаты по сравнению с химиотерапией при распространенном ALK-положительном НМРЛ. Церитиниб продемонстрировал более высокую эффективность по сравнению с комбинированной химиотерапией. В исследовании ASCEND-4, в котором участвовало 376 ALK-положительных пациентов с НМРЛ, ранее не получавших лечения, у пациентов, которым рандомизированно назначали церитиниб (750 мг/день), наблюдалось улучшение ВБП (16,6 против 8,1 месяца; HR 0,55, 95% ДИ 0,42–0,73) (рис. 1), частота объективных ответов (72,5 против 26,7%) и длительность ответа (23,9 против 11,1 месяца) по сравнению с назначенными пеметрекседом и препаратом платины25 (табл. 1).
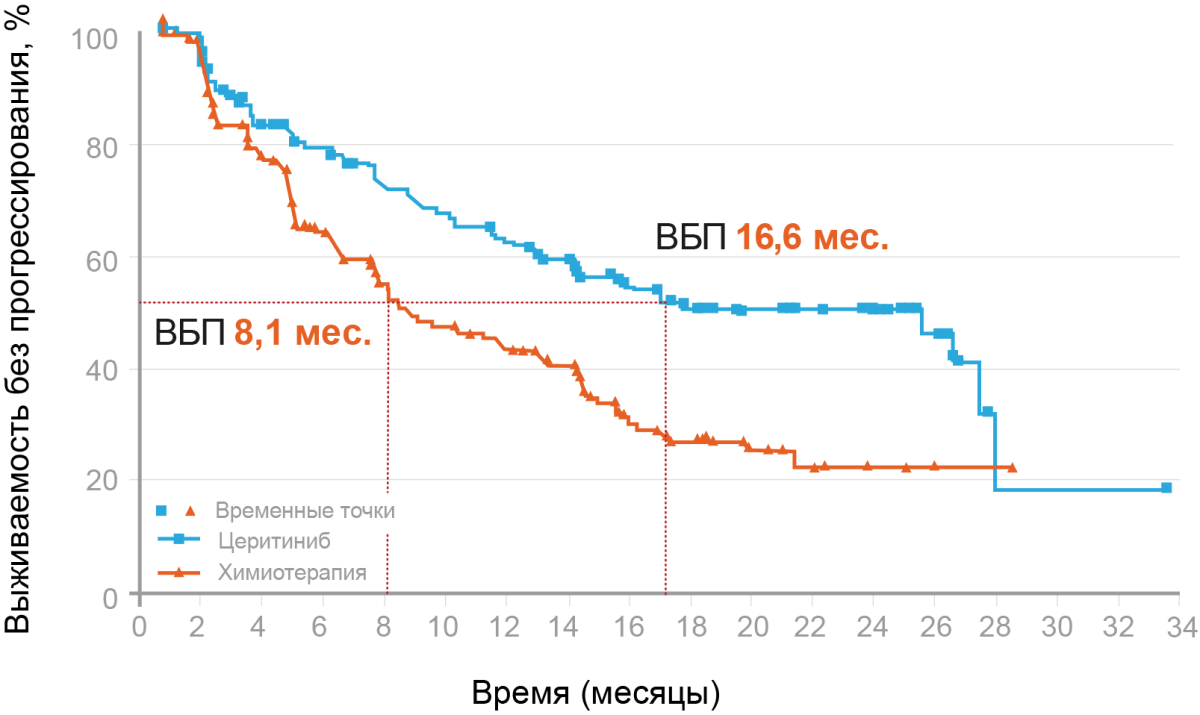
Рисунок 1. Показатели выживаемости без прогрессирования на фоне терапии церитинибом в исследовании ASCEND-4
Таблица 1 — Показатели частоты ответа на фоне терапии церитинибом в исследовании ASCEND-4
| Церитиниб (n = 189) | Химиотерапия (n = 187) | |
| Объективный ответ (ПО + ЧО), n (%) [95% Сl] | 137 (72,5) [65,5; 78,7] | 50 (26,7) [20,5; 33,7] |
| ПО, n (%) | 1 (0,5) | 0 |
| ЧО, n (%) | 136 (72,0) | 50 (26,7) |
| Стабилизация, n (%) | 23 (12,2) | 88 (47,1) |
| Прогрессия, n (%) | 19 (10,1) | 26 (13,9) |
| Неизвестно, n (%) | 10 (5,3) | 23 (12,3) |
| Медиана времени до наступления ответа, нед. | 6,14 (5,1–61,7) | 13,36 (5,1–90,1) |
| Медиана длительности ответа, мес. [95% Cl] | 23,9 [16,6–NE] | 11,1 [7,8–16,4] |
Лечение ингибиторами ALK обычно продолжается до тех пор, пока не появятся признаки прогрессирования заболевания. По мере прогрессирования может быть показано лечение ингибитором ALK нового поколения или стандартной химиотерапией. Однако доклинические и ранние клинические исследования показывают, что пациенты, которые приобрели мутации устойчивости к ALK при прогрессировании на ингибиторах ALK следующего поколения, могут все еще быть ALK-зависимыми. Наиболее распространенной мутацией устойчивости к ALK, наблюдаемой после алектиниба, является ALK G1202R, чувствительная к ингибитору третьего поколения лорлатинибу. Вторые по частоте мутации устойчивости к ALK — это мутации I1171, чувствительные к церитинибу или лорлатинибу26–28,31.
Лорлатиниб продемонстрировал активность у пациентов с мутацией ALK G1202R. Эта мутация придает устойчивость к другим ингибиторам ALK следующего поколения, включая церитиниб, алектиниб. При отсутствии мутаций резистентности к ALK после неэффективности алектиниба доклинические данные предполагают, что эти опухоли могут больше не быть чувствительными к монотерапии ингибиторами ALK31.
У бессимптомных и симптоматических пациентов с метастазами НМРЛ в головной мозг можно использовать алектиниб (и другие проникающие в мозг ALK TKI)30. Когда пациентам с ALK-положительным распространенным НМРЛ требуется химиотерапия, обычно предпочтительнее использовать пеметрексед или режим на основе пеметрекседа, поскольку почти у всех этих пациентов морфологический подтип аденокарциномы.
Исследования иммунотерапии на ранних и поздних этапах предполагают более низкую частоту ответа у никогда не курящих пациентов, в том числе с генетическими аберрациями ALK и EGFR. Клинические исследования часто исключали эту подгруппу пациентов, и однозначные данные отсутствуют.
Список литературы:
- Shaw AT, Solomon B. Targeting anaplastic lymphoma kinase in lung cancer. Clin Cancer Res 2011; 17:2081.
- Pikor LA, Ramnarine VR, Lam S, Lam WL. Genetic alterations defining NSCLC subtypes and their therapeutic implications. Lung Cancer 2013; 82:179.
- Takahashi T, Sonobe M, Kobayashi M, et al. Clinicopathologic features of non-small-cell lung cancer with EML4-ALK fusion gene. Ann Surg Oncol 2010; 17:889.
- Weickhardt AJ, Aisner DL, Franklin WA, et al. Diagnostic assays for identification of anaplastic lymphoma kinase-positive non-small cell lung cancer. Cancer 2013; 119:1467.
- Ignatius Ou SH, Azada M, Hsiang DJ, et al. Next-generation sequencing reveals a Novel NSCLC ALK F1174V mutation and confirms ALK G1202R mutation confers high-level resistance to alectinib (CH5424802/RO5424802) in ALK-rearranged NSCLC patients who progressed on crizotinib. J Thorac Oncol 2014; 9:549.
- Martelli MP, Sozzi G, Hernandez L, et al. EML4-ALK rearrangement in non-small cell lung cancer and non-tumor lung tissues. Am J Pathol 2009; 174:661.
- Boland JM, Erdogan S, Vasmatzis G, et al. Anaplastic lymphoma kinase immunoreactivity correlates with ALK gene rearrangement and transcriptional up-regulation in non-small cell lung carcinomas. Hum Pathol 2009; 40:1152.
- Shaw AT, Yeap BY, Mino-Kenudson M, et al. Clinical features and outcome of patients with non-small-cell lung cancer who harbor EML4-ALK. J Clin Oncol 2009; 27:4247.
- Perner S, Wagner PL, Demichelis F, et al. EML4-ALK fusion lung cancer: a rare acquired event. Neoplasia 2008; 10:298.
- Conklin CM, Craddock KJ, Have C, et al. Immunohistochemistry is a reliable screening tool for identification of ALK rearrangement in non-small-cell lung carcinoma and is antibody dependent. J Thorac Oncol 2013; 8:45.
- https://www.fda.gov/medicaldevices/productsandmedicalprocedures/deviceapprovalsandclearances/recently-approveddevices/ucm454476.htm (Accessed on June 19, 2017).
- Lindeman NI, Cagle PT, Beasley MB, et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. Arch Pathol Lab Med 2013; 137:828.
- Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature 2007; 448:561.
- Takeuchi K, Choi YL, Soda M, et al. Multiplex reverse transcription-PCR screening for EML4-ALK fusion transcripts. Clin Cancer Res 2008; 14:6618.
- Koivunen JP, Mermel C, Zejnullahu K, et al. EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res 2008; 14:4275.
- Wong DW, Leung EL, So KK, et al. The EML4-ALK fusion gene is involved in various histologic types of lung cancers from nonsmokers with wild-type EGFR and KRAS. Cancer 2009; 115:1723.
- Inamura K, Takeuchi K, Togashi Y, et al. EML4-ALK fusion is linked to histological characteristics in a subset of lung cancers. J Thorac Oncol 2008; 3:13.
- Solomon B, Varella-Garcia M, Camidge DR. ALK gene rearrangements: a new therapeutic target in a molecularly defined subset of non-small cell lung cancer. J Thorac Oncol 2009; 4:1450.
- Food and Drug Administration http://www.accessdata.fda.gov/drugsatfda_docs/label/2011/202570s000lbl.pdf
- http://seer.cancer.gov/statfacts/html/lungb.html (Accessed on September 03, 2014)
- Rodig SJ, Mino-Kenudson M, Dacic S, et al. Unique clinicopathologic features characterize ALK-rearranged lung adenocarcinoma in the western population. Clin Cancer Res 2009; 15:5216.
- Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014; 371:2167.
- Moran T, Sequist LV. Timing of epidermal growth factor receptor tyrosine kinase inhibitor therapy in patients with lung cancer with EGFR mutations. J Clin Oncol 2012; 30:3330.
- Hida T, Nokihara H, Kondo M, et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX): an open-label, randomised phase 3 trial. Lancet 2017; 390:29.
- Soria JC, Tan DS, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet 2017; 389:917.
- Shaw AT, Gandhi L, Gadgeel S, et al. Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol 2016; 17:234.
- Yang JC, Ou SI, De Petris L, et al. Pooled Systemic Efficacy and Safety Data from the Pivotal Phase II Studies (NP28673 and NP28761) of Alectinib in ALK-positive Non-Small Cell Lung Cancer. J Thorac Oncol 2017; 12:1552.
- Shaw AT, Kim TM, Crinò L, et al. Ceritinib versus chemotherapy in patients with ALK-rearranged non-small-cell lung cancer previously given chemotherapy and crizotinib (ASCEND-5): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2017; 18:874.
- Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med 2014; 370:1189.
- Crinò L, Ahn MJ, De Marinis F, et al. Multicenter Phase II Study of Whole-Body and Intracranial Activity With Ceritinib in Patients With ALK-Rearranged Non-Small-Cell Lung Cancer Previously Treated With Chemotherapy and Crizotinib: Results From ASCEND-2. J Clin Oncol 2016; 34:2866.
- Gainor JF, Dardaei L, Yoda S, et al. Molecular Mechanisms of Resistance to First- and Second-Generation ALK Inhibitors in ALK-Rearranged Lung Cancer. Cancer Discov 2016; 6:1118.
451320/ZYK/WEB/052024/1
