аГУС — редкое заболевание, сопровождающееся микроангиопатической гемолитической анемией, тромбоцитопенией и повреждением почек. Ниже вы сможете ознакомиться с современным представлением о данной нозологии: эпидемиологии, этиопатогенезе и роли системы комплемента в развитии и исходе заболевания — а также увидите актуальные данные по диагностике и ведению пациентов.
Пожалуйста, нажмите на интересующий вас раздел, чтобы его открыть.
аГУС: основная информация и эпидемиология
Гемолитико-уремический синдром (ГУС) — это клинический синдром, характеризующийся прогрессирующей почечной недостаточностью и включающий разные заболевания, такие как типичный ГУС, вызванный инфекцией STEC, и атипичный ГУС (аГУС). ГУС определяется по трем основным признакам: неиммунной микроангиопатической гемолитической анемии, тромбоцитопении и повреждению жизненно важных органов, в основном почек1–3.
аГУС — это редкая, жизнеугрожающая форма тромботической микроангиопатии. Его развитие связано с нарушением регуляции альтернативного пути активации комплемента из-за генетических аномалий и (или) приобретенных антител к регуляторным белкам комплемента. Гемолиз и тромботическая микроангиопатия являются универсальными признаками аГУС; у 20% пациентов отмечаются внепочечные проявления3–6.
аГУС — это ультраорфанное заболевание с приблизительной оценкой заболеваемости от 0,5 до 2 случаев на миллион в год. Доля пациентов с дефектом комплемента остается неопределенной7–9.
США: ~2 случая на миллион в год10, 11.
Европа: ~0,11—0,42 случая на миллион в год12–14.
Япония: ~100—200 случаев на миллион15.
Механизмы развития и роль системы комплемента в патогенезе аГУС
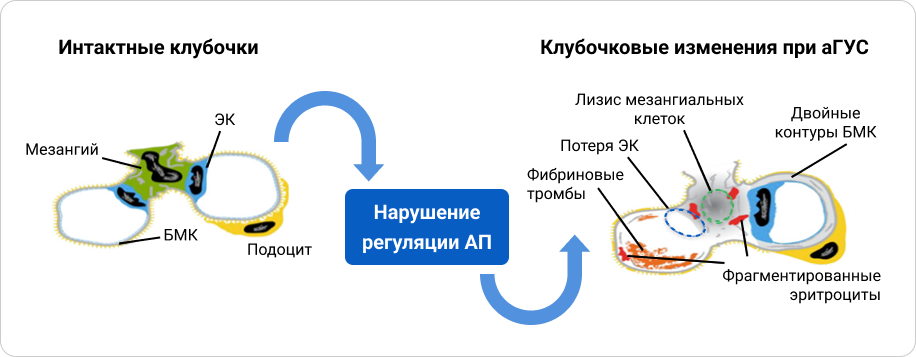
аГУС возникает после повреждения эндотелиальных клеток вследствие нарушения контроля активности комплемента на поверхности эндотелия. Этот процесс сопровождается образованием тромбов, гибелью и лизисом клеток мезангия. Хроническая фаза репарации приводит к образованию внеклеточного матрикса (ВКМ) новообразованными эндотелиальными клетками, что приводит к утолщению двойных контуров базальной мембраны клубочков (БМК)1, 16—18.
Роль системы комплемента в патогенезе аГУС18.
При неверно установленном диагнозе или некорректном лечении аГУС крайне высоки риски смертности19.
У 56% взрослых появляется почечная недостаточность в первый год после начала заболевания13.
У взрослых встречается чаще, чем у детей (46% по сравнению с 16%), аГУС прогрессирует до почечной недостаточности после первого эпизода13.
У детей частота смертности через 1 год выше, чем у взрослых (6,7% по сравнению с 0,8%)13.
Рецидив заболевания у ~50% пациентов возникает после трансплантации почки20.
Клинические проявления аГУС
Появление аГУС может быть идиопатическим или вызванным различными факторами. Инфекции дыхательных путей и диарея могут часто являться провоцирующими факторами13, 19.
В 20—30% случаев диарея у детей, не связанная с шига-токсином, может предшествовать развитию аГУС. Симптомы, как правило, крайне разнообразны: усталость, бледность, нарушения питания, рвота, одышка и отеки6, 19, 20.
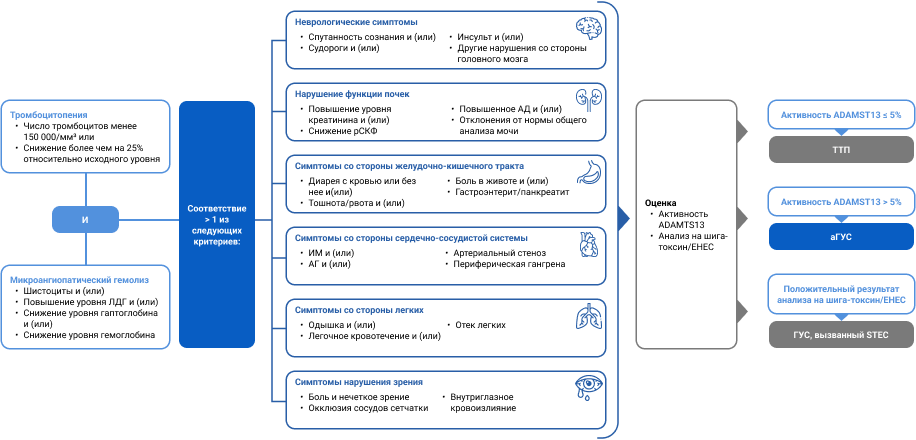
Клинические признаки аГУС13, 19, 21:
Почки: почечная недостаточность, олигурия.
Поражение нервной системы.
Легочное кровотечение или отек.
Дистальная гангрена.
Сердечно-сосудистая система: сердечная недостаточность, артериальная гипертензия, инфаркт миокарда.
Желудочно-кишечный тракт: боль в животе, тошнота/рвота и кишечное кровотечение, панкреатит.
аГУС — системная ТМА, затрагивающая не только почки, но и другие жизненно важные органы: головной мозг, сердце, легкие, пищеварительный тракт, орган зрения, кожу и др.29
- Экстраренальные проявления наблюдаются у 20—30% пациентов, причем две трети из них сталкиваются с поражением более чем одного органа, помимо почек29.
- Многие пациенты с аГУС испытывают значительные периферические и полостные отеки, вызванные воздействием анафилотоксинов С3а и С5а, образующихся при активации АПК и усиливающих сосудистую проницаемость через освобождение гистамина29.
- Большинство пациентов с аГУС характеризуются тромбоцитопенией (менее 150 000/мм3 или снижение числа тромбоцитов более чем на 25% от исходного), неиммунной МАГА (гемоглобин менее 100 г/л) и ОПП29.
- Артериальная гипертония вследствие перегрузки объемом в случае олиго/анурии и (или) гиперренинемии вследствие ишемии ткани почек, обусловленной ТМА29.
- Почти у половины пациентов с аГУС возникают проблемы с ЦНС, включая сонливость, раздражительность, судороги, нарушения зрения, гемипарез или гемиплегию, а также состояния от ступора до комы29.
- У 40% пациентов развивается ТМА миокарда, характеризующаяся дилатационной кардиомиопатией с симптомами острой сердечной недостаточности, острым инфарктом миокарда, тяжелыми нарушениями ритма и проводимости, что может привести к внезапной смерти29.
- Поражения ЖКТ выявляются примерно у 30% пациентов с аГУС. Они могут проявляться в виде диареи, тошноты, рвоты и возможного развития абдоминального болевого синдрома. Также возможно появление острого панкреатита с характерными признаками вплоть до панкреонекроза29.
- У взрослых пациентов в редких случаях проявляется поражение кожи в виде обширных очагов некроза или дигитальной ишемической гангрены, приводящей к ампутации пальцев рук и ног29.
- При акушерском аГУС примерно у 5% пациентов возможно развитие полиорганной недостаточности, вызванной генерализацией ТМА и вовлечением сосудов микроциркуляторного русла жизненно важных органов29.
Подтверждение диагноза аГУС
Выявление патогенных мутаций и аномалий в альтернативном пути активации комплемента подтверждает диагноз аГУС6, 19. Несмотря на то что генетическое тестирование не является обязательным для экстренной диагностики аГУС, оно может улучшить прогностическую ценность результатов и дополнить информацию о долгосрочном лечении23. Хотя биопсия почек может выявить ТМА, она необязательна для установления диагноза и часто недоступна на диагностическом этапе6, 17.
Краткий алгоритм диагностики аГУС: исключение других причин ТМА22:
Лечение аГУС: текущие подходы и возможные перспективы
- Лечение, направленное на систему комплемента, включая ингибиторы С5 (экулизумаб и равулизумаб), является стандартом для аГУС24. Однако такая терапия сопряжена с высоким риском инфекций, отсутствием консенсуса относительно оптимальной длительности и высокой частотой рецидивов после прекращения (до 30%)6. Ингибиторы С5 требуют внутривенного введения каждые две недели, что также создает финансовую и лечебную нагрузку на пациента25, 26.
- Применение плазмотерапии, представленной в виде плазмообмена, рекомендуется в качестве первичной терапии для всех пациентов с подозрением на аГУС или рецидивом заболевания в ожидании результатов обследования на STEC-ГУС и определения уровня ADAMTS13. Это направлено на уменьшение тяжести жизнеугрожающих проявлений болезни. При отсутствии доступа к плазмообмену или невозможности его проведения немедленно для пациентов с подозрением на аГУС рекомендуется применение плазмотерапии в форме трансфузии свежезамороженной плазмы29. Но у данного метода существуют свои недостатки: ограниченная эффективность, отсутствие лечения основного заболевания, риски, связанные с катетером, анафилактические реакции, гиперволемия и повышенное АД6, 24.
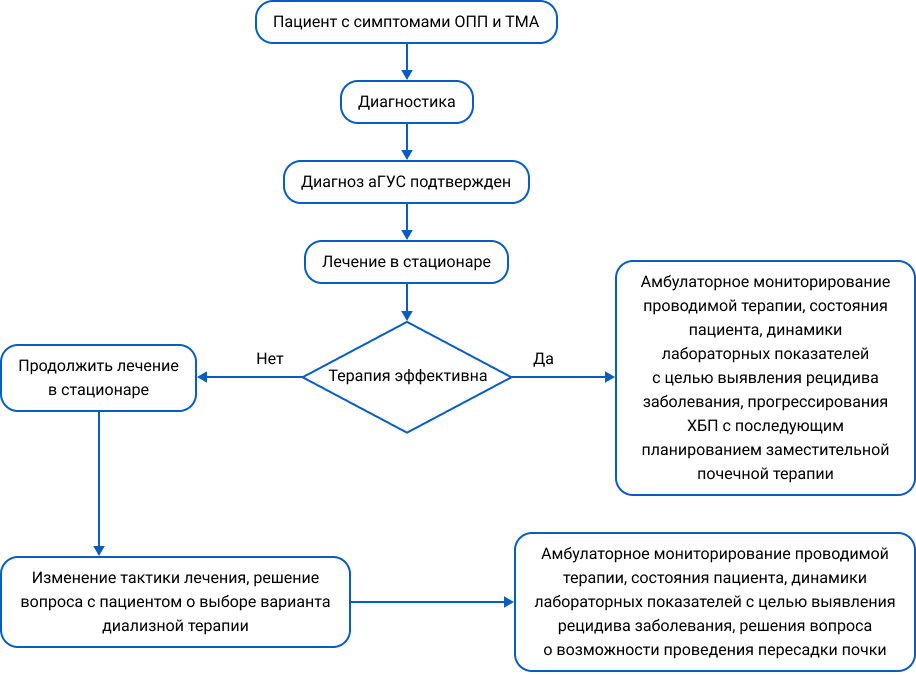
- Поддерживающая терапия аГУС может включать: иАПФ/БРА для контроля АГ, волемический контроль, переливание эритроцитов при анемии и лечение инфекций23, 24.
- При развитии аГУС может потребоваться диализ, а при почечной недостаточности — трансплантация почки.
Алгоритм ведения пациента с атипичным гемолитико-уремическим синдромом29:
Прогноз для пациента с подтвержденным диагнозом аГУС
Прогностические факторы риска ухудшения ХБП при аГУС через 1 год7, 13, 28:
Низкая функция почек (рСКФ < 60 мл/мин/1,73 м2).
Высокое артериальное давление.
Небольшое снижение тромбоцитов.
Генетические факторы риска, такие как мутации в генах CFH и MCP, влияют на прогнозирование выживаемости и исходы почечной функции. По данным исследования уровень мутаций в гене CFH, кодирующем фактор комплемента Н, выше как у детей (63%) так и у взрослых (68%), в то время как мутации MCP были менее распространены у детей (17%) по сравнению со взрослыми (63%). У пациентов с мутациями в CFH прогрессирование до почечной недостаточности происходило быстрее, чем у тех, у кого были мутации в MCP.
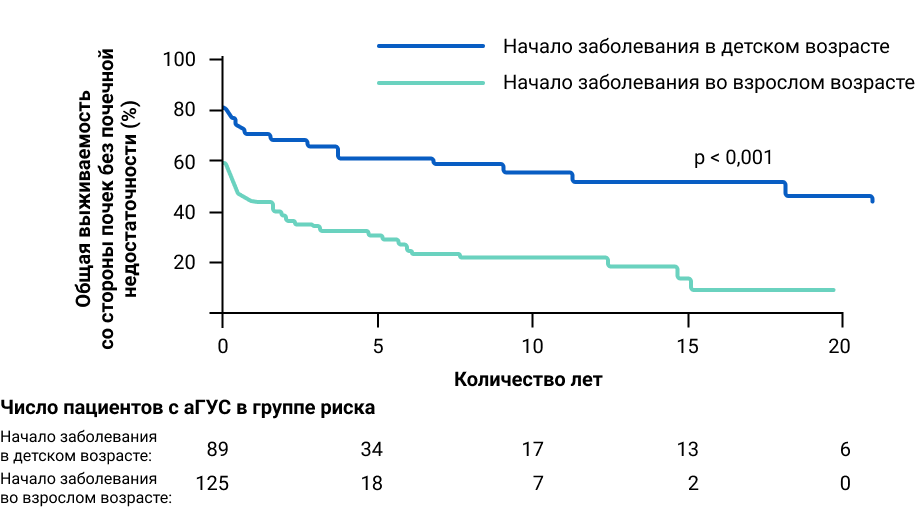
Совокупные оценки по методу Каплана — Мейера для доли пациентов без почечной недостаточности или смертельного исхода в зависимости от возраста начала заболевания13.
Выживаемость почек значительно лучше у пациентов с ранним началом заболевания, чем у больных с поздней манифестацией аГУС. Дебют аГУС во взрослом возрасте имеет, как правило, более плохой прогноз13.
Переход от инъекционной терапии аГУС к таблетированной — это важный шаг для пациентов, особенно для тех, кто испытывает трудности с регулярными госпитализациями. Люди, занятые работой или заботой о грудничках (акушерский аГУС), а также проживающие в отдаленных районах, сталкиваются с трудностями в доступе к медицинским услугам. Возможность перейти на таблетированное лечение была бы весьма ценной для данных категорий пациентов, однако на данный момент такая альтернатива, к сожалению, недоступна.
Список сокращений
- ГУС — гемолитико-уремический синдром;
- аГУС — атипичный гемолитико-уремический синдром;
- STEC — шига-токсин продуцирующая E.coli;
- ВКМ — внеклеточный матрикс;
- БМК — базальная мембрана клубочков;
- ЭК — эндотелиальная клетка;
- АПК — альтернативный путь комплемента;
- ТМА — тромботическая микроангиопатия;
- МАГА — микроангиопатическая гемолитическая анемия;
- ЦНС — центральная нервная система;
- ЛДГ — лактатдегидрогеназа;
- ADAMTS13 — металлопротеаза, расщепляющая сверхкрупные мультимеры фактора Виллебранда;
- ТТП — тромботическая тромбоцитопеническая пурпура;
- АД — артериальное давление;
- иАПФ — ингибитор ангиотензинпревращающего фермента;
- БРА — блокатор рецепторов ангиотензина;
- ХБП — хроническая болезнь почек;
- ОПП — острое повреждение почек;
- рСКФ — расчетная скорость клубочковой фильтрации.
Источники
- Fakhouri F et al, Lancet. 2017;390:681–96.
- Raina R et al, Ther Apher Dial. 2019; 23:4–21.
- Schaefer F et al, Kidney Int. 2018;94:408–18.
- Norris M, Remuzzi G, N Engl J Med. 2009;361:1676–87.
- Goodship THJ, et al, Kidney Int. 2017;91(3):539–551.
- Dixon BP, et al, Pediatr Clin N Am. 2018;65(3):509–525.
- Schaefer F, et al, Kidney Int. 2018;94(2):408–418.
- Loirat C, Frémeaux–Bacchi V, Orphanet J. Rare Dis. 2011;6:60.
- Kavanagh D, Semin Nephrol. 2013;33:508–30.
- Constantinescu AR, Am J Kidney Dis. 2004;43:976–82.
- Maga TK et al, Hum Mutat. 2010;31:E1445–460.
- Campistol JM et al, Nefrologia. 2013;33:27–45.
- Fremeaux–Bacchi V et al, Clin J Am Soc Nephrol. 2013;8:554–62.
- Sheerin NS et al, QJM: In J Med. 2016;109:27–33.
- Yoshida Y et al, Ren Replace Ther. 2017;3:5.
- Noris M, Remuzzi G, N Engl J Med. 2009;361:1676–87.
- Sethi S, et al, Semin Thromb Hemost. 2014;40:416–21.
- Zipfel PF, et al, J Am Soc Nephrol. 2020;31:241–56.
- Sridharan M et al. J Immunol Methods 2018;461:15–22.
- Noris M et al. Clin. J. Am. Soc. Nephrol 2010;5:1844-1859.
- Yeneral M Turk J Haematol 2014;31:216–25.
- Laurence J et al, Clin Adv Hematol Oncol. 2016;14.
- Azoulay E et al, Chest. 2017;152:424–434.
- Campistol J, et al, Nephrologia. 2015;35(5):421–447.
- Wijnsma KL, et al, Pediatr Nephrol. 2019;34(11):2261–2277.
- Raina R, et al, Int J Nephrol Renovasc Dis. 2019;12:183–204.
- KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases, 2021 Kidney Int. 2021;100(4S):S1-S276.
- Jamme M et al, PLOS ONE.2017; 12(5): e0177894.
- Козловская Н.Л., Добронравов В.А., Боброва Л.А. и соавт. Клинические рекомендации по ведению взрослых пациентов с атипичным гемолитико-уремическим синдромом. Нефрология и диализ. 2023. 25(4):465-492.
11376906/IPT/DIG/03.25/1