В ряде случаев при морфологическом анализе биоптатов почки невозможно выполнить все три вида микроскопии. Это может быть связано с техническим или материальным оснащением лаборатории, а также качеством доставленного материала. В таких случаях понимание диагностической ценности каждого из видов исследования становится наиболее актуальным. Ниже приведен анализ трех видов морфологического исследования, которым стандартно подвергается почечная ткань, на предмет значимости для постановки точного диагноза.
Пожалуйста, нажмите на интересующий вас раздел, чтобы его открыть.
Этап забора биоптата
Для выполнения исследовательской работы морфолог в первую очередь оценивает качество биоптата. Поэтому важно еще на этапе проведения биопсии производить забор адекватной по толщине иглой (18G, а лучше 16G). При этом перед тем как отправить материал на исследование, хирургу или нефрологу следует удостовериться в достаточности клубочков в отправляемых образцах с помощью лупы1, 2.
Необходимый минимум:
Нативная почка: 10 клубочков для собственных почек.
Почечный трансплантат: 7 клубочков + 1 артерия.
Репрезентативность биоптата, зависящая от диффузии процесса, имеет важное значение. Например, при фокальном сегментарном гломерулосклерозе наиболее репрезентативными являются юкстамедуллярные клубочки. Принято считать, что качество биоптата на 90% определяет корректность правильного результата при светооптическом исследовании3.
Не менее важным является этап фиксации, то есть помещение материала в среду, которая бы позволила обеспечить сохранность клеток и полимерных молекул.
Обычно берется три «столбика» ткани, которые помещаются в три различных раствора в зависимости от последующего метода исследования:
Cветовая микроскопия — 10% нейтральный забуференный формалин;
Иммунофлюоресцентная микроскопия — физиологический раствор либо раствор Мишель;
Электронная микроскопия — раствор глютаральдегида4.
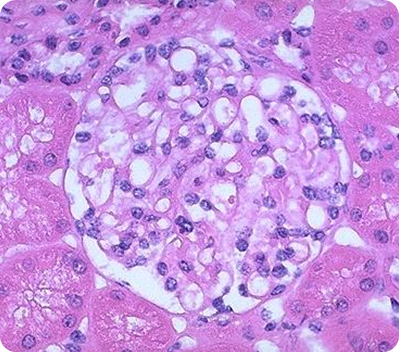
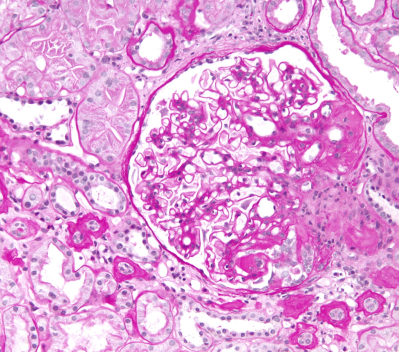
Световая микроскопия в нефрологии
Попытки визуализации почечной ткани начались с проведения световой микроскопии5. Еще в 1666 году анатом Марчелло Мальпиги исследовал ткань почки с использованием светового микроскопа с увеличением в 25—30 раз и впервые описал клубочек как «железу, в которой моча отделяется от крови»6. Этот вклад игнорировался до 1842 года, когда сэр Уильям Боумен описал структуру нефрона с помощью более мощного светового микроскопа. Боумен обнаружил перигломерулярную капсулу (позже названную капсулой Боумена), анатомически связанную с проксимальной частью канальца7.
Благодаря внедрению световой микроскопии стала возможной гистологическая классификация заболеваний почек5. Морфологическая диагностика позволила понять, что патологические изменения на микроскопическом уровне значительно различаются у пациентов со сходным клиническим течением заболевания. Внедрение в 1951 году прижизненной биопсии почек сделало возможными своевременную диагностику патологии почек и корректировку лечения в зависимости от заключения.
Световая микроскопия на современном этапе предполагает исследование почечной ткани после окрашивания различными методиками:
- окраска гематоксилином-эозином (для общего анализа структур);
- окраска по Массону (визуализация соединительной ткани);
- трихромальная окраска (для выявления фуксинофильных отложений);
- РАS-ШИК (для анализа мембран и дистрофии эпителиальных клеток);
- серебрение по Джонсу (исследование мембран);
- окраска по Вейгерту (исследование состояния сосудов);
- окраска конго-рот (идентификация амилоидных масс).
Отсутствие тех или иных методик окрашивания при выполнении световой микроскопии затрудняет постановку точного морфологического диагноза. Например, без выполнения серебрения по Джонсу нельзя сделать вывод о состоянии базальных мембран, что является важным компонентом верификации диагноза8.
Состояния, которые можно определить при помощи световой микроскопии:
- норма;
- сегментарный склероз/некроз;
- утолщение/нарушение структуры ГБМ;
- расширение мезангия/мезангиальная пролиферация;
- эндокапиллярная пролиферация;
- экстракапиллярная пролиферация.
Обзорное исследование биоптата включает оценку распространения и тяжести повреждений. Повреждение считается сегментарным для одного клубочка, если оно занимает менее 50% площади сосудистого клубочка, и глобальным, если занимает от 50 до 100% площади клубочка.
Тяжесть повреждения оценивается полуколичественно по балльной системе. Оценка варьируется от 0 до 3 или от 0 до 4 баллов, где 0 баллов означает отсутствие изменений, а 3 или 4 балла — выраженные изменения.
Основные гломерулярные повреждения, выявляемые при помощи световой микроскопии, включают увеличение или уменьшение размеров клубочка, изменения в количестве клеток клубочка, лобулярность (дольчатость), наличие некрозов, склероз, изменения клеток и базальной мембраны, изменение состояния просветов капилляров и Боуменовой капсулы, канальцев и интерстиция, а также сосудов.
Критерии постановки диагноза морфологической формы нефрита включают наличие или отсутствие гиперклеточности и мембранозной трансформации, а также локализацию иммунных комплексов. При необходимости дополнительной оценки базальной мембраны и локализации иммунных комплексов используется электронная микроскопия8.
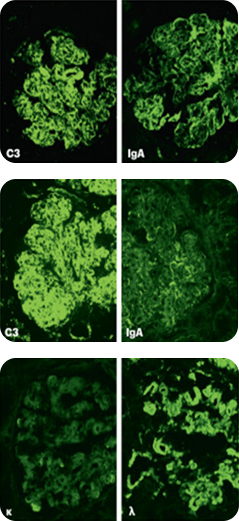
Иммунофлюоресцентный анализ в нефроморфологии
Развитие иммуногистохимических методов диагностики ткани почки было связано с возможностью максимального сохранения репрезентативного фрагмента живой ткани почки. В 1950 году Альберт Кунс разработал метод идентификации антител изоцианатом флуоресцеина, то есть иммунофлюоресценцию, с сохранением способности специфически реагировать с их тканевыми антигенами. С тех пор иммунофлюоресценция была включена в диагностическую процедуру оценки замороженных образцов биопсии почки. Этот метод впервые позволил выявить иммуноглобулины и отложения комплемента в почечной ткани у больных гломерулонефритом, способствуя дифференциации различных патофизиологических механизмов, лежащих в основе некоторых неспецифических поражений тканей, например, при гломерулонефрите с полулуниями9.
В настоящее время иммунофлюоресценция является неотъемлемой частью морфологического анализа прижизненного анализа почечной ткани. Такие заболевания, как IgA-нефропатия, C1q- и C3-гломерулопатии, не могут быть диагностированы без использования данного метода. Важным аспектом является локализация, а также выраженность свечения иммунных депозитов. Прямая иммунофлюоресценция на свежезамороженных тканях является наиболее широко используемым методом, позволяющим произвести качественную оценку депозитов и менее точный количественный анализ. Метод иммунофлюоресценции на парафиновых блоках, по данным литературы, может быть более информативным за счет точной количественной оценки иммунных включений. Однако данный метод ограничен в использовании в связи с техническими ограничениями морфологических центров10. Широкий спектр различных моноклональных антител к маркерам (IgG, IgM, IgA, C3c, С4d, C1q; легким цепям лямбда и каппа, и другие) позволяет в результате комплементарного связывания определить доминирующий вид депозитов и их локализацию.
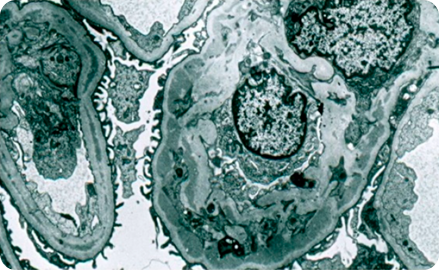
Электронная микроскопия в нефрологии
Первая попытка преодолеть предел разрешения световых и флюоресцентных микроскопов была предпринята в 1931 году, когда Эрнст Руска и Макс Кнолль изобрели электронный микроскоп, в котором в качестве источника возбуждения используется пучок ускоренных электронов вместо луча света.
Благодаря возросшей разрешающей способности вскоре стало очевидно, что клубочек представляет собой не просто механический фильтр, а чрезвычайно сложный орган, состоящий из трех слоев: эндотелиальных клеток, базальной мембраны клубочка и подоцитов11.
Примерно 25% биопсий требуют применения электронной микроскопии:
- электронно-плотные отложения в мезангии вдоль ГБМ12;
- необходима электронная микроскопия для однозначного определения БПД и C3ГН13;
- синдром Альпорта14, 15;
- болезнь тонких базальных мембран14, 15;
- фибриллярный гломерулонефрит14, 15;
- иммунотактоидный гломерулонефрит14, 15;
- коллагеновая гломерулопатия III типа14, 15.
Электронная микроскопия позволяет тонко исследовать состояние базальной мембраны и компонентов клубочков, предоставляя ценные для диагностики данные о патологических изменениях. Безусловно, электронная микроскопия имеет свои ограничения. Так, информативность метода определяется объемом исследования, включающим максимум до 4 клубочков. При диффузных процессах, затрагивающих каждый клубочек, метод обладает высокой информативностью, но при очаговых процессах вероятность получения информативного участка становится ниже. Из-за ограниченности объема исследования при проведении электронной микроскопии не анализируется состояние интерстиция и лимфатических сосудов, а количественные исследования проводятся лишь в специальных случаях, таких как оценка толщины базальной мембраны и степени стирания ножек подоцитов. Электронная микроскопия является дополнительным методом исследования почечного биоптата, решение о проведении которого принимает патоморфолог, основываясь на информации, полученной при помощи световой и иммунофлюоресцентной микроскопии. Иногда патоморфолог данное решение принимает совместно с клиницистом3.
О чем важно помнить клиницисту?
Постановка точного морфологического диагноза требует:
Проведения световой и иммунофлюоресцентной микроскопии, а в ряде случаев — электронно-микроскопического исследования;
Достаточного количества почечной ткани: необходимо собрать три «столбика», содержащих элементы коркового и мозгового вещества почки с 10 клубочками;
Правильной фиксации и обработки полученного материала после его забора;
Полного сопроводительного анамнеза;
Эффективного взаимодействия между клиницистом и морфологом.
Сегодня морфологические методы диагностики играют ключевую роль в постановке нефрологического диагноза. Понимание особенностей поражения элементов нефрона при различных заболеваниях почек позволяет подобрать правильную терапию, избежать развития нежелательных явлений и сохранить функцию почек4.
Список сокращений
- PAS-ШИК (Periodic acid–Schiff) — реакция Шифф-йодная кислота;
- ГБМ — гломерулярная базальная мембрана;
- БПД — болезнь плотных депозитов;
- C3ГН — С3-гломерулонефрит;
- IgA — иммуноглобулин А;
- IgG — иммуноглобулин G;
- IgM — иммуноглобулин M.
Источники
- Nicholson M.L. A prospective randomized trial of three different sizes of cure-cutting needle for renal biopsy. Kidney int. 2000; 58 (1): 390-5.
- MacGinley R., Champion De Crespigny P.J., Gutman T. et al. KHA-CARI Guideline recommendations for renal biopsy. Nephrology. 2019; 24: 1205–1213.
- Титова В.А., Клемина И.К. Возможности световой и электронной микроскопии в диагностике гломерулонефрита. Нефрология. 2002; 6(4): 84-91.
- Пилотович В.С., Сукало А.В., Кравцова Г.И. Пункционная нефробиопсия и ее роль в клинической нефрологии. Белорусская медицинская академия последипломного образования, Белорусский государственный медицинский университет, 2004: 33.
- Weening JJ, Jennette JC. Historical milestones in renal pathology. Virchows Arch 2012; 461: 3–11.
- Malpighi M. De Viscerum Structura Exercitation anatomica. Bologna. 1666.
- Bowman W. On the structure and use of the Malpighian bodies of the kidney, with observations on the circulation through that gland. Philos Trans R Soc A. 1842; 132: 57–80.
- Титова В.А., Клемина И.К. Возможности световой и электронной микроскопии в диагностике гломерулонефрита. Нефрология. 2002; 6(4): 84-91.
- D’Agati VD, Mengel M. The rise of renal pathology in nephrology: structure illuminates function. Am J Kidney Dis. 2013; 61: 1016–1025.
- Singh G, Singh L, Ghosh R, Nath D, Dinda AK. Immunofluorescence on paraffin embedded renal biopsies: Experience of a tertiary care center with review of literature. World J Nephrol. 2016 Sep 6;5(5):461-70.
- Tisher CC. Functional anatomy of the kidney. Hosp Pract 1978.
- Sethi S. et al. Kidney Int. 2009; 75: 952-960.
- Smith RJH. et al. Nat Rev Nephrol. 2019; 15: 129-143.
- Haas M. J Am Soc Nephrol. 1997; 8: 70.
- Rivera A. Meleg-Smith S. Ultrastruct Pathol. 2001; 25: 313.
11376906/IPT/DIG/03.25/1