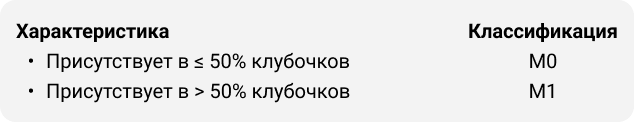IgA-нефропатия представляет собой гетерогенное иммуновоспалительное заболевание почек, приводящее к развитию необратимых изменений их структуры. Ниже вы сможете ознакомиться с основными клинико-морфологическими характеристиками IgA-нефропатии и факторами неблагоприятного прогноза. Затронуты вопросы значимости диагностики и морфологической классификации MEST-C и приведен детальный алгоритм ведения пациентов с данным заболеванием.
Пожалуйста, нажмите на интересующий вас раздел, чтобы его открыть.
IgA-нефропатия: основные характеристики и особенности, распространенность
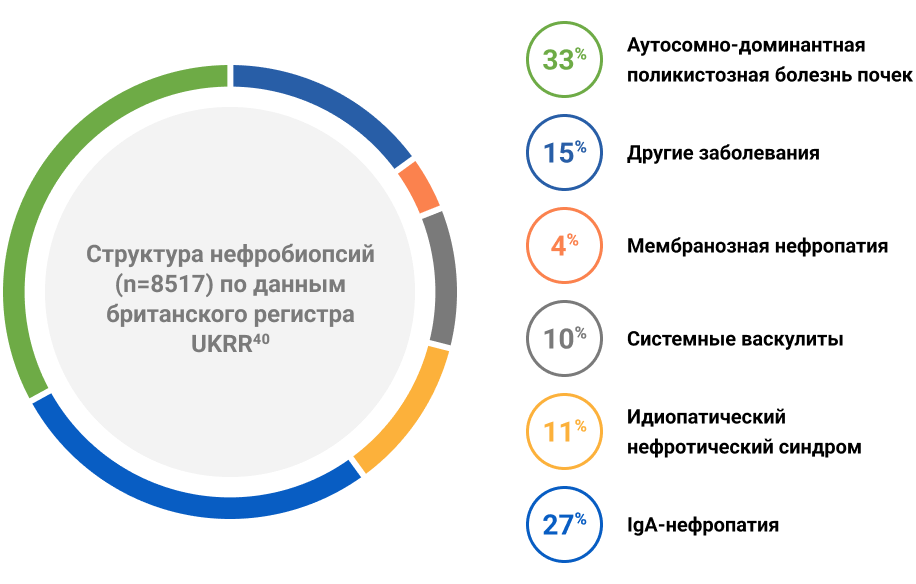
IgA-нефропатия — гетерогенное аутоиммунное заболевание1, 2, описанное Жаном Бергером в 1968 году3. Это самая распространенная форма первичного гломерулонефрита в мире, каждая третья нефробиопсия (27%) имеет данное заключение40. Процентное соотношение всех случаев IgA-нефропатии к общему числу индикационных биопсий и морфологически подтвержденных первичных иммунных гломерулопатий составляет 20,5% и 31,7% соответственно6. Более того, данная патология является и самой частой причиной развития терминальной почечной недостаточности3, 4.
Структура нефробиопсий (n=8517) по данным британского регистра UKRR40.
Заболеваемость среди взрослого населения составляет примерно 25 случаев на миллион человек в год5.
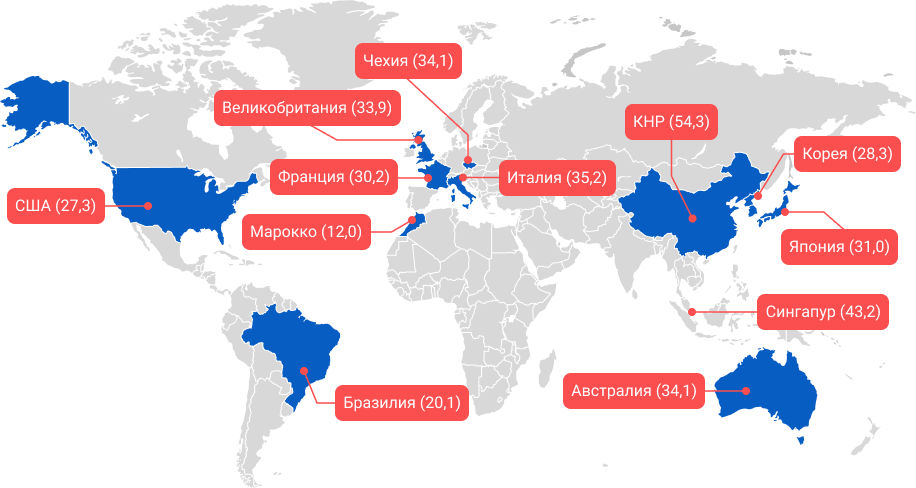
Глобальные данные по распространенности IgA-нефропатии в некоторых регионах мира4.
В российской популяции IgA-нефропатия не только является наиболее распространенной гломерулопатией, но также представляет собой один из наиболее частых клинических и морфологических диагнозов в практике нефрологов. В НИИ нефрологии ежегодно регистрируется около 45 случаев IgA-нефропатии среди резидентов Санкт-Петербурга. Это свидетельствует о заболеваемости, достигающей уровня от 8 до 10 случаев на миллион населения, что сопоставимо с европейской статистикой. Распространенность, клинические характеристики и прогноз IgA-нефропатии различаются в зависимости от географического и этнического контекста в России6.
Одной из характерных особенностей IgA-нефропатии является отложение IgA в мезангии клубочков, что приводит к пролиферации мезангиальных клеток7, 8. Риск прогрессирования IgA-нефропатии до конечной стадии почечной недостаточности через 10 лет значительно варьируется (от < 10% до 60%)1. На ранних этапах этот тип нефропатии может быть спонтанно обратимым, что подчеркивает важность ранней диагностики и проведения адекватной терапии для предотвращения дальнейшего прогрессирования болезни. Пациенты, страдающие IgA-нефропатией, требуют длительного наблюдения (не менее 10 лет), поскольку заболевание имеет склонность к прогрессированию9. Важно отметить, что согласно данным регистров нефробиопсии, IgA-нефропатия в 50% (13—60%) случаев может рецидивировать в трансплантированной почке10.
Роль иммунной системы в развитии IgA-нефропатии и роль активации пути комплемента
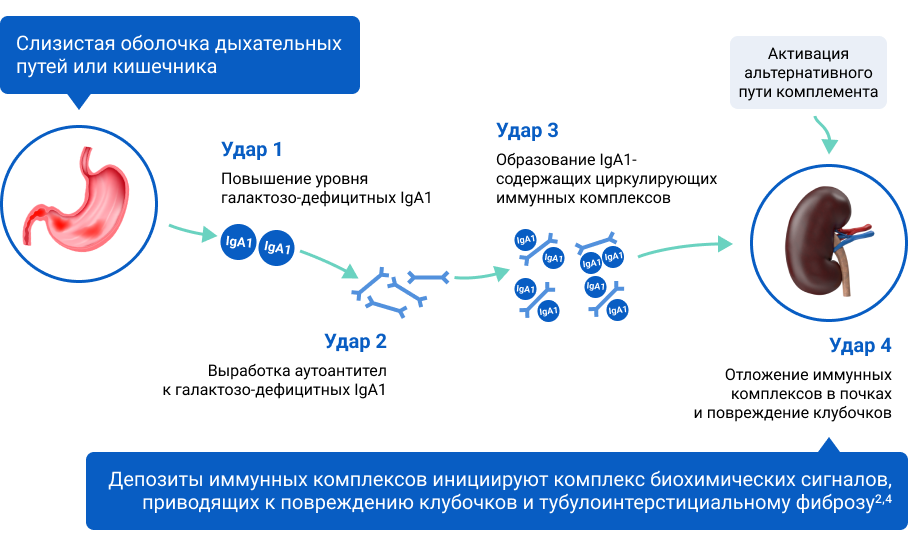
Воспалительная реакция слизистых оболочек запускает синтез IgA, однако на фоне точечных мутаций генов образуется дефектный белок с измененной структурой — галактозодефицитный IgA141. Развитие патологического процесса сопровождается образованием аутоантител, направленных против галактозодефицитного IgA1, а также образованием патогенных иммунных комплексов, содержащих IgA1, что приводит к активации комплемента через альтернативный путь. Циркулирующие иммунные комплексы попадают в мезангий и вызывают клеточную пролиферацию мезангиальных клеток и чрезмерное образование внеклеточного матрикса, цитокинов и хемокинов, повреждая при этом почки2, 11, 12.
У 90% пациентов существуют гистологические доказательства вовлечения альтернативного пути комплемента.
Совместное отложение компонентов альтернативного пути (таких как C3, пропердин и фактор H) с иммунными комплексами в мезангии поддерживает активность альтернативного пути активации комплемента.
Существует гипотеза о четырехэтапном развитии IgA-нефропатии, в рамках которой предполагается активация пути комплемента2, 11, 12.
IgA-нефропатия: клиническая картина, диагностика и прогноз для пациента
IgA-нефропатия характеризуется широким спектром клинических характеристик7, 9, 15—19, 36:
- Гематурия: микро- и макрогематурия отмечается у 40—50% пациентов. При фазово-контрастной микроскопии осадка мочи выявляются дисморфные эритроциты.
- Протеинурия: обычно < 1 г/сут, редко изолированная. Нефротический синдром возникает у 5% пациентов, чаще у детей и подростков.
- Артериальная гипертензия: чаще в сочетании с высокоактивным гломерулонефритом, протеинурией и острой почечной недостаточностью.
- Острая почечная недостаточность: может возникнуть на любой стадии из-за тяжелого повреждения клубочков или окклюзии канальцев эритроцитами.
- Хроническая почечная недостаточность: чаще развивается у пациентов с высоким риском прогрессирования.
- Повышение уровня IgA (в основном полимерных форм) в сыворотке крови: отмечается у 35—60% пациентов и обычно не связано с тяжестью заболевания.
Качественная диагностика играет важную роль в определении необходимости проведения биопсии. Это включает в себя общий анализ мочи для оценки протеинурии и гематурии, а также измерение скорости клубочковой фильтрации.
Основные показания к выполнению биопсии почки37:
Стойкая протеинурия и (или) гематурия после исключения других причин.
Нефротический синдром.
Нефритический синдром (острый, быстропрогрессирующий, хронический).
Снижение СКФ, необъяснимое при клиническом исследовании (острое или хроническое).
Уточнение характера поражения почек при системных заболеваниях (множественная миелома, AL-амилоидоз, АА-амилоидоз, системная красная волчанка, антифосфолипидный синдром, системный васкулит и др.).
По результатам биопсии почек могут быть проведены световая микроскопия, иммунофлюоресцентная микроскопия (ИФА) и электронная микроскопия. Наиболее показательной с точки зрения подтверждения диагноза может служить биопсия с ИФА38.
Проводятся анализы крови, такие как измерение уровня креатинина. При оценке биоптата почки учитываются гистологические параметры, такие как мезангиальная пролиферация (M), эндокапиллярная пролиферация (E), сегментарный гломерулосклероз (S), атрофия канальцев и интерстициальный фиброз (T), а также наличие клеточных или фиброзно-клеточных полулуний (C). Оценка каждого параметра биоптата помогает прогнозировать скорость снижения функции
почек9, 20.
Связь гистологических характеристик по шкале MEST с клиническими аспектами IgA-нефропатии20:
Мезангиальная пролиферация
Течение заболевания у пациентов с мезангиальной пролиферацией (М1) и даже низкой протеинурией ≤ 1 г/день характеризуется схожим прогнозом, как у пациентов со стойкой протеинурией от 1 до 2 грамм в день. Таким образом, несмотря на более низкую экскрецию белка, в первом случае можно говорить о более высоком риске, а также о возможной пользе более ранней иммуносупрессии, потенциально улучшающей сохранение массы нефронов42.
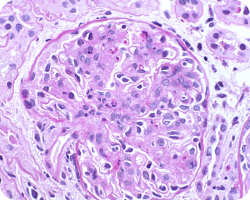
Эндокапиллярная пролиферация
Связана с более быстрой потерей функции почек и худшей почечной выживаемостью. При этом использование иммуносупрессии может маскировать прогностическую ценность Е в отношении почечных исходов. Данный признак указывает на необходимость исследования применения иммуносупрессивной терапии22.
Сегментарный гломерулосклероз (более четырех мезангиальных клеток):
Признаки гипертрофии подоцитов или склероз с локализацией на канальцевом полюсе, являющиеся одной из причин сегментарного гломерулосклероза, связаны с более выраженной протеинурией и более быстрым снижением функции почек. Вместе с тем у пациентов, имеющих описанные признаки, иммуносупрессивная терапия связана с лучшей почечной выживаемостью22.
Атрофия канальцев/интерстициальный фиброз
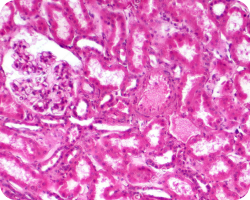
Критерий интерстициального фиброза (CI) оценивает уровень фиброза в кортикальной зоне почки. Оценка этого критерия основана на определении процента площади интерстициального фиброза в корковом веществе. В норме доля фиброзной ткани в корковом веществе составляет до 5%.
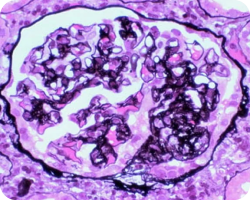
Клеточные или фиброзно-клеточные полулуния
Наличие клеточных или фиброзно-клеточных полулуний (С1) характеризует значимо более высокий риск неблагоприятного почечного исхода при отсутствии иммуносупрессивной терапии, однако исчезающий при ее проведении. Обнаружение же С2-признаков говорит о неблагоприятном почечном исходе вне зависимости от иммуносупрессии22.
IgA-нефропатия: прогноз для пациента
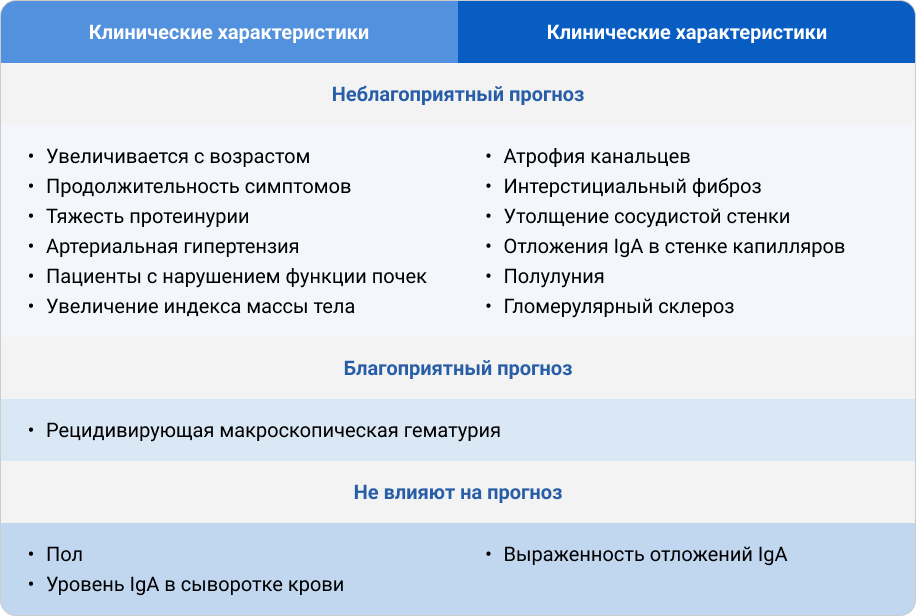
Определение прогноза течения IgA-нефропатии в зависимости от клинической картины20–23:
Прогноз заболевания у пациентов с IgA-нефропатией обусловлен широким спектром факторов и зависит не только от морфологических особенностей заболевания, но и от клинических и лабораторных показателей на момент его начала (например, уровня мочевины, протромбина, α2-глобулина в крови и протеинурии)31. Неблагоприятным признаком является манифестация в возрасте 35—40 лет, частые и выраженные эпизоды макрогематурии, а также эпизоды обострения32, 33. У детей, особенно с ранним началом, прогноз обычно более благоприятный, чем у взрослых35.
Критерии неблагоприятного прогноза согласно клиническим рекомендациям по диагностике и лечению IgA-нефропатии34:
Лечение IgA-нефропатии: существующие подходы
Основные критерии эффективности терапии IgA-нефропатии39:
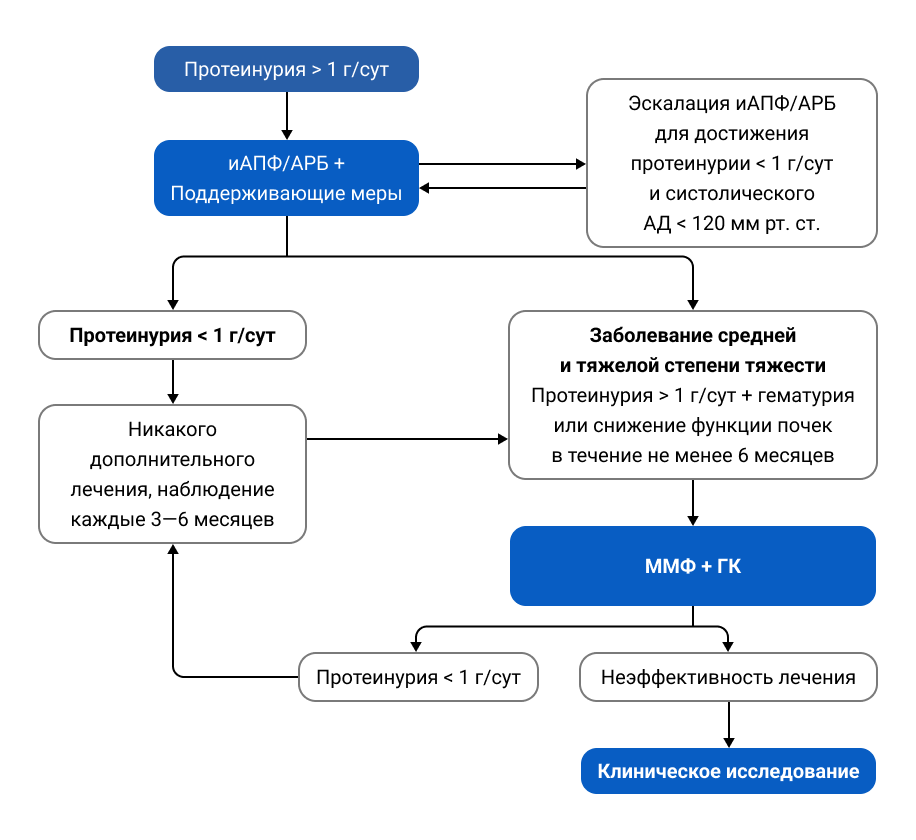
Для лечения IgA-нефропатии ключевым методом остается симптоматическая терапия вне зависимости от уровня протеинурии, стадии хронической почечной недостаточности или гистопатологических изменений. Основные меры включают применение ингибиторов АПФ/БРА для контроля артериальной гипертензии и протеинурии, а также диету с ограничением натрия. Пациентам рекомендуется аэробная физическая активность, коррекция массы тела и прекращение курения. Для пациентов с высоким риском, у которых протеинурия стабильно высокая (> 1 г/сут), рекомендуется применение иммуносупрессивной терапии в сочетании с симптоматическим лечением в течение 3—6 месяцев24—26.
Лечение IgA-нефропатии: возможные перспективы
Краткий алгоритм лечения IgAN (рекомендации KDIGO)13.
ГК проявляют важные противовоспалительные и иммуносупрессивные свойства. Однако широкая вариабельность реакции на них у разных пациентов представляет существенную проблему. Экспрессия различных изоформ рецепторов глюкокортикоидов влияет на чувствительность и специфичность ГК, которые могут изменяться в результате воспалительных и патологических процессов27, 28.
Перспективным направлением лечения является применение комплемент-блокирующей терапии. Ингибирование проксимальной части альтернативного пути активации комплемента предотвращает амплификацию конвертазы C3 и C5, сохраняя активность лектинового и классического путей. При этом происходит угнетение образования провоспалительных факторов: опсонинов, анафилотоксинов и мембраноатакующего комплекса через выключение альтернативного пути комплемента14, 30.
Список сокращений
- IgA — иммуноглобулин A;
- C3 — компонент комплемента 3;
- C5 — компонент комплемента 5;
- МАК — мембраноатакующий комплекс;
- П — пропердин;
- АП — альтернативный путь комплимента;
- ЛП — лектиновый путь комплимента;
- ТП — терминальный путь;
- МСЛ — манноза-связывающий лектин;
- FHR1,5 — белок 1,5, связанный с фактором комплемента Н;
- АГ — артериальная гипертензия;
- СКФ — скорость клубочковой фильтрации;
- АПФ — ангиотензинпревращающий фермент;
- БРА — блокатор рецепторов ангиотензина;
- ГК — глюкокортикостероиды;
- ММФ — микофенолата мофетил.
Источники
- Barbour S, Reich H. Curr Opin Nephrol Hypertens 2018;214–20.
- Rizk DV et al. Front. Immunol 2019;10;5042.
- Berger J, Hinglais N. J Urol Nephrol (Paris).1968;74:694–95; 3.
- Lai KN, et al. Nat Rev Dis Primers 2016;2:doi: 10.1038/nrdp.2016.1.
- McGrogan A et al. Nephrol Dial Transplant 2011;26: 414–430.
- Добронравов В.А. и соавт. Нефрология 2019;23(6):45–60. doi: 10.36485/1561–6274–2019–23–6-45–60.
- Feehally J, Floege J. In Comprehensive Clinical Nephrology 2007;253–264. Eds. Johnson, Feehally, Floege.
- Feehally J. Semin Nephrol. 2017 Sep;37(5):464–477.
- Floege J, Eitner J Am Soc Nephrol 2011;22:1785–794.
- Evangelista-Carrillo L. A., Monteón-Ramos F. Recurrencia de enfermedades glomerulares en trasplante renal. Revista Mexicana de Trasplantes. 2020; 9: S1: 86–90. https://dx.doi.org/10.35366/93492.
- Maillard N, et al. J Am Soc Nephrol. 2015;26(7):1503–1512.
- Suzuki H, et al. J Am Soc Nephrol. 2011;22(10):1795–1803.
- KDIGO Glomerular Diseases Work Group. Kidney Int. 2021;100(4S):S1–S276.
- Merle et al. Front Immunol 2015;6:262.
- Szeto C.C., Lai F.M., To K.F. et al. The natural history of immunoglobulin a nephropathy among patients with hematuria and minimal proteinuria. Am J Med 2001; 110: 434–437.
- Donadio J.V., Grande J.P. IgA nephropathy. N Engl J Med 2002; 347: 738–748.
- Selvaskandan H et al. Clin Exp Nephrol 2019 https://doi.org/10.1007/s10157–019–01700–1.
- Zhang C et al. Transl Res 2015;166:134–44.
- https://rarediseases.org/rare-diseases/iga-nephropathy/ Дата обращения: 15 декабря 2023 г.
- Markowitz G Nat Rev Nephrol 2017;13:385–386; таблица адаптирована из Markowitz 2017.
- Barratt J, Feehally J. Am Soc Nephrol. 2005;16:2088–97.
- Trimarchi H et al. on behalf of Working Group of the International IgA Nephropathy Network and the Renal Pathology Society et al. Kidney International 2017;91:1014–1021.
- Haas M, et al. J Am Soc Nephrol. 2017:2;691–701; таблица адаптирована и обновлена из Barratt, Feehally.
- Lafayette RA, Kelepouris E Am J Nephrol 2018;47(suppl 1):43–52 adapted from KDIGO Clinical Practice Guideline for Glomerulonephritis Kidney Int Supp 2012;2:209–17.
- Trimarchi H et al. Meeting report; The 15th International Symposium on IgAN. Kidney International 2019;95:750–56.
- KDIGO Clinical Practice Guideline for Glomerulonephritis Kidney Int Supp 2012;2; таблица из KDIGO 2012.
- Buttgereit F, et al. Lancet. 2005;365(9461):801–3.
- Ramamoorthy, Cidlowski. Rheum Dis Clin North Am. 2016; 42:15–31.
- Schubart A, et al. Proc Natl Acad Sci USA 2019;116:7926–31.
- Макарова Ю.А., Шишкин А.Н., Эрман М.В., Козлов В.В. Ретроспективная оценка течения хронического гломерулонефрита, дебютировавшего в детском возрасте. Нефрология. 2006; 10 (3): 38–42.
- Думан В.Л., Шилов Е.М., Батанина Н.Ю., Крохина Н.Б. Факторы прогрессирования хронического гломерулонефрита с изолированным мочевым синдромом. Нефрология. 2008; 12 (1): 29–35.
- Шилов Е.М., Тареева И.Е., Иванов А.А. Течение и прогноз мезангиопролиферативного гломерулонефрита. Терапевтический архив. 2002; 6: 11–18.
- Шилов Е.М., Бобкова И.Н., Колина И.Б., Камышова Е.С. Клинические рекомендации по диагностике и лечению IgA-нефропатии. Нефрология. 2015. № 6.
- Haas M., Rahman M.H., Cohn R.A. IgA nephropaty in children and adults: comparison of histologic.
- features and clinical outcomes. Nephrol. Dial. Transplant. 2008; 23 (8): 2537–2545.
- Wyatt R.J., Julian B.A. IgA nephropathy. N Engl J Med 2013; 368: 2402–2414.
- Клинические рекомендации «Хроническая болезнь почек (ХБП)». Рубрикатор клинических рекомендаций. [Электронный ресурс]. URL: https://cr.minzdrav.gov.ru/recomend/469_2 Last accessed January 2024.
- Schena FP, et al. Int J Mol Sci. 2020;21(2):525.
- Карунная А.В., Добронравов В.А. Ремиссии и прогрессирование С3-гломерулопатии. Терапевтический архив.2022;94(6):718–724.
- Wong K., Pitcher D., Braddon F. et al. The National Registry of Rare Kidney Diseases (RaDaR): Description, recruitment, and cross-sectional analyses of 25,880 adults and children with rare kidney diseases in the UK. Preprint. https://doi.org/10.1101/2023.09.24.23296009.
- Knoppova B., Reily C., King R.G. et al. Pathogenesis of IgA Nephropathy: Current Understanding and Implications for Development of Disease-Specific Treatment. J. Clin. Med. 2021, 10(19), 4501; https://doi.org/10.3390/jcm10194501.
- Barbour, S. J. et al. Kidney Int. 2016, 167–175.
11376906/IPT/DIG/03.25/1