Мидостаурин — первый зарегистрированный препарат группы ингибиторов протеинкиназ для лечения продвинутых форм мастоцитоза. Мидостаурин рекомендован в качестве монотерапии для лечения агрессивного СМ, СМ, ассоциированного с гематологическим неопластическим заболеванием, или тучноклеточного лейкоза у взрослых пациентов.
Терапия мидостаурином позволяет достичь выраженного клинического ответа: уменьшения числа тучных клеток в КМ, снижения уровней триптазы в сыворотке, уменьшения симптоматики СМ, опосредованной медиаторами. Мидостаурин блокирует передачу сигнала, опосредованную мутантным (D816V) KIT, таким образом ингибируя пролиферацию и рост ТК. Также мидостаурин подавляет IgE-опосредованную секрецию гистамина ТК и базофилами, уменьшая выраженность симптоматики и повреждение внутренних органов1–3.
Эффективность и безопасность мидостаурина продемонстрированы в ходе клинических исследований II фазы D2201 и A22134 (табл. 1)3–5.
Таблица 1 — Клинические исследования мидостаурина при рСМ
| Исследования | D2201 | A2213 | D2201 + A2213 |
| Пациенты |
Взрослые с АСМ, СМ-АГН или ТКЛ
|
Взрослые с АСМ, СМ-АГН или ТКЛ
|
Взрослые с АСМ, СМ-АГН или ТКЛ
|
| Дизайн исследования | II фазы, открытое, в единственной группе | II фазы, открытое, в единственной группе | Анализ единого пула данных исследований D2201 + A2213 |
| Первичные конечные точки | Наилучшие общие ответы, ЧОО (большие + частичные ответы) в первые 6 циклов | ЧОО (БО + ЧО) в первые 12 циклов | ОВ, по сравнению с историческими контрольными данными |
| Обзор результатов |
|
|
|
Исследование D22016
Исследование проводилось с участием 116 пациентов в возрасте от 18 лет с АСМ, СМ-АГН или ТКЛ. Пациенты получали мидостаурин по 100 мг 2 раза в сутки 28-дневными непрерывными циклами до прогрессирования заболевания или неприемлемой токсичности. В качестве первичных конечных точек были выбраны наилучшие общие ответы, ЧОО (большие + частичные ответы) в первые 6 циклов; вторичными конечными точками были безопасность, длительность ответа, выживаемость без прогрессирования (ВБП), общая выживаемость (ОВ); поисковыми конечными точками были симптоматика заболевания и качество жизни участников исследования.
60% пациентов достигли ответа на терапию мидостаурином, при этом ответы наблюдались во всех подгруппах вне зависимости от подтипа рСМ, мутационного статуса KIT D816V или ранее проводимой терапии. Медиана длительности ответа достигла 24,1 месяца (95% ДИ 10,8–Н/О), а медиана ОВ — 28,7 месяца (95% ДИ 18,1–Н/О). Следует отметить, что медиана длительности ответа не была достигнута у пациентов с АСМ или ТКЛ, а у пациентов с СМ-АГН составила 12,7 месяца (рис. 1).
Кроме того, у 57% пациентов было зарегистрировано снижение числа ТК в КМ ≥ 50%, а среднее наилучшее процентное изменение уровня триптазы было равно -58%. У 77% пациентов с исходной спленомегалией было показано уменьшение объема селезенки. Кроме того, на фоне терапии мидостаурином было показано значимое улучшение со стороны 30 из 32 оцениваемых симптомов.
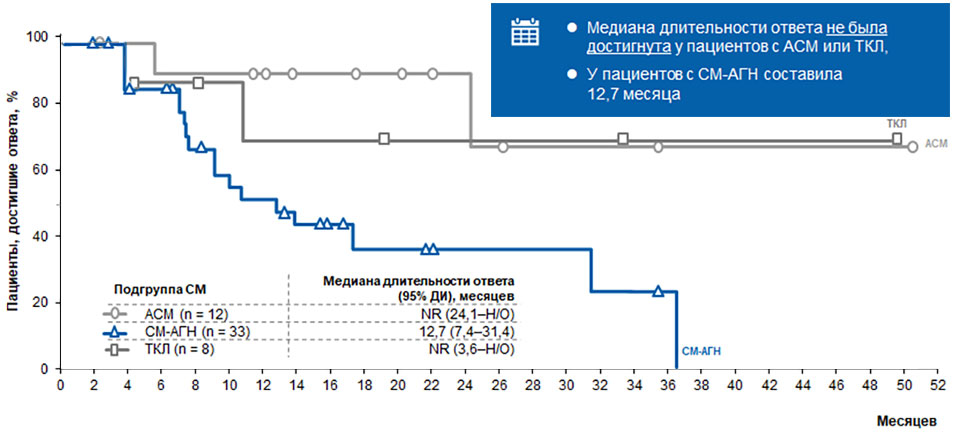
Рисунок 1. Длительность ответа в зависимости от подгрупп в исследовании D22016
Исследование А22137
В исследовании участвовали пациенты старше 18 лет с АСМ, СМ-АГН или ТКЛ (в популяции согласно назначенному лечению (ITT), n = 26), которые получали мидостаурин по 100 мг 2 раза в сутки 28-дневными циклами, ≤ 12 циклов. При сохранении ответа на терапию и приемлемой токсичности допускалось продление лечения более чем на 12 месяцев. Первичной конечной точкой была ЧОО (большие + частичные ответы) в первые 12 циклов.
69% пациентов достигли ответа на терапию, при этом улучшение симптоматики отмечали во всех подгруппах вне зависимости от подтипа рСМ, ранее проводившейся терапии или мутационного статуса по KIT D816V. Медиана времени до первоначального ответа составила 25,5 дня (95% ДИ 4–56), а медиана времени до наилучшего ответа — 56 дней (95% ДИ 25–229). Медиана длительности ответа не была достигнута полностью к 37,8 месяца, а медиана ОВ для общей когорты пациентов составила 40 месяцев (рис. 2).
У 68% пациентов наблюдалось снижение числа ТК в КМ на ≥ 50%, а у 46% пациентов мидостаурин приводил к снижению уровня триптазы. Также следует отметить, что неожиданных нежелательных явлений в ходе исследования не наблюдалось. Таким образом, долгосрочное наблюдение показало устойчивую активность препарата и его переносимость в популяции пациентов с рСМ.
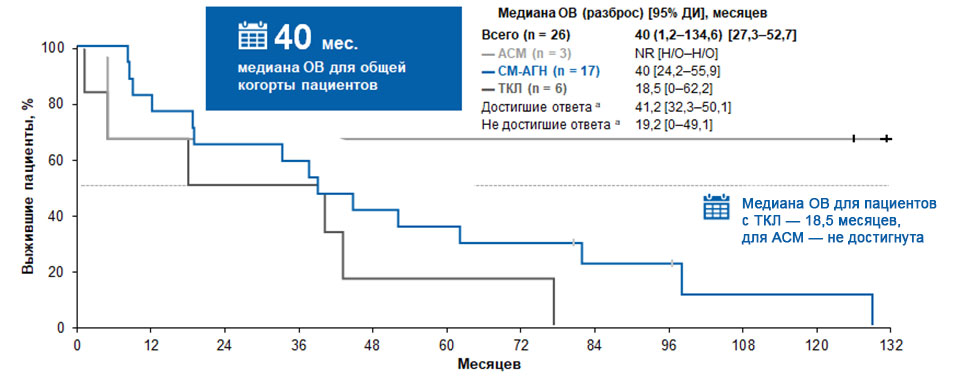
Рисунок 2. Общая выживаемость в исследовании А22137
Объединенный анализ исследований D2201 и А22138
В рамках объединенного анализа было показано, что мидостаурин снижал риск смерти на 50% по сравнению с историческими контрольными данными (относительный риск (ОР) 0,50, 95% ДИ 0,33–0,76). Польза препарата была сравнима во всех ключевых подгруппах.
Список литературы:
- Peter B. et al. Target interaction profiling of midostaurin and its metabolites in neoplastic mast cells predicts distinct effects on activation and growth. Leukemia 30, (2016).
- DeAngelo D.J. et al. Efficacy and safety of midostaurin in patients with advanced systemic mastocytosis: 10-year median follow-up of a phase II trial. Leukemia 32, (2018).
- Gotlib J. et al. Efficacy and Safety of Midostaurin in Advanced Systemic Mastocytosis. New England Journal of Medicine 374, (2016).
- Hartmann K. et al. Midostaurin improves quality of life and mediator-related symptoms in advanced systemic mastocytosis. Journal of Allergy and Clinical Immunology 146, (2020).
- Reiter A. Haematologica [abstract S788]. 102(s2), (2017).
- Gotlib J. et al. Efficacy and Safety of Midostaurin in Advanced Systemic Mastocytosis. New England Journal of Medicine 374, 2530–2541 (2016).
- DeAngelo D.J. et al. Efficacy and safety of midostaurin in patients with advanced systemic mastocytosis: 10-year median follow-up of a phase II trial. Leukemia 32, 470–478 (2018).
- Reiter A. Pooled survival analysis of midostaurin clinical data (D2201 + A2213) in patients with advanced systemic mastocytosis (ADVSM) compared with historical controls. https://library.ehaweb.org/eha/2017/22nd/182075/andreas.reiter.pooled.survival.analysis.of.midostaurin.clinical.study.data.html (2017).
11213600/RYD/WEB/07.24/0
