Истинная полицитемия (ИП) - клональное миелопролиферативное новообразование, которое характеризуется пролиферацией эритроидного, гранулоцитарного, мегакариоцитарного ростков миелопоэза, с преимущественной пролиферацией эритроидного ростка (панмиелоз), увеличением количества эритроцитов и повышением концентрации гемоглобина, тромбоцитозом, лейкоцитозом в крови (панцитоз), независимостью эритропоэза от нормальных механизмов регуляции. 1,2 Развитие ИП обусловлено мутациями JAK2, обычно JAK2V617F, или другой функционально сходной мутацией. 3
Тромботические осложнения служат наиболее частой причиной смерти и инвалидизации больных ИП. 4,5 Пациентам высокого риска, для нормализации гематологических показателей и снижения числа сосудистых событий, необходима терапия аспирином и циторедуктивными препаратами. 6,7 Гидроксикарбамид (ГК) является стандартным лечением первой линии, но у части больных отмечается непереносимость или резистентность к данному препарату, что отрицательно влияет на дальнейший прогноз в этой популяции пациентов. Так, резистентность к ГК и непереносимость ГК связаны с более чем пятикратным повышением риска смертельного исхода. 1,6,7,8,9 Перспективы успешного лечения ИП в настоящее время связаны с таргетной терапией. Руксолитиниб является ингибитором Янус-киназ (JAK), и первым зарегистрированным таргетным препаратом для лечения пациентов с ИП при непереносимости гидроксикарбамида или резистентности к нему. В рандомизированных контролируемых исследованиях было доказано, что руксолитиниб обладает большей эффективностью, чем наилучшая доступная терапия (НДТ), в достижении контроля гематокрита без кровопусканий и уменьшении выраженности симптомов, связанных с заболеванием. 10-12 В указанных исследованиях, однако, был разрешен переход пациентов с НДТ на терапию руксолитинибом, что затрудняет долгосрочную оценку сосудистых событий, прогрессирования заболевания и общей выживаемости (ОВ).
MAJIC-PV - это рандомизированное открытое сравнительное многоцентровое клиническое исследование II фазы, оценивающее долгосрочную безопасность и эффективность руксолитиниба в сравнении с НДТ в популяции пациентов с непереносимостью ГК или резистентностью к нему (Рис.1 ). 13 В исследовании MAJIC-PV не было запланированного перехода с НДТ на руксолитиниб, а пациенты наблюдались в течение 60 месяцев, что позволило получить новые клинические и биологические данные для анализа. Основная цель исследования- частота достижения полного ответа (ПО) по критериям Европейской организации по лечению лейкозов (ELN) (лейкоциты ≤ 10, гематокрит ≤ 0,45, тромбоциты ≤ 400) в течение 1 года. 14 Вторичные цели включали длительность ПО, частоту развития геморрагических и тромбоэмболических осложнений, бессобытийную выживаемость (БСВ),выживаемость без прогрессирования (ВБП),ОВ, оценку молекулярного ответа (в соответствии с критериями ELN), оценку тяжести симптомов, безопасность и токсичность.
Рисунок 1. Дизайн исследования.
Результаты.
В исследование включено 190 пациентов с ИП, которые были рандомизированы в соотношении 1:1 в группы руксолитиниба и НДТ ( из 180 пациентов с доступными для анализа данными, 93 пациента получали руксолитиниб и 87 пациентов получали НДТ). Средний период наблюдения на момент анализа данных составлял 4,8 года. Среди включеных в исследование пациентов, 58% (n= 105) составляли мужчины и 42% (n=75) женщины, средний возраст- 66 лет. Резистентность к ГК отмечалась у 54 (30%) пациентов, непереносимость ГК- у 80 (44%) пациентов, у 46 (26%) пациентов зафиксировано и то и другое. Исходные характеристики, как правило, были сбалансированы. Средняя продолжительность лечения составила 1568 дней для руксолитиниба, и 1220 дней для НДТ. Средняя доза руксолитиниба- 10 мг 2 раза в сутки с увеличением дозы в течение наблюдения. Наиболее часто применяемыми схемами НДТ были: ГК (32%), интерферон (15%) и комбинация ГК и интерферона (12%).
Эффективность.
Первичной конечной точки (ПО) достигли 40 (43%) пациентов, получавших руксолитиниб, в сравнении с 23 (26%) пациентами, получавшими НДТ (отношение шансов [ОШ] 2,12; 90% ДИ, 1,25-3,60; Р=0,02). Продолжительность ПО также была выше в группе руксолитиниба (отношение рисков [ОР], 0,38; 95% ДИ, 0,24-0,61; Р < 0,001) (Рис.2).
Рисунок 2. Терапия руксолитинибом, в сравнении с НДТ, обеспечивает лучшую эффективность как в достижении полного ответа (А), так и в его устойчивости (В). НДТ- наилучшая доступная терапия
Относительно компонентов гематологического ответа, на терапии руксолитинибом пациентам требовалось меньше венесекций, несмотря на более длительное лечение и медиану наблюдения: всего 83 vs 307 венесекции в группе НДТ. В целом, у 52% пациентов, получавших НДТ (45/87пациентов) была проведена хотя бы одна венесекция по сравнению с 29% (27/93пациентов) в группе руксолитиниба. Время до первого тромботического осложнения коррелировало со средним количеством процедур венесекции в год (p < 0,001). В группе руксолитиниба отмечался более низкий уровень гемоглобина и гематокрита, в то время как уровень лейкоцитов и тромбоцитов существенно не отличался между группами.
БСВ (обширное кровотечение, тромбоз, трансформация или смертельный исход) была выше на фоне терапии руксолитинибом (ОР 0,58; 95% ДИ 0,35-0,94; Р=0,03) (Рис.3).
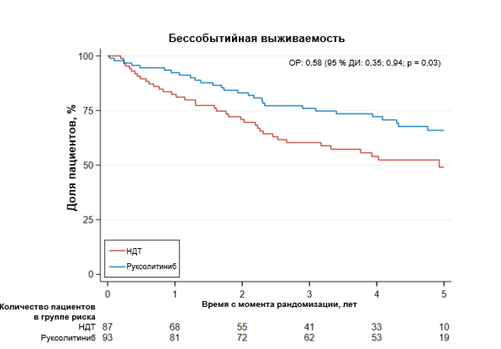
Рисунок 3. Динамика показателя БСВ на фоне терапии в исследуемых группах. БСВ-бессобытийная выживаемость, НДТ-наилучшая доступная терапия.
Кроме того, более высокий уровень БСВ отмечался у всех пациентов, достигших ПО в течение 12 месяцев (ОР 0,41; 95% ДИ 0,21-0,78; Р=0,01) (Рис.4).
Рисунок 4. Лучшая динамика бессобытийной выживаемости при достижении полного ответа в течение 12 месяцев.
Терапия руксолитинибом была ассоциирована с более частым достижением молекулярного ответа, определяемым как снижение на 50% доли вариантных аллелей JAK2V617F (P <0,001). При этом ранний JAK2V617F молекулярный ответ через 12 месяцев коррелировал с более высоким показателем БСВ (Р=0,005) (Рис.5). Важно отметить, что независимо от группы лечения, у пациентов с устойчивым молекулярным ответом в последней временной точке наблюдалось статистически значимое улучшение показателей БСВ (P=0,001 для всей когорты и P=0,006 для руксолитиниба), ВБП (P=0,001 для всей когорты и P=0,001 для руксолитиниба) и ОВ (P=0,01 для всей когорты и P=0,04 для руксолитиниба).
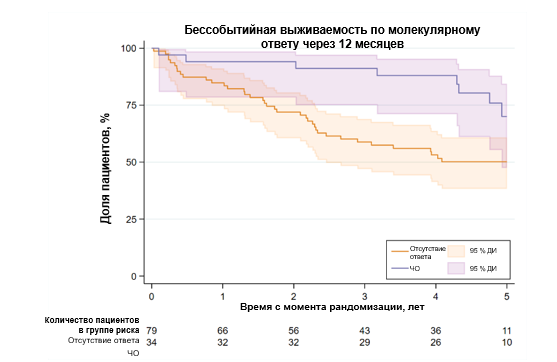
Рисунок 5. Корреляция раннего молекулярного ответа с более высоким показателем бессобытийной выживаемости. ЧО-частичный ответ.
Самыми частыми дополнительными мутациями были TET2 и ASXL1. Наличие мутации ASXL1 являлось предиктором неблагоприятного исхода БСВ (ОР, 3,02; 95% ДИ, 1,47-6,17; P =0,003).
Согласно оценке влияния терапии на бремя симптомов заболевания (использовался опросник MPN-SAF TSS), из 115 пациентов, прошедших опрос при включении в исследование и по крайней мере еще один дополнительный опрос на протяжении исследования, у 17/56 (30%) в группе НДТ и 36/59 (61%) в группе руксолитиниба наблюдалось снижение балов по шкале TSS на 50% и более процентов (P=0,001). Устойчивые улучшения в общей оценке симптоматики для группы руксолитиниба, наблюдались в среднем на протяжении 52 месяцев. В группе НДТ у пациентов отмечалось ухудшение симптоматики, с постепенным достижением исходного уровня в течение 56 месяцев (Рис.6)
Рисунок 6. Оценка симптомов на фоне терапии руксолитинибом в сравнении с наилучшей доступной терапией. Затененные области указывают 95% ДИ
Безопасность.
Профиль безопасности руксолитиниба соответствовал полученным ранее данным, новых нежелательных явлений (НЯ), связанных с долгосрочным применением препарата, зафиксировано не было. Из НЯ наиболее часто отмечались инфекции, желудочно-кишечные расстройства и сосудистые нарушения. Летальных исходов, связанных с инфекцией, или атипичных инфекции не зарегистрировано. Что касается злокачественных новообразований, у получавших руксолитиниб пациентов чаще регистрировался плоскоклеточной рак кожи (11 vs 0 при приеме руксолитиниба и НДТ, соответственно).
Заключение.
Исследование MAJIC-PV продемонстрировало значимые преимущества терапии руксолитинибом vs НДТ в группе высокого риска пациентов с ИП и непереносимостью или резистентностью к ГК при оценке ПО, БСВ и молекулярного ответа. Кроме того, впервые было продемонстрировано, что снижение частоты вариантных аллелей JAK2 V617F на 50 % ассоциировано с важными клиническими исходами (улучшение ВБП, БСВ и ОВ), что предполагает модификацию заболевания.
Ссылки
- Tefferi A., Vannucchi A.M., Barbui T.: Polycythemia vera: Historical oversights, diagnostic details, and therapeutic views. Leukemia 35:3339-3351, 2021.
- Меликян А.Л., Суборцева И.Н. Актуальные вопросы таргетной терапии истинной полицитемии. Клиническая онкогематология. 2021;14(3):355–60.
- Mead A.J., Mullally A.: Myeloproliferative neoplasm stem cells. Blood 129:1607-1616, 2017.
- Танашян М.М., Кузнецова П.И., Суборцева И.Н. и др. Хроническая и острая цереброваскулярная патология при Ph-негативных миелопролиферативных заболеваниях. Гематология и трансфузиология. 2016;61(3):146–50. doi: 10.18821/0234-5730-2016-61-3-146-150.
- Меликян А.Л., Суборцева И.Н., Суханова Г.А. Тромбогеморрагические осложнения у больных Ph-негативными миелопролиферативными заболеваниями. Кровь. 2014;2(18):21–5.
- McMullin MF, Harrison CN, Ali S, et al: A guideline for the diagnosis and management of polycythaemia vera. A British Society for Haematology Guideline. Br J Haematol 184:176-191, 2019.
- Mesa RA, Jamieson C, Bhatia R, et al: NCCN guidelines insights: Myeloproliferative neoplasms, version 2.2018. J Natl Compr Canc Netw 15:1193-1207, 2017.
- Barosi G, Birgegard G, Finazzi G, et al: A unified definition of clinical resistance and intolerance to hydroxycarbamide in polycythaemia vera and primary myelofibrosis: Results of a European LeukemiaNet (ELN) consensus process. Br J Haematol 148:961-963, 2010.
- Alvarez-Larran A, Pereira A, Cervantes F, et al: Assessment and prognostic value of the European LeukemiaNet criteria for clinicohematologic response, resistance, and intolerance to hydroxyurea in polycythemia vera. Blood 119:1363-1369, 2012.
- Vannucchi AM, Kiladjian JJ, Griesshammer M, et al: Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Engl J Med 372:426-435, 2015.
- Passamonti F, Griesshammer M, Palandri F, et al: Ruxolitinib for the treatment of inadequately controlled polycythaemia vera without splenomegaly (RESPONSE-2): A randomised, open-label,phase 3b study. Lancet Oncol 18:88-99, 2017 .
- Mesa R, Vannucchi AM, Yacoub A, et al: The efficacy and safety of continued hydroxycarbamide therapy versus switching to ruxolitinib in patients with polycythaemia vera: A randomized, doubleblind, double-dummy, symptom study (RELIEF). Br J Haematol 176:76-85, 2017.
- Harrison, Claire N et al. Ruxolitinib Versus Best Available Therapy for Polycythemia Vera Intolerant or Resistant to Hydroxycarbamide in a Randomized Trial. Journal of Clinical Oncology 2023 41:19, 3534-3544, 2023.
- Barosi G, Mesa R, Finazzi G, et al: Revised response criteria for polycythemia vera and essential thrombocythemia: An ELN and IWG-MRT consensus project. Blood 121:4778-4781, 2013.
711078/JAK/webpage/9.23/0

