Элтромбопаг является агонистом рецептора тромбопоэтина (ТПО), аналогично эндогенному ТПО он взаимодействует с рецепторами ТПО (рТПО) мегакариоцитов, клеток-предшественниц и стимулирует их пролиферацию и дифференцировку, что приводит к повышению продукции тромбоцитов.
При АА механизм действия элтромбопага иной и не связан с активацией мегакариоцитарного ростка, однако связан с активацией рТПО. Известно, что ТПО является главным регулятором самовоспроизведения и выживания гемопоэтической стволовой клетки. При АА основным повреждающим агентом аутоиммунной агрессии является интерферон гамма (ИНФγ). Предполагается, что он связывается с ТПО и, образуя с ним комплекс, препятствует активации рТПО, что препятствует активации сигнальных путей и уменьшает вероятность выживания стволовой клетки.
Механизм взаимодействия элтромбопага с рТПО отличается от такового для ТПО — элтромбопаг активирует рТПО через взаимодействие с трансмембранным доменом рецептора (ТПО взаимодействует с внеклеточным доменом рецептора), также важно, что элтромбопаг является небелковой молекулой. По этим двум причинам ИНФγ не может связаться с элтромбопагом и не препятствует его взаимодействию с рТПО, в результате чего запускается каскад реакций, которые способствуют выживанию стволовой клетки1,2.
Таким образом, элтромбопаг компенсирует иммуноопосредованный дефицит ТПО даже в присутствии ИНФγ1,2.
Исследования влияния элтромбопага на течение АА позволили расширить возможности терапии — теперь, помимо подавления иммунной агрессии на гемопоэтические стволовые клетки, пациенты могут получать терапию, направленную на их сохранение и воспроизведение, сочетающуюся с подавлением активации цитотоксических клеток через взаимодействие с Т-регуляторными клетками3.
Элтромбопаг также обладает хелаторной активностью и способствует выведению избыточного железа из клеток печени, сердца и других внутренних органов при перегрузке железом у пациентов с АА на гемотрансфузии3.
Классический протокол лечения АА в первой линии подразумевает проведение комбинированной ИСТ (рис. 1). Через 3–6 месяцев от начала ИСТ при отсутствии положительной динамики (рефрактерное течение) проводят второй курс терапии АТГ. Терапия циклоспорином должна быть продолжена. Альтернативный вариант терапии рефрактерной АА допускает через 3–6 месяцев после начала терапии добавление ко второму курсу АТГ элтромбопага (рис. 2). Назначение элтромбопага может сопровождаться моно-, би-, трилинейным гематологическим ответом у пациентов с рефрактерной АА3.
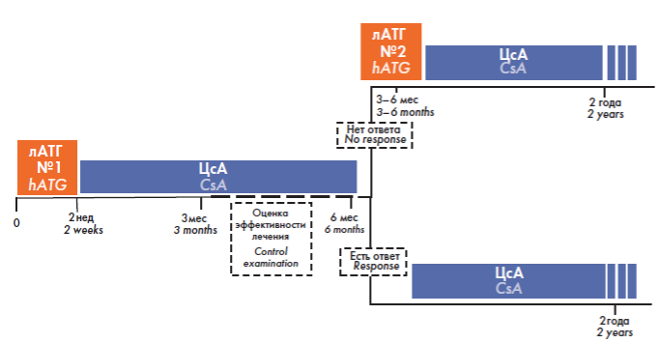
Рисунок 1. Классический протокол лечения АА комбинированной ИСТ
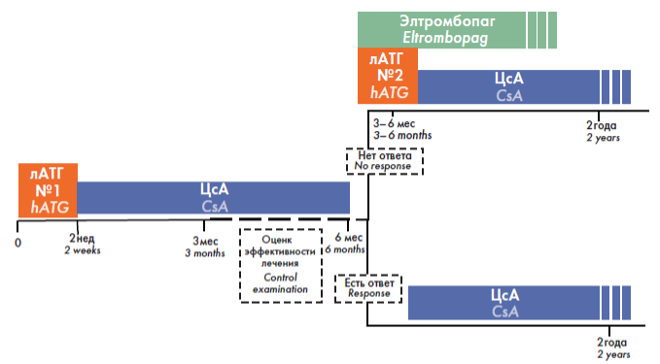
Рисунок 2. Протокол лечения АА, включающий элтромбопаг у пациентов, рефрактерных к первому курсу ИСТ
У пациентов с тяжелой АА в первой линии терапии вместе с ИСТ может быть назначен элтромбопаг (рис. 3)3. Клинические испытания показали, что у таких пациентов комбинированная ИСТ с добавлением элтромбопага позволяла заметно чаще добиваться выраженного повышения уровня клеток всех трех ростков кроветворения (нейтрофилы, эритроциты, тромбоциты) по сравнению с ИСТ.
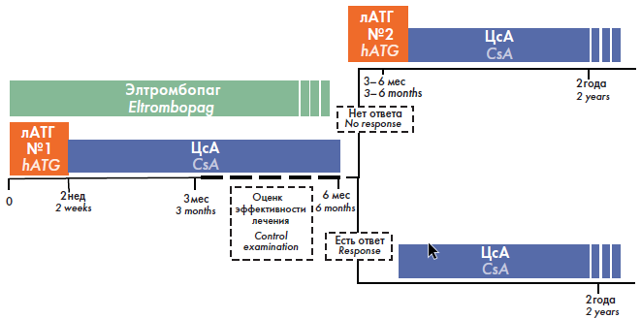
Рисунок 3. Протокол программы комбинированной ИСТ, включающий элтромбопаг в период индукции ремиссии АА
Элтромбопаг в первой линии терапии АА также может назначаться при наличии у пациента противопоказаний к назначению АТГ (рис. 4)3.
Эффективность и безопасность элтромбопага были изучены в ряде клинических испытаний.
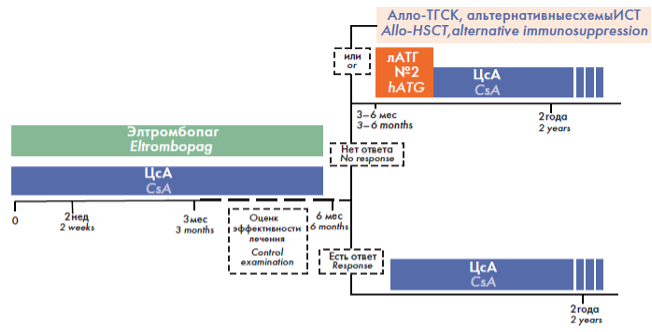
Рисунок 4. Протокол комбинированной терапии с включением элтромбопага при наличии противопоказаний к терапии АТГ на первом этапе лечения
Исследование Townsley D.M. et al., 20174
Исследование Townsley D.M. et al., 2017, — проспективное когортное исследование с историческим контролем. В него вошли пациенты в возрасте от 2 лет и старше с впервые выявленной ТАА (первая линия терапии). В исследовании изучалась эффективность трех режимов приема элтромбопага в комбинации со стандартной ИСТ. В первой когорте пациенты получали элтромбопаг с 14 дня до 6 месяца; во второй когорте с 14 дня до 3 месяца; в третьей когорте — с 1 дня до 6 месяца. Историческая когорта включала пациентов, получавших терапию ИСТ в рамках двух клинических испытаний, проводившихся в том же медицинском центре в период с 2003 по 2010 год. Состав, режим дозирования и схема применения ИСТ исторической когорты и настоящего исследования не различались4.
Критериями оценки эффективности терапии являлись: частота полного ответа (доля пациентов с показателями: гемоглобин > 10,0 г/л, гранулоциты > 1,0 × 109/л, тромбоциты > 100,0 × 109/л), частота неполного ответа (доля пациентов, у которых показатели гемограммы превышают уровень, соответствующий тяжелой АА, но не соответствуют условиям полного ответа), частота достижения общего ответа (доля пациентов, достигших полного и неполного ответа), выживаемость, клональная эволюция, развитие мутаций ГСК.
Добавление к ИСТ элтромбопага заметно повысило частоту гематологического ответа по сравнению с историческим контролем — полный ответ через 6 месяцев наблюдался у 33% пациентов когорты 1, 26% — когорты 2 и 58% — когорты 3 по сравнению с 17% в исторической когорте (рис. 5). Частота общего ответа в 1, 2, 3 когортах составила 80%, 87% и 94% соответственно, в исторической когорте частота общего ответа составила 66%. Наиболее выраженный гематологический ответ наблюдался в когорте 3, в которой элтромбопаг назначался с первого дня терапии.
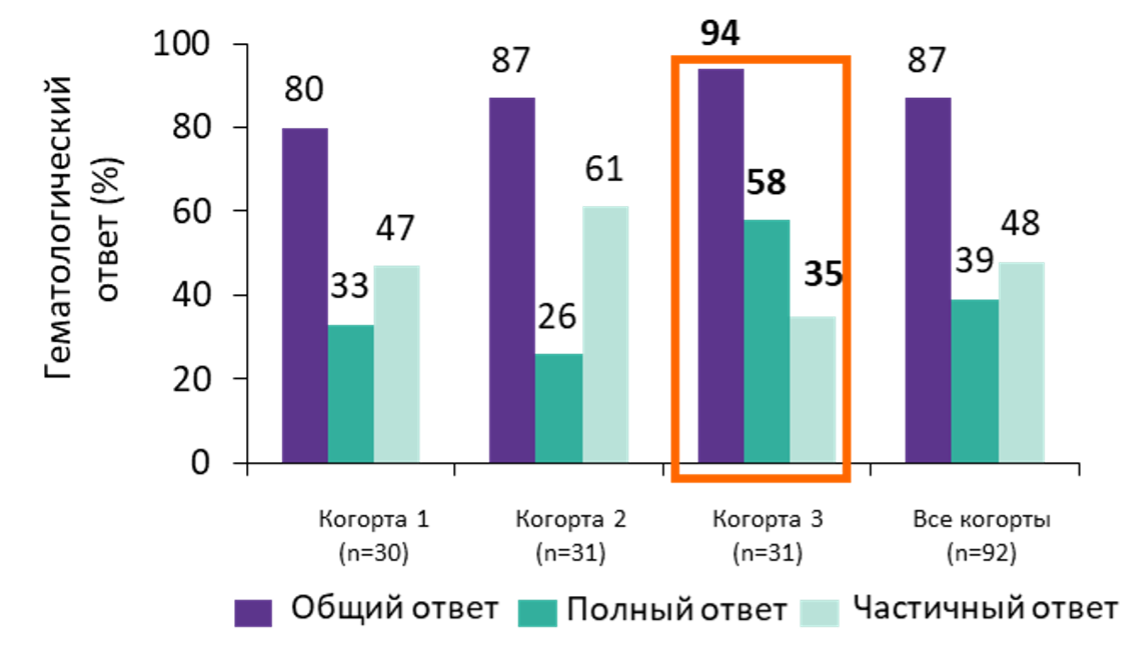
Рисунок 5. Ответ на комбинированную ИСТ в сочетании с элтромбопагом на 6 месяце терапии в исследовании Townsley D.M. et al., 2017
Общая выживаемость в группе ИСТ + элтромбопаг через 2 года составила 99% и 97% без учета ТКМ.
Клональная эволюция в течение 2 лет произошла у 8% участников, что оказалось сопоставимо с частотой клональной эволюции в исторической когорте (рис. 6).
Частота возникновения мутаций ГСК в когорте элтромбопага оказалась ниже, чем на фоне только ИСТ, — 22%4 по сравнению с 35%5. У всех пациентов с мутациями на фоне терапии ИСТ + элтромбопаг был достигнут гематологический ответ4.
Показатели переносимости и безопасности терапии схемы ИСТ + элтромбопаг сопоставимы с таковыми при ИСТ.
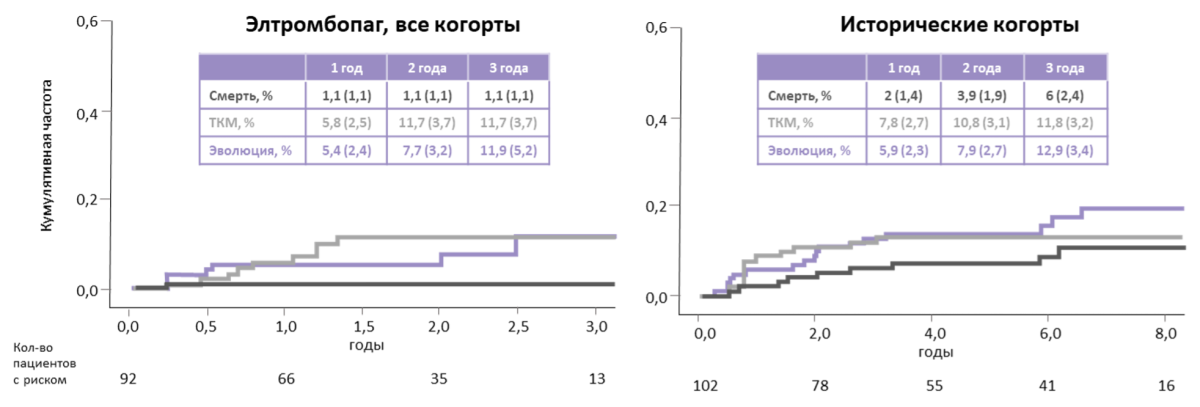
Рисунок 6. Сравнение показателей терапии тяжелой АА в исследовании Townsley D.M. et al., 2017, и исторической когорте
Исследование RACE6
Открытое рандомизированное исследование III фазы, посвященное изучению применения ИСТ в комбинации с элтромбопагом или без в 1 линии терапии у пациентов с ТАА. В исследовании приняли участие 197 пациентов с впервые выявленной тяжелой и сверхтяжелой АА в возрасте 15 лет и старше6.
Критериями оценки эффективности терапии являлись: частота достижения полного ответа (гемоглобин > 10,0 г/л, гранулоциты > 1,0 × 109/л, тромбоциты > 100,0 × 109/л), частота неполного ответа (доля пациентов, у которых показатели гемограммы превышают уровень, соответствующий тяжелой АА, но не соответствуют условиям полного ответа), частота общего ответа (доля пациентов, достигших полного и неполного ответа), выживаемость, клональная эволюция, развитие мутаций ГСК.
Частота полного ответа в группе ИСТ + элтромбопаг через 3 месяца оказалась выше, чем в группе ИСТ, — 21,9% и 9,9% соответственно (p = 0,012). Частота достижения общего ответа составила 31,7% и 59,4% соответственно.
За время наблюдения (медиана 18 мес.) клональная эволюция произошла у 1 пациента в группе ИСТ + элтромбопаг и у 3 пациентов группы ИСТ.
Общая выживаемость в течение 2 лет составила 83,2% в группе ИСТ + элтромбопаг и 86,3% в группе ИСТ (различия статистически не значимы, p = 0,142).
Исследование Desmond R. et al., 20147
Исследование Desmond R. et al., 2014, представляет собой когортное несравнительное испытание на 43 пациентах с рефрактерной ТАА в возрасте 12 лет и старше. Пациенты получали ИСТ + элтромбопаг7.
Общая частота ответа на терапию составила 40%. Среди ответивших на терапию и продолживших лечение 50% достигли ответа со стороны трех ростков кроветворения. Среди пациентов, получавших регулярные трансфузии тромбоцитов, 60% смогли от них отказаться.
Список литературы:
- Новартис Фарма АГ. Револейд, таблетки, покрытые пленочной оболочкой. Инструкция по медицинскому применению. ЛСР-010032/09.; 2020.
- Erickson-Miller CL, DeLorme E, Tian S-S, и др. Discovery and characterization of a selective, nonpeptidyl thrombopoietin receptor agonist. Exp Hematol. 2005;33(1):85–93.
- Михайлова ЕА, Фидарова ЗТ, Троицкая ВВ, и др. Клинические рекомендации по диагностике и лечению апластической анемии (редакция 2019 г.). Гематология и трансфузиология. 2020;65(2).
- Townsley DM, Scheinberg P, Winkler T, и др. Eltrombopag added to standard immunosuppression for aplastic anemia. N Engl J Med. 2017;376(16):1540–1550.
- Yoshizato T, Dumitriu B, Hosokawa K, и др. Somatic mutations and clonal hematopoiesis in aplastic anemia. N Engl J Med. 2015;373(1):35–47.
- Peffault de Latour R, Marsh J, Iacobelli S. Results of the EBMT saawp phase III prospective randomized multicenter race study of horse ATG and ciclosporin with or without Eeltrombopag in naïve SAA patients. В: 46th Annual Meeting of the EBMT. ; 2020:22–25.
- Desmond R, Townsley DM, Dumitriu B, и др. Eltrombopag restores trilineage hematopoiesis in refractory severe aplastic anemia that can be sustained on discontinuation of drug. Blood, J Am Soc Hematol. 2014;123(12):1818–1825.
11213590/REV/WEB/07.24/0
