ТПО — главный регулятор самовоспроизведения и выживания гемопоэтической стволовой и прогениторной клетки1–3
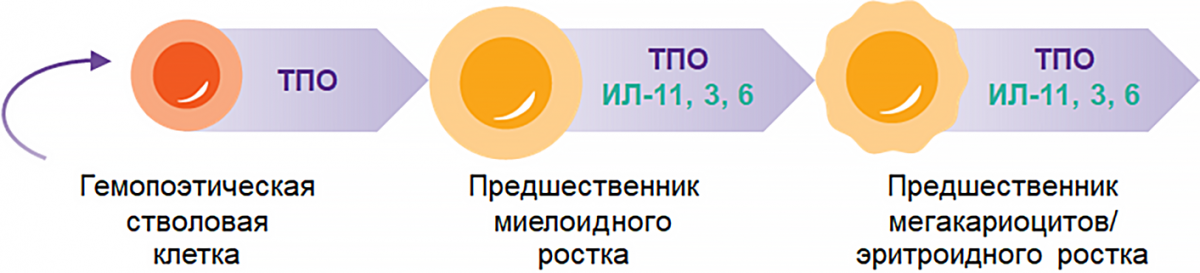
Примечание.
ТПО — тромбопоэтин.
У пациентов с ТАА уровень эндогенного ТПО высокий4
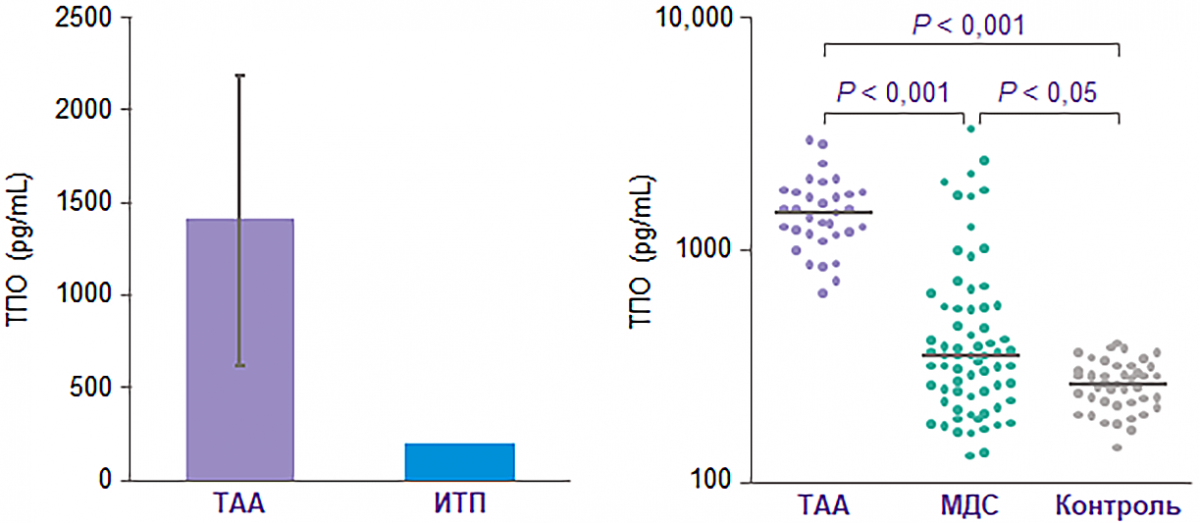
Несмотря на высокий уровень нативного ТПО у пациентов с ТАА, он не выполняет должным образом функцию регуляции самовоспроизведения и выживания ГСК4.
Примечание.
ТПО — тромбопоэтин.
Возможной причиной нарушения гемопоэза при ТАА является связывание ТПО с IFN-γ5–10
В норме
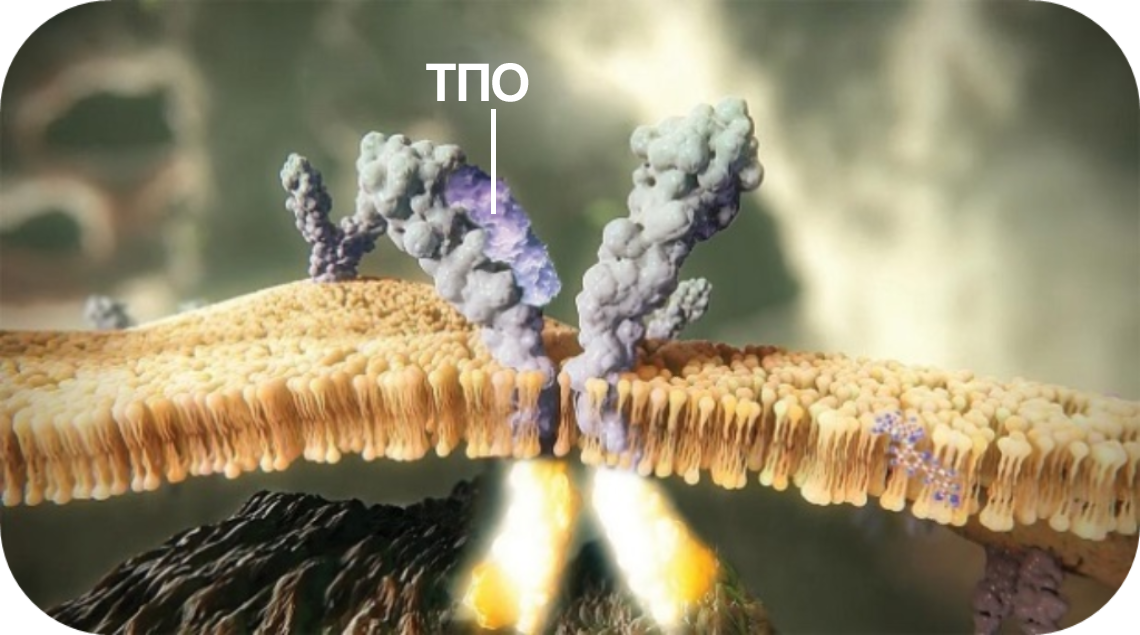

ТПО связывается с внеклеточным доменом рецептора ТПО (р-ТРО), что приводит к активации нисходящих сигналов.
При ТАА
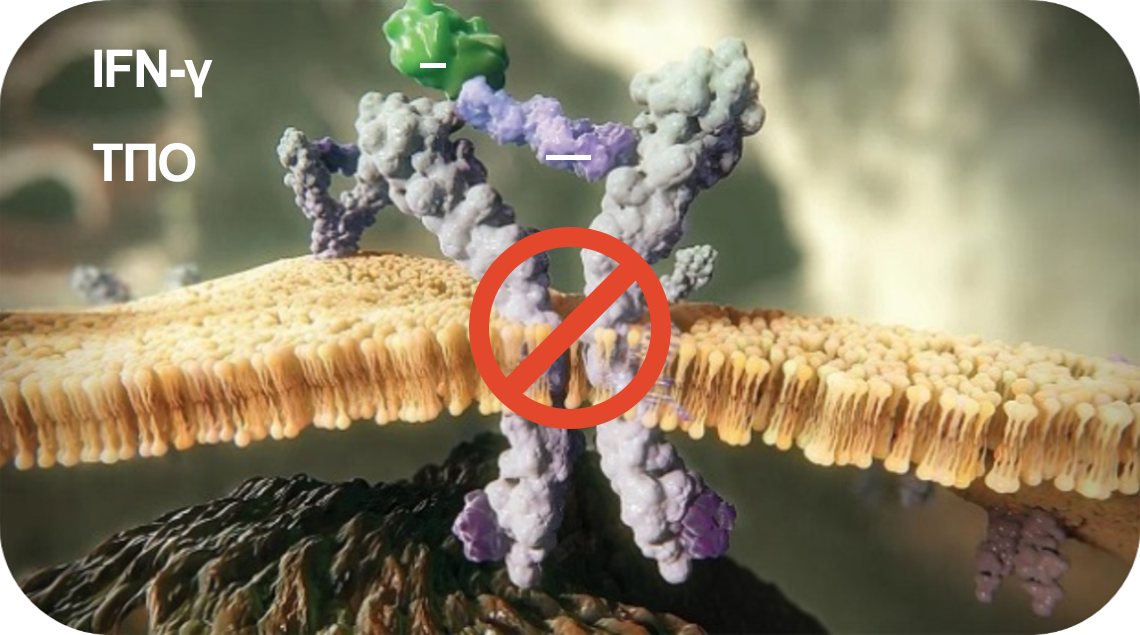

IFN-γ — ключевой цитокин, вовлеченный в деструкцию ГСК и прогениторных клеток при ТАА. Он связывается с ТПО, препятствуя его взаимодействию с внеклеточным доменом рецептора и блокируя нисходящие сигналы.
Цитокины IFN-γ и ФНО-α избыточно экспрессированы в КМ лимфоцитах у пациентов с ТАА11
IFN-γ
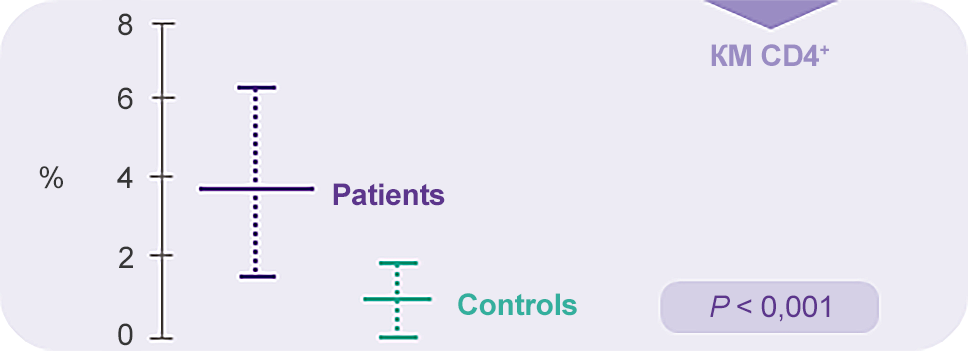

TNF-α
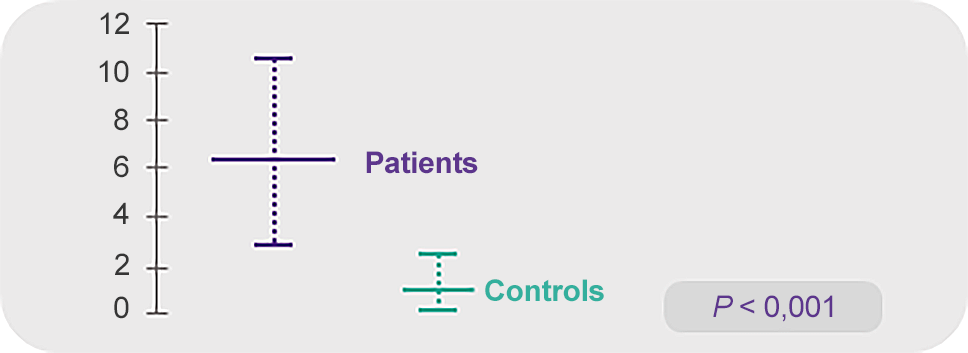
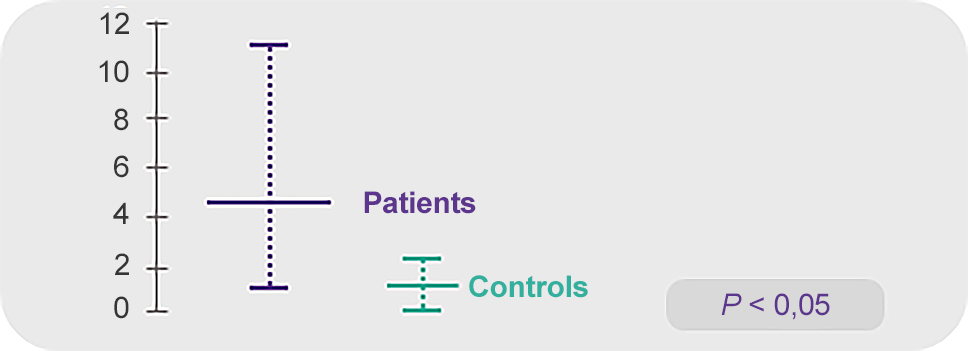
Примечание.
Values are reported as mean ± SD of percentages.
Элтромбопаг активирует гемопоэз даже в присутствии IFN-γ5–10
При ТАА
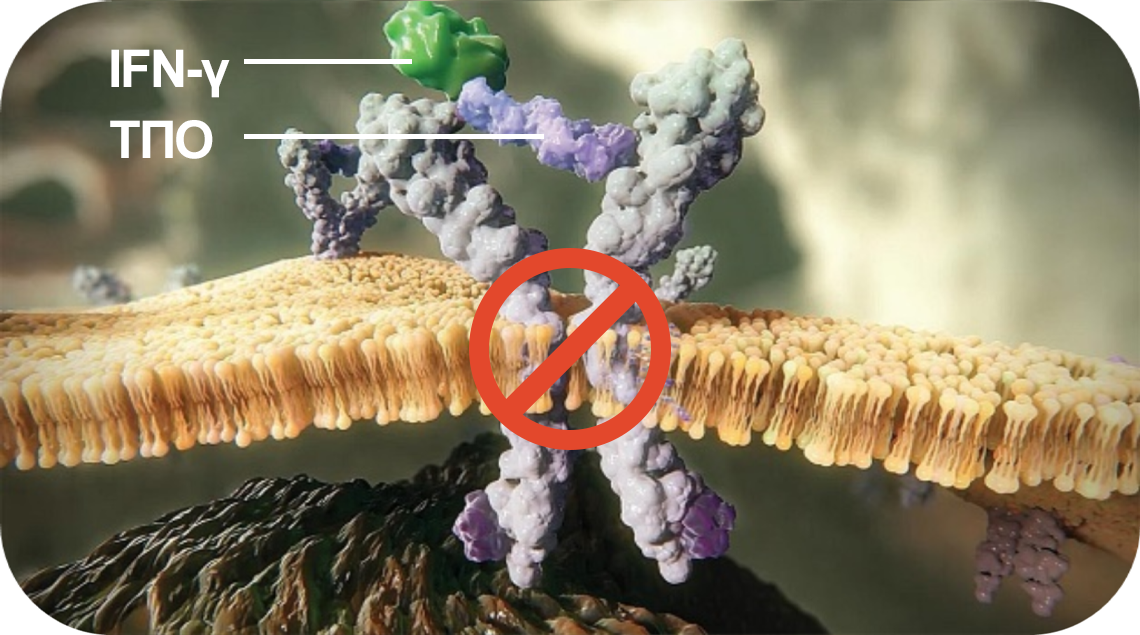

IFN-γ — ключевой цитокин, вовлеченный в деструкцию ГСК и прогениторных клеток при ТАА.
Он связывается с ТПО, препятствуя его взаимодействию с внеклеточным доменом рецептора и блокируя нисходящие сигналы.
Элтромбопаг
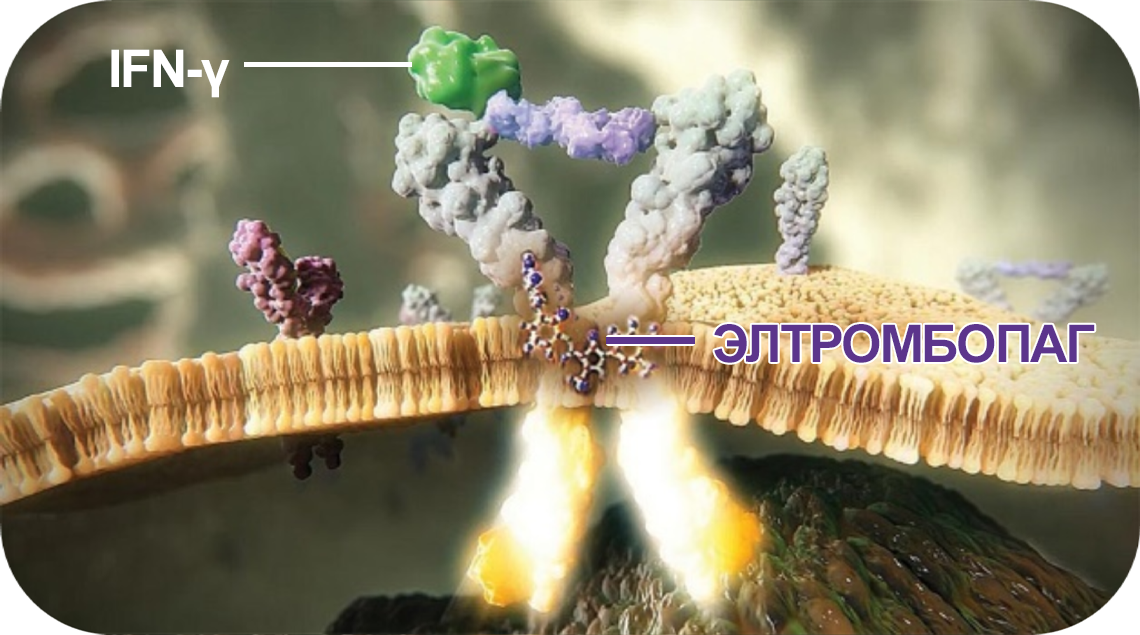

Элтромбопаг взаимодействует не с внеклеточным, а с трансмембранным доменом рецептора ТПО.
Поэтому он активирует сигнальные пути даже в присутствии IFN-γ, не связываясь с ним.
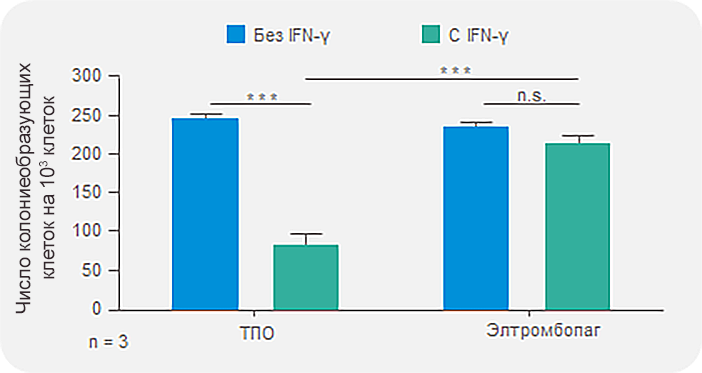
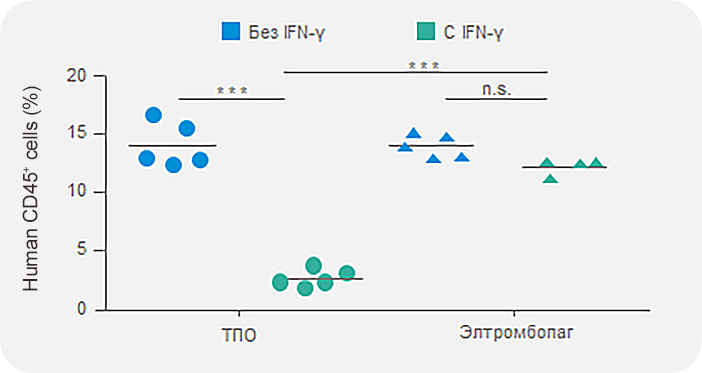
Элтромбопаг сохраняет число ГСК и прогениторных клеток в присутствии IFN-γ in vitro12
-
IFN-γ — ключевой провоспалительный цитокин, вовлеченный в деструкцию ГСК и прогениторных клеток при ТАА.
-
Элтромбопаг может нивелировать этот эффект in vitro, вызывая:
Увеличение количества предшественников колониеобразующих единиц
Улучшение приживления CD45+ клеток на моделях трансплантации
Примечание.
*** p < 0,001
CD45 — связанный с рецептором белок тирозинфосфатаза, присутствует во всех кроветворных клетках, кроме эритроцитов и плазматических клеток.
HSPC — гемопоэтическая и прогениторная клетка.
Потенциальные механизмы, посредством которых элтромбопаг улучшает гемопоэз при апластической анемии13
Влияние на ГСК
-
Стимуляция ГСК
-
Сохранение ГСК
-
Обход подавления ГСК IFN-γ
Иммуномодуляция
-
Уменьшение высвобождения IFN-γ
-
Уменьшение высвобождения TNF-α
-
Усиление высвобождения TGF-β
Улучшение переносимости
-
Отсрочка активности макрофагов
-
Нарушение созревания дендритных клеток
-
Усиление регуляции B-клеток
-
Усиление регуляции Т-клеток
Хелация
-
Мобилизация внутриклеточного Fe
-
Снижение перегрузки Fe
-
Возможные бенефиты для гемопоэза
Примечание.
IFN-g, interferon-g; TGFb, transforming growth factor-b.
Задачи терапии апластической анемии


Примечание.
Adapted from Young N.S. et al. Hematology Am Soc Hematol Educ Program 2013;76–81.
Рекомендации Национального гематологического общества (НГО)
Программное лечение больных АА, рекомендации НГО14
-
1
Комбинированная иммуносупрессивная терапия, включающая антитимоцитарный глобулин, циклоспорин А. -
2
Использование в программах лечения больных апластической анемией стимуляторов или индукторов кроветворения (Элтромбопаг). -
3
Заместительная гемотрансфузионная терапия (донорские эритроцитная масса, тромбоконцентраты, свежезамороженная плазма). -
4
Хелаторная терапия.
Этапы лечения больных АА, рекомендации НГО14
-
I
АТГ назначают на первом этапе лечения. Через 2 недели от начала курса АТГ (после купирования симптомов сывороточной болезни) начинают терапию циклоспорином. Стартовая суточная доза циклоспорина составляет 5–10 мг/кг/сут. Коррекцию суточной дозы проводят с учетом индивидуальной переносимости препарата и содержания циклоспорина А в сыворотке крови. -
II
Через 3–6 месяцев от начала ИСТ при отсутствии положительной клинико-гематологической динамики проводят второй курс терапии АТГ. Терапия циклоспорином должна быть продолжена. Может быть начата терапия элтромбопагом. -
III
Через 6 месяцев от начала ИСТ при рефрактерном течении АА и сохраняющейся зависимости больного от трансфузий донорских эритроцитов и тромбоцитов в программу лечения включают элтромбопаг, если препарат не был назначен ранее. Кроме того, под контролем показателей обмена железа может проводиться хелаторная терапия (деферазирокс).
Примечание.
Курс терапии циклоспорином у больных апластической анемией продолжается 18–24 месяца (не менее 12 месяцев после достижения ремиссии).
Курс терапии АТГ соответствует протоколам № 1 и № 2 (таб. 1, 2). В течение первых 21–28 дней курса, даже при отсутствии инфекционных осложнений, больной находится в асептических условиях одноместной палаты.
Оценка результатов лечения, рекомендации НГО14
-
1
Ремиссия (полная или частичная) — полная или частичная нормализация показателей гемограммы (гемоглобин > 100,0 г/л, гранулоциты > 1,5 × 109/л, тромбоциты > 100,0 × 109/л) и отсутствие потребности в заместительной терапии компонентами крови. -
2
Клинико-гематологическое улучшение — улучшение показателей гемограммы (гемоглобин > 80,0 г/л, гранулоциты > 1,0 × 109/л, тромбоциты > 20,0 × 109/л), исчезновение или значительное уменьшение зависимости от трансфузий компонентов крови. -
3
Результаты лечения оценивают через 3, 6, 9, 12, 18, 24 месяца и далее ежегодно.
Литературные источники:
- Cines D.B., Liebman H., Stasi R. Pathobiology of secondary immune thrombocytopenia. Semin Hematol. 2009;46(1 Suppl 2):S2-14.
- Arnold D.A., Patriquin C., Toltl L.J. et al. Diseases of platelet number: immune thrombocytopenia, neonatal alloimmune thrombocytopenia, and posttransfusion purpura. In: Hoffman R.
- Benz E.J., Silberstein L.E. et al. eds. Hematology: Basic Principles and Practice. 6th ed. Philadelphia, PA: Saunders, Elsevier Ins.; 2013:1883-1894.
- Emmons R.V. et al. Blood 1996;87:4068–4071; Feng X et al. Haematologica 2011;96:602–606.
- Erickson-Miller C. et al. Exp Hematol 2005;33:85–93.
- Bussel J.B. & Pinheiro M.P. In: Hematopoietic Growth Factors in Oncology 2011.
- Kuter D. et al. Seminars Hematol 2010; 47:243–248.
- Kuter D.J. Blood 2007;109: 4607–4616.
- Erickson-Miller C. et al. Stem Cells 2009;27:424.
- Sun H. et al. Stem Cell Res 2012;9:77–86.
- Dufour C. et al. Br J Haematol 2001;115:1023–1031.
- Alvarado L.J. et al. Blood 2017;130:abst 4, oral presentation at ASH 2017.
- P. Scheinberg, Activity of eltrombopag in severe aplastic anemia 13 NOVEMBER 2018 x VOLUME 2, NUMBER 21.
- Клинические рекомендации по лечению апластической анемии (комбинированная иммуносупрессивная терапия). Национальное Гематологическое Общество. 2018 год.
11213657/REV/WEB/07.24/0
