Как уже было сказано, подход гликемического контроля с использованием стартовой комбинированной терапии ранее частично рассматривался в клинических рекомендациях, однако только с позиции того, что два ССП могут обеспечить больший эффект снижения исходно высокого HbA1c. Поэтому такой подход рекомендовался ранее лишь пациентам для быстрого достижения целей терапии.
Концепция
Концепция исследования VERIFY предполагала болезнь-модифицирующий эффект от терапии комбинацией препаратов с комплементарным механизмом действия на старте заболевания. Поэтому дизайн исследования был в первую очередь сфокусирован на пациентах с недавно установленным диагнозом СД2, имеющим небольшое повышение HbA1c. В исследование были включены пациенты со средним стажем СД2 около 3 месяцев и со средним HbA1c 6,7% (т. е. почти пограничным уровнем диагностирования СД2).
Для подтверждения гипотезы об увеличении долгосрочности удержания достигнутого гликемического контроля в исследовании сравнили два терапевтических подхода:
- традиционный подход поэтапной интенсификации терапии (ПИТ) — старт терапии метформином со своевременной интенсификацией путем добавления вилдаглиптина;
- подход ранней комбинированной терапии (РКТ) — старт терапии с комбинации вилдаглиптина с метформином.
Результаты
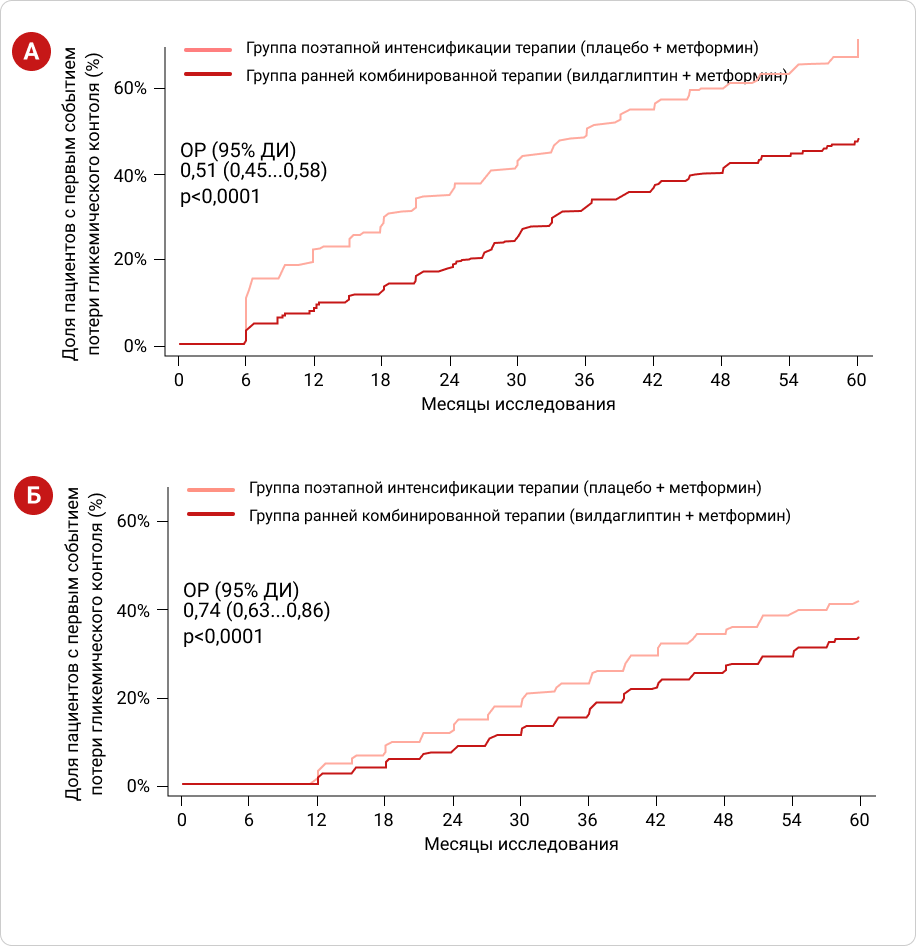
По результатам исследования было показано, что пациенты, находившиеся в группе РКТ, в 2 раза реже теряли гликемический контроль в ходе 5 лет исследования (ОР: 0,51 [0,45-0,58]) и в среднем на 2 года дольше удерживали стойкий гликемический контроль (HbA1c<7,0%), чем пациенты группы ПИТ (Рис. 3А).
Более того, успех полученных результатов подтверждался и во втором этапе исследования, когда оценили частоту вторичной потери контроля у пациентов в двух группах: группы, исходно начавшей терапию вилдаглиптина с метформином — РКТ, и группы, пациенты которой поэтапно перешли на данную комбинацию — ПИТ.
Во втором этапе в группе РКТ пациенты на четверть реже теряли гликемический контроль (ОР: 0,74 [0,63-0,86]), несмотря на то, что пациенты обеих групп находились на комбинации одинаковыми препаратами (Рис. 3Б)18.
Рисунок 2. Кумулятивная частота первичной (А) и вторичной (Б) потери гликемического контроля в исследовании VERIFY.
Дополнительное подтверждение результатов
-
В первые 3 месяца терапии 3 из 4 пациентов в группе РКТ достигали HbA1c <6,5 %, в то время как только 2 из 4 пациентов в группе ПИТ достигали данного показателя.Притом независимо от того, что пациенты из группы ПИТ постепенно переходили на комбинированную терапию теми же препаратами, доля пациентов с HbA1c <6,5% в РКТ существенно превосходила долю таких пациентов в группе ПИТ на протяжении всех 5 лет исследования.
- В группе РКТ к концу первого периода исследования наблюдалось увеличение функции β-клетки; в группе ПИТ, получавшей только метформин, функция β‑клетки, наоборот, снижалась. Межгрупповая разница составила 19,23% в пользу РКТ (p <0,001)32.
-
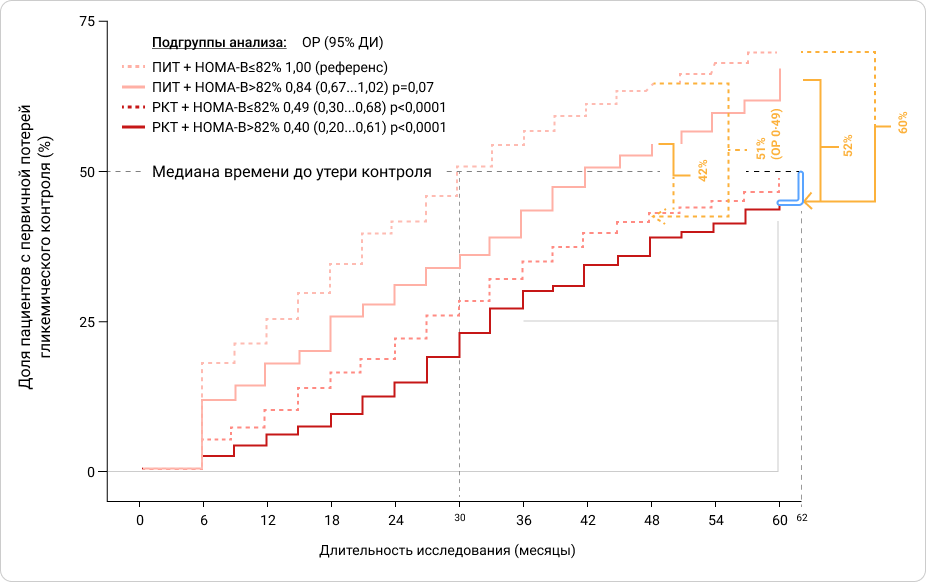
Также преимущество РКТ по сравнению с ПИТ сохранялось при стратификации пациентов исследования по исходной функции β-клетки (Рис.3).Было показано, что пациенты в группе ПИТ, находящиеся в страте наименьшего показателя функции β-клетки и получавшие только метформин, наиболее часто теряли гликемический контроль.По сравнению с этой группой пациенты в страте с более сохранной функцией β‑клетки, получавшие РКТ, имели на 60% ниже риск потери гликемического контроля. Также эта группа в среднем на 2 года и 8 месяцев дольше удерживала гликемический контроль33.
Рисунок 3. Кумулятивная частота первичной утраты гликемического контроля в исследовании VERIFY в разных стратегиях терапии при стратификации по медианному значению показателя оценки функции β‑клетки (HOMA-B=82%).
Оценка влияния на СС исходы
Как отмечалось в мета-анализе27, у более ранних пациентов с СД2 вилдаглиптин, возможно, оказывает благоприятное влияние на кардиометаболические факторы риска и, как следствие, на долгосрочный прогноз.
Дополнительно, в контексте строгого гликемического контроля, возможного патогенетического влияния на траекторию заболевания за счет исходного улучшения функции β-клетки и концепции избегания клинической инерции в исследовании VERIFY предприняли попытку оценить влияние РКТ метформина с вилдаглиптином на СС прогноз пациентов на коротком для такой ранней популяции горизонте времени.
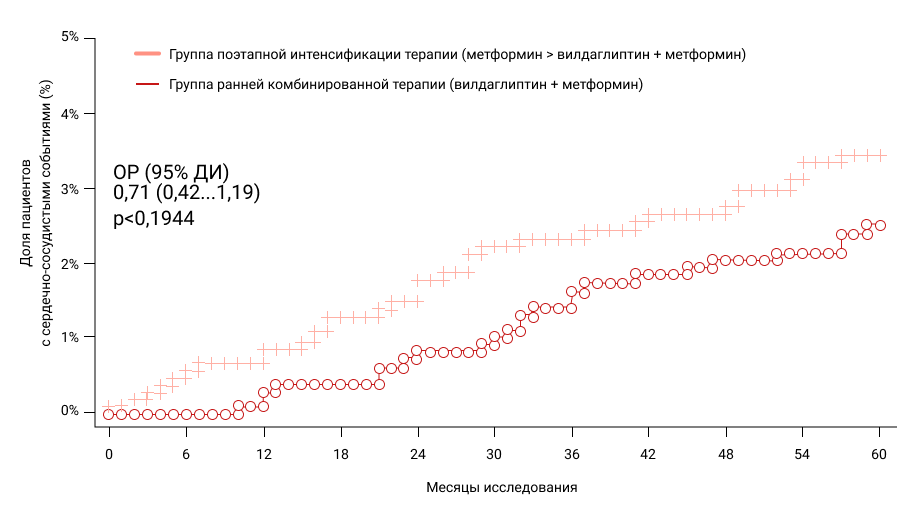
Оценка безопасности VERIFY продемонстрировала, что даже в такой ранней популяции пациентов (общая доля ССЗ за 5 лет исследования <3%) в группе РКТ вилдаглиптином с метформином наблюдалась тенденция к снижению на 29% частоты ССЗ (ОР: 0,71 [0,42-1,19] тренд в пользу РКТ вилдаглиптина с метформином, кумулятивные кривые пропорционально расходились на протяжении всех 5 лет исследования) (Рис. 4)19.
Рисунок 4. Кумулятивная частота развития ССЗ в VERIFY
Всестороннее управление прогнозом пациента с СД2
Как видно, исследователи, врачебное сообщество и авторы рекомендаций на постоянной основе пересматривают возможные подходы старта терапии пациентов с СД2.С одной стороны, это связано с эпидемическим характером роста числа пациентов с СД2 и необходимостью поиска комплексных решений в управлении заболеванием; с другой стороны, это возможно благодаря поступающим результатам широкомасштабных исследовательских программ.
На основании совокупности накопленных данных к 2023 году как зарубежные, так и российские рекомендации претерпели концептуальные изменения. В связи с достигнутыми позитивными результатами многих исследований и внедрением этих результатов в алгоритмы помощи пациентов у врачей и пациентов появляется возможность повлиять на траекторию течения заболевания и его осложнений.
Результаты исследования VERIFY продемонстрировали, что ранняя комбинация метформина с вилдаглиптином у большой доли пациентов может не только обеспечить контроль показателей гликемии до сопоставимых с преддиабетическим уровнем, но и обеспечить стойкий и более длительный контроль заболевания.
Такой подход также предполагает, что разностороннее управление заболеванием с момента установления диагноза позволит изменить курс его развития и избежать возможных осложнений в будущем.
В последних обновлениях клинических рекомендаций по всему миру на один пьедестал встали как управление прогнозом пациентов с высоким риском ССЗ, так и управление гликемическими целями с момента исходного выбора терапии у ранних пациентов. Это стало возможным в связи с фокусом экспертного сообщества на подходе раннего интенсивного вмешательства в аспекты патогенеза СД2, немалую роль в подтверждении преимуществ которого сыграло исследование VERIFY17, 21.
Список литературы
- Magliano DJ, Boyko EJ, IDF Diabetes Atlas 10th edition scientific committee. IDF DIABETES ATLAS. 2021 [cited 29 Aug 2023]. Available: https://www.ncbi.nlm.nih.gov/books/NBK581934/
- Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group. Lancet. 1998;352: 854–865. Available: https://www.ncbi.nlm.nih.gov/pubmed/9742977
- American Diabetes Association. Abridged for Primary Care Providers. Clin Diabetes. 2017;35: 5–26. doi:10.2337/cd16-0067
- Viberti G, Kahn SE, Greene DA, Herman WH, Zinman B, Holman RR, Haffner SM, Levy D, Lachin JM, Berry RA, Heise MA, Jones NP, Freed MI. A diabetes outcome progression trial (ADOPT): an international multicenter study of the comparative efficacy of rosiglitazone, glyburide, and metformin in recently diagnosed type 2 diabetes. Diabetes Care. 2002 Oct;25(10):1737-43. doi: 10.2337/diacare.25.10.1737.
- Kahn SE. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 2003 Jan;46(1):3-19. doi: 10.1007/s00125-002-1009-0
- Blüher, M, Malhotra, A, Bader, G. Beta-cell function in treatment-naïve patients with type 2 diabetes mellitus: Analyses of baseline data from 15 clinical trials. Diabetes Obes Metab. 2023; 25(5): 1403-1407. doi:10.1111/dom.14969
- Khunti K, Wolden ML, Thorsted BL, Andersen M, Davies MJ. Clinical inertia in people with type 2 diabetes: a retrospective cohort study of more than 80,000 people. Diabetes Care. 2013 Nov;36(11):3411-7. doi: 10.2337/dc13-0331.
- Dedov I.I., Shestakova M.V., Mayorov A.Y., Vikulova O.K., Galstyan G.R., Kuraeva T.L., Peterkova V.A., Smirnova O.M., Starostina E.G., Surkova E.V., Sukhareva O.Y., Tokmakova A.Y., Shamkhalova M.S., Jarek-Martynova I.R., Beshlieva D.D., Bondarenko O.N., Volevodz N.N., Grigoryan O.R., Esayan R.M., Ibragimova L.I., Kalashnikov V.Y., Lipatov D.V., Shestakova E.A. Standards of specialized diabetes care. Edited by Dedov II, Shestakova MV, Mayorov AY. 8th edition. Diabetes mellitus. 2017;20(1S):1-121. (In Russ.). https://doi.org/10.14341/DM20171S8
- Laiteerapong N, Ham SA, Gao Y, Moffet HH, Liu JY, Huang ES, et al. The Legacy Effect in Type 2 Diabetes: Impact of Early Glycemic Control on Future Complications (The Diabetes & Aging Study). Diabetes Care. 2019;42: 416–426. doi:10.2337/dc17-1144
- Davies MJ, D’Alessio DA, Fradkin J, Kernan WN, Mathieu C, Mingrone G, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2018;41: 2669–2701. doi:10.2337/dci18-0033
- Cosentino F, Grant PJ, Aboyans V, Bailey CJ, Ceriello A, Delgado V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020;41: 255–323. doi:10.1093/eurheartj/ehz486
- Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;140: e596–e646. doi:10.1161/CIR.0000000000000678
- Buse JB, Wexler DJ, Tsapas A, Rossing P, Mingrone G, Mathieu C, et al. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2020;43: 487–493. doi:10.2337/dci19-0066
- American Diabetes Association. 9. Pharmacologic Approaches to Glycemic Treatment: Diabetes Care. 2020;43: S98–S110. doi:10.2337/dc20-S009
- American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Diabetes Care. 2021;44: S15–S33. doi:10.2337/dc21-S002
- American Diabetes Association Professional Practice Committee. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2022. Diabetes Care. 2022;45: S17–S38. doi:10.2337/dc22-S002
- ElSayed NA, Aleppo G, Aroda VR, Bannuru RR, Brown FM, Bruemmer D, et al. 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Care in Diabetes-2023. Diabetes Care. 2023;46: S140–S157. doi:10.2337/dc23-S009
- Bethel MA, Sourij H. Impact of FDA guidance for developing diabetes drugs on trial design: from policy to practice. Curr Cardiol Rep. 2012;14: 59–69. doi:10.1007/s11886-011-0229-7
- Matthews DR, Paldánius PM, Proot P, Chiang Y, Stumvoll M, Del Prato S, et al. Glycaemic durability of an early combination therapy with vildagliptin and metformin versus sequential metformin monotherapy in newly diagnosed type 2 diabetes (VERIFY): a 5-year, multicentre, randomised, double-blind trial. Lancet. 2019;394: 1519–1529. doi:10.1016/S0140-6736(19)32131-2
- Шестакова М.В., Анциферов М.Б., Аметов А.С., Галстян Г.Р., Демидова Т.Ю., Зилов А.В., Маркова Т.Н., Петунина Н.А., Черникова Н.А., Шамхалова М.Ш. Какие новые возможности для клинической практики открывает исследование VERIFY и какова его ценность для пациентов с впервые выявленным СД 2 типа? Совместное заключение по итогам экспертного совета. 6 ноября 2019 г. Сахарный диабет. 2020;23(1):106-110. https://doi.org/10.14341/DM12404
- Клинические рекомендации. Сахарный диабет 2 типа у взрослых. 2022 г. https://cr.minzdrav.gov.ru/recomend/290_2 (доступ: сентябрь 2023 г.)
- Aroda VR, Henry RR, Han J, Huang W, DeYoung MB, Darsow T, et al. Efficacy of GLP-1 receptor agonists and DPP-4 inhibitors: meta-analysis and systematic review. Clin Ther. 2012;34: 1247–1258.e22. doi:10.1016/j.clinthera.2012.04.013
- Esposito K, Chiodini P, Maiorino MI, Capuano A, Cozzolino D, Petrizzo M, et al. A nomogram to estimate the HbA1c response to different DPP-4 inhibitors in type 2 diabetes: a systematic review and meta-analysis of 98 trials with 24 163 patients. BMJ Open. 2015;5: e005892. doi:10.1136/bmjopen-2014-005892
- Ahrén B, Mathieu C, Bader G, Schweizer A, Foley JE. Efficacy of vildagliptin versus sulfonylureas as add-on therapy to metformin: comparison of results from randomised controlled and observational studies. Diabetologia. 2014;57: 1304–1307. doi:10.1007/s00125-014-3222-z
- Brath H, Paldánius PM, Bader G, Mathieu C. Relationship Between Duration of Type 2 Diabetes and Effectiveness of DPP-4 Inhibitor Versus Sulfonylurea as Add-on Therapy: A Post Hoc Analysis. Diabetes Ther. 2017;8: 829–836. doi:10.1007/s13300-017-0276-1
- Green JB, Bethel MA, Armstrong PW, Buse JB, Engel SS, Garg J, et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2015;373: 232–242. doi:10.1056/NEJMoa1501352
- Schernthaner G, Cahn A, Raz I. Is the Use of DPP-4 Inhibitors Associated With an Increased Risk for Heart Failure? Lessons From EXAMINE, SAVOR-TIMI 53, and TECOS. Diabetes Care. 2016;39 Suppl 2: S210–8. doi:10.2337/dcS15-3009
- Crowley MJ, Williams JW Jr, Kosinski AS, D’Alessio DA, Buse JB. Metformin Use May Moderate the Effect of DPP-4 Inhibitors on Cardiovascular Outcomes. Diabetes Care. 2017;40: 1787–1789. doi:10.2337/dc17-1528
- Schweizer A, Dejager S, Foley JE, Couturier A, Ligueros-Saylan M, Kothny W. Assessing the cardio-cerebrovascular safety of vildagliptin: meta-analysis of adjudicated events from a large Phase III type 2 diabetes population. Diabetes Obes Metab. 2010;12: 485–494. doi:10.1111/j.1463-1326.2010.01215.x
- McInnes G, Evans M, Del Prato S, Stumvoll M, Schweizer A, Lukashevich V, et al. Cardiovascular and heart failure safety profile of vildagliptin: a meta-analysis of 17 000 patients. Diabetes Obes Metab. 2015;17: 1085–1092. doi:10.1111/dom.12548
- Evans M, Kozlovski P, Paldánius PM, Foley JE, Bhosekar V, Serban C, et al. Factors that may Account for Cardiovascular Risk Reduction with a Dipeptidyl Peptidase-4 Inhibitor, Vildagliptin, in Young Patients with Type 2 Diabetes Mellitus. Diabetes Ther. 2018;9: 27–36. doi:10.1007/s13300-017-0329-5
- Paldánius PM, Del Prato S, Stumvoll M, Matthews DR. Effect on beta cell function in newly diagnosed type 2 diabetes patients after treatment with vildagliptin and metformin: results from the VERIFY study. ePoster # 609_PDF. EASD Virtual meeting, 2020.
- Matthews DR, Paldánius PM, Bader G, Del Prato S. Beta cell activity modulates treatment response in treatment-naive patients: exploratory analysis from the VERIFY study. Abstract # 336. EASD Virtual meeting, 2021.
752811/GAL/DIG/11.23/0