Инклизиран является представителем инновационного класса гиполипидемических препаратов — его действие основано на высокоспецифичном посттранскрипционном сайленсинге гена, кодирующего синтез фермента, определяющего утилизацию липопротеидов низкой плотности (ЛПНП) клетками печени1,2.
Инклизиран представляет собой синтетическую малую интерферирующую РНК (миРНК), конъюгированную «трехантенным» N-ацетилгалактозамином (GalNAc)3–6, обеспечивающим таргетную доставку в печень. Кроме этого, препарат содержит 2′-фтор и 2′-O-метил модификации для повышения стабильности соединения. Фосфодиэфирные связи в скелете заменены фосфотиоатами для защиты молекулы от расщепления экзонуклеазами печени (рис. 1).
Основные характеристики:
-
 Малая интерферирующая РНК для снижения уровня холестерина.
Малая интерферирующая РНК для снижения уровня холестерина. -
 Подкожная инъекция два раза в год.
Подкожная инъекция два раза в год. -
 Благоприятный доклинический фармакокинетический и токсикокинетический профиль.
Благоприятный доклинический фармакокинетический и токсикокинетический профиль. -
 На сегодняшний день находится в фазе клинических исследований в рамках программы исследований ORION7.
На сегодняшний день находится в фазе клинических исследований в рамках программы исследований ORION7.
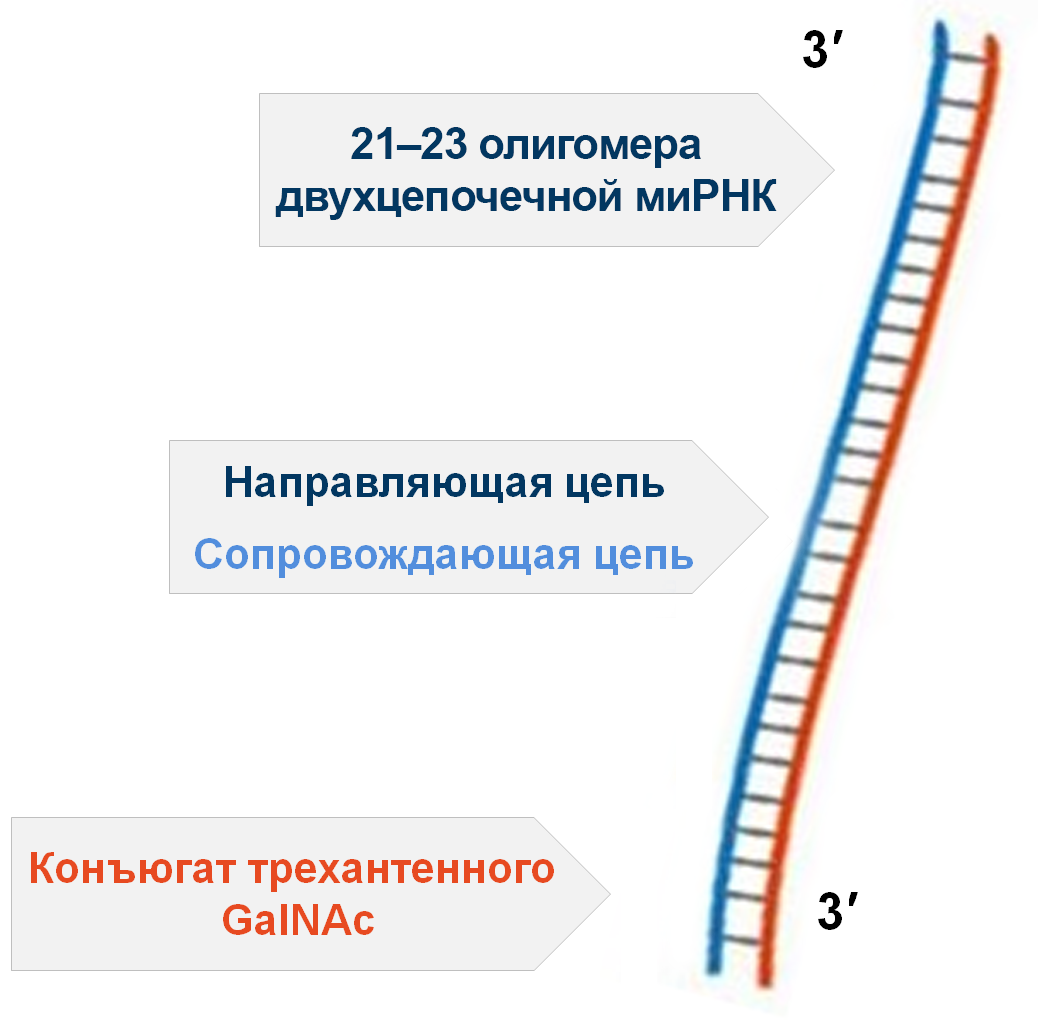
Рисунок 1 — Строение инклизирана
Механизм действия инклизирана
Мишень инклизирана — пропротеин-конвертаза субтилизин/кексин типа 9 (PCSK9). Этот фермент в основном присутствует в печени, связывается с рецептором холестерина ЛПНП и разрушает его. PCSK9 препятствует распознаванию клеткой холестерина ЛПНП и его метаболизму.
Инклизиран задействует естественный механизм РНК-интерференции для расщепления матричной РНК (мРНК) PCSK9 и предотвращения ее трансляции в белковую молекулу. В отличие от молекул, подавляющих активность уже циркулирующей PCSK9, инклизиран подавляет ее синтез.
Конъюгирование с GalNAc способствует быстрому захвату инклизирана гепатоцитами посредством асиалогликопротеинового рецептора (ASGPR) — рисунок 21,5.
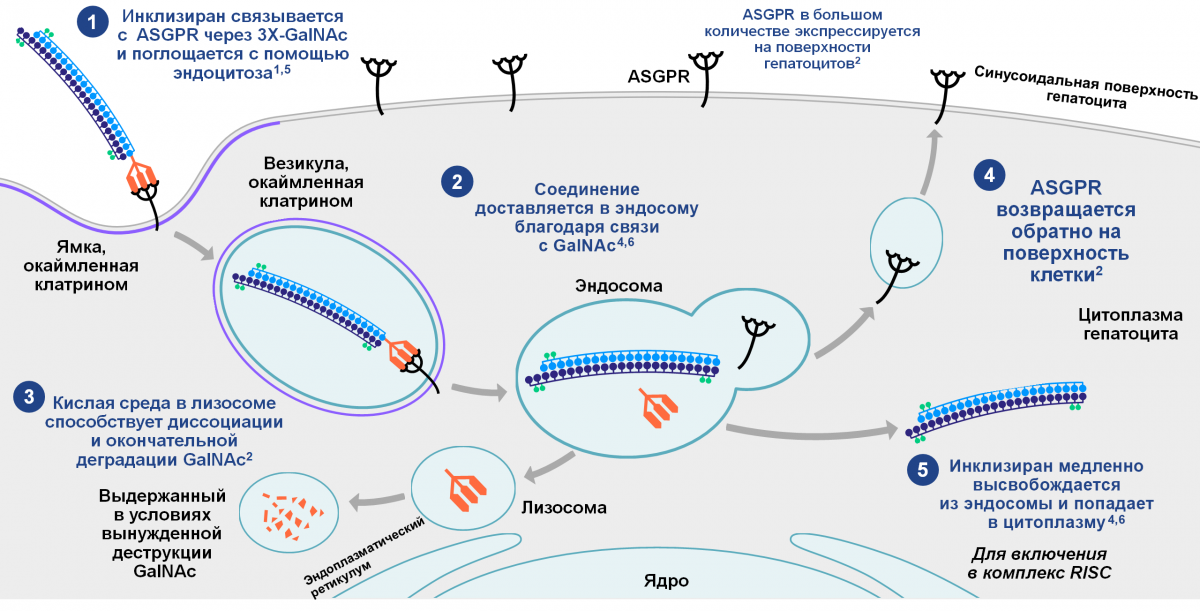
Рисунок 2 — Механизм действия инклизирана
В составе инклизирана миРНК конъюгирована с углеводородом N-ацетилгалактозамином — аминосахарным производным галактозы, стабилизирующим, усиливающим и продлевающим терапевтическую химию миРНК. Кроме того, N-ацетилгалактозамин обладает высоким сродством к асиалогликопротеиновым рецепторам гепатоцитов, что обеспечивает избирательное поступление препарата в клетки печени. После эндоцитоза N-ацетилгалактозаминовый остаток отщепляется от активной молекулы в цитоплазматической эндосоме клетки, а миРНК инклизирана в чистом виде остается в цитоплазме, где и связывается с мРНК PCSK9. Инклизиран встраивается в РНК-индуцируемый комплекс (RISC) и направляет его для разрезания таргетной мРНК, предотвращая синтез белка (рис. 3).
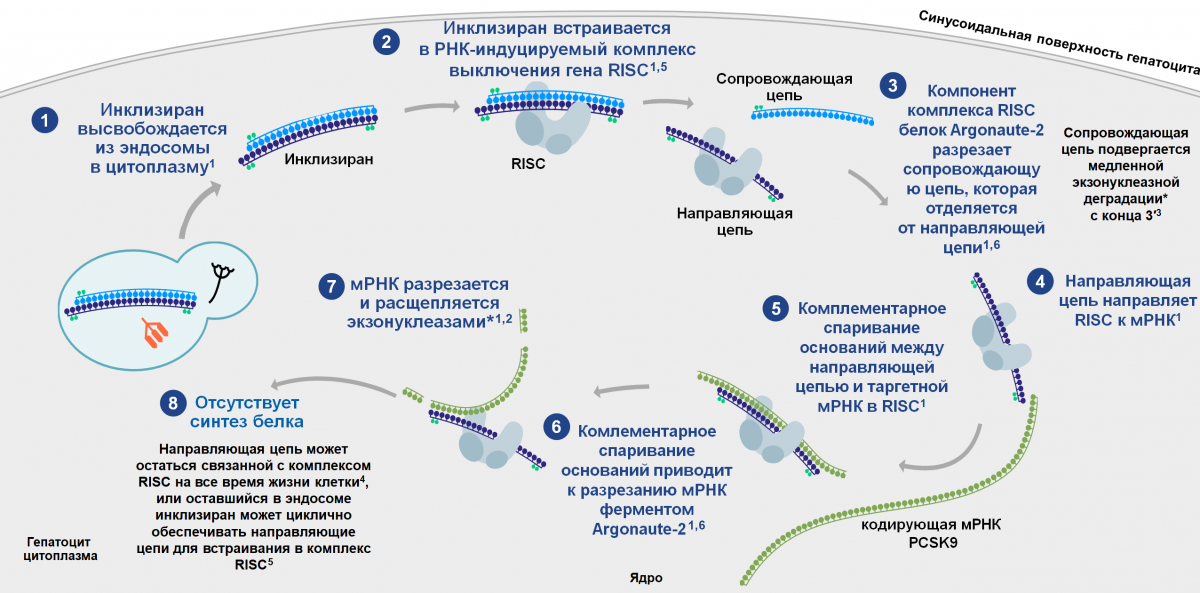
* Нуклеотиды возвращаются в депо печени или выводятся с желчью.
Рисунок 3 — Механизм действия инклизирана
Метаболизм инклизирана
Нуклеотиды подвергаются медленной деградации экзонуклеазами печени. GalNAc на 3′-конце защищает сопровождающую цепь от деградации.
В конечном счете утрата GalNAc и линкеров в эндосоме приводит к атаке экзонуклеаз с 3′-конца. Наблюдается медленная постоянная утрата нуклеотидов с 3′- и 5'-концов направляющей цепи (рис. 4)3.
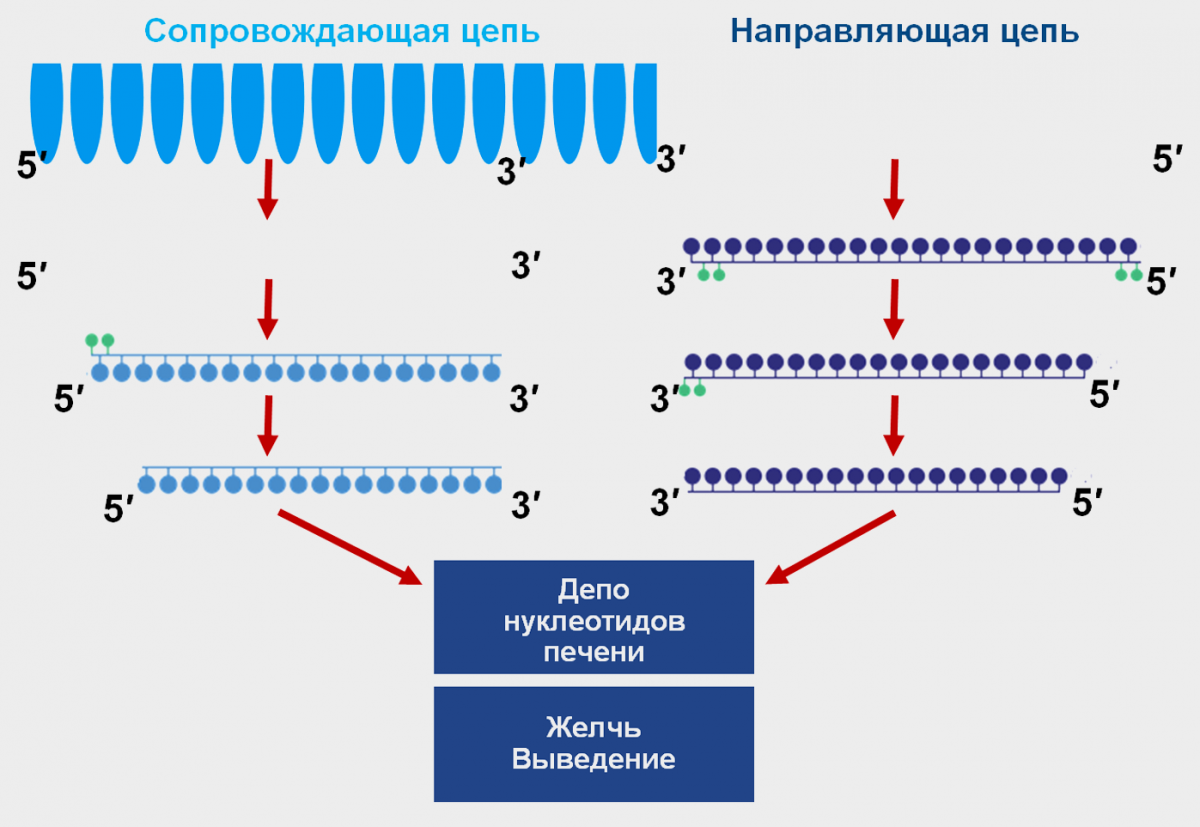
Рисунок 4 — Метаболизм инклизирана
Способ применения
Режим дозирования и способ применения инклизирана представлены на рисунке 5.

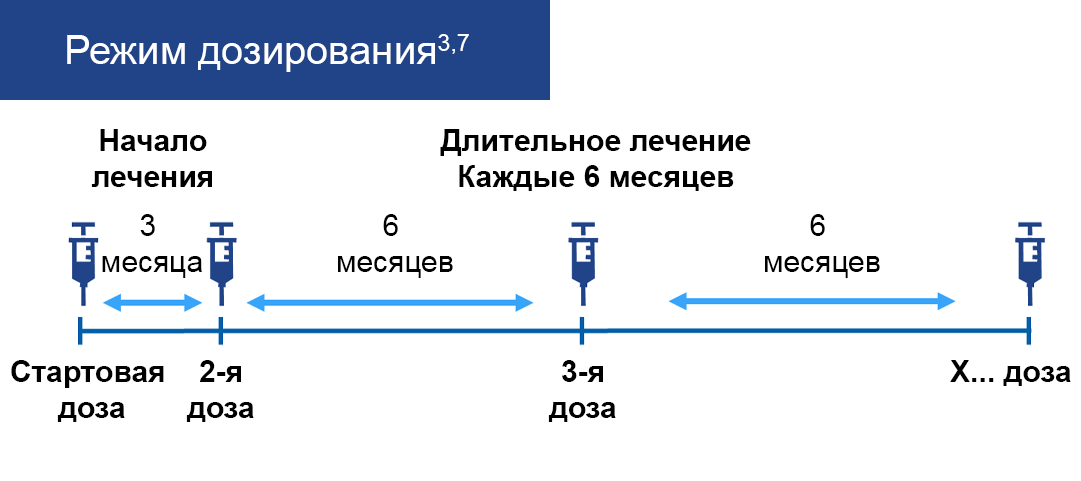

Рисунок 5 — Дозы и способ применения инклизирана
Фармакокинетические свойства
-
Плазма крови
-
Инклизиран выявляется в плазме крови примерно через 0,5 часа после введения, период полувыведения около 7,5 часов3.
-
Максимальные концентрации в плазме выявляются примерно через 4 часа после введения и держатся на этом уровне примерно до 12 часов после введения3,7.
-
Концентрации в плазме крови быстро снижаются в течение 24 часов в связи с распределением препарата в ткани печени* и в связи с почечным клиренсом3.
-
Инклизиран обнаруживается в плазме крови в интервале 24–48 часов после введения независимо от состояния функции почек3.
* Нуклеотиды возвращаются в депо печени или выводятся с желчью.
-
-

Печень
-
Таргетная доставка инклизирана в печень посредством захвата ASGPR в течение 8 часов после введения3.
-
В гепатоцитах инклизиран предотвращает трансляцию мРНК PCSK9 посредством РНК-интерференции3.
-
Сопровождающая и направляющие цепи инклизирана подвергаются медленной деградации экзонуклеазами3.
-
Не оказывает эффекта на основные изоформы цитохрома P450 (CYP450) или молекулы-транспортеры, и, следовательно, ожидается, что препарат не будет вызывать лекарственных взаимодействий, и на него не будут влиять ингибиторы или индукторы ферментов CYP450 или транспортеры3,7.
-
-
Почки
-
Почки — главный орган элиминации инклизирана3.
-
Концентрации инклизирана также обнаруживаются в почках, но они в 2–5 раз ниже, чем в печени3.
-
16% инклизирана выводится через почки, и его конечный период полувыведения около 9 часов7.
-
Оценка безопасности
К концу 2019 года завершились три исследования III фазы c одинаковым дизайном, но разным контингентом7:
-
ORION-9 — пациенты с семейной гетерозиготной гиперхолестеринемией;
-
ORION-10 — больные с заболеваниями, обусловленными атеросклерозом;
-
ORION-11 — пациенты с состояниями, которые по риску ССО приравниваются к сердечно-сосудистым.
Прочие критерии включения были одинаковыми: уровень ЛПНП более 70 мг/дл, несмотря на максимально переносимую дозу статинов или на фоне непереносимости статинов.
На научной сессии АСС 2020 года были доложены результаты объединенного анализа всех трех исследований7. Анализ показал, что к 510 дню терапии уровень ЛПНП в группе инклизирана снизился на 51%, в группе плацебо увеличился на 4% (p < 0,0001). На фоне лечения инклизираном не было зарегистрировано увеличения частоты серьезных побочных эффектов, в том числе — со стороны мышц, почек и печени.
Заранее запланированный предварительный («разведочный», exploratory) анализ частоты сердечно-сосудистых осложнений показал, что в группе инклизирана она была ниже (7,1% vs 9,4%).
В настоящее время начат набор в исследование III фазы, в котором первичной конечной точкой будет являться частота сердечно-сосудистых осложнений. Завершение исследования ожидается к 2024 году.
Основные параметры профиля безопасности:
-
Не ожидаются лекарственные взаимодействия3.
-
Совместное применение с аторвастатином не было связано с увеличением токсичности*1.
-
Отсутствуют дозолимитирующие токсические эффекты*7.
-
Не является генотоксичным или канцерогенным*3,7.
-
Ненаправленные действия не наблюдались*3.
-
Не оказывает влияния на фертильность или эмбриональное развитие*3.
-
Не требуется коррекция дозы для пациентов с нарушениями функций печени и почек7.
-
Нежелательные явления в сравнении с плацебо — клинически значимые реакции в месте инъекции включали боль, эритему и сыпь примерно у 5% участников1.
* Испытание проводилось in vitro или с применением животных моделей.
Список источников:
- Wang N. et al. Circ Res. 2017;120:1063-1065; 2. Fitzgerald K. et al. N Engl J Med. 2017;376:41-51.
- Неопубликованные данные. Инклизиран. Брошюра исследователя. «Новартис Фармасьютиклз Корпорейшн», 2018 г.
- Khorova A. et al. N Engl J Med. 2017;376:4-7.
- Springer A.D. et al. Nucleic Acid Ther. 2018;28:109-118.
- Tsouka A.N. et al. Curr Pharm Des. 2018;24:3622-3633.
- Неопубликованные данные. Инклизиран. Базовая информация о препарате. «Новартис Фармасьютиклз Корпорейшн», 2020 г.
- URL: https://cardioweb.ru/news/item/2115-inkliziran-snizhaet-lpnp-vdvoe-u-patsientov-vsekh-osnovnykh-kategorij-nuzhdayushchikhsya-v-gipolipidemicheskoj-terapii-ob-edinennyj-analiz-rezultatov-issledovanij-orion-9-orion-10-orion-11 (актуализация на 5.12.2020 год).
