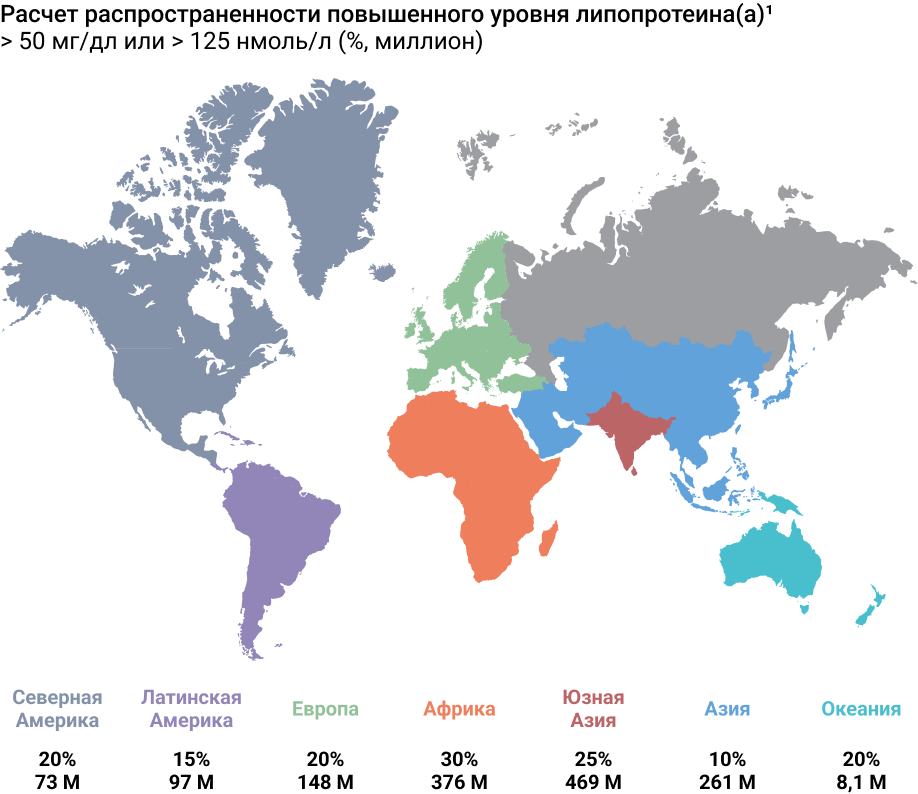
Эпидемиологические и генетические исследования выявили прямую связь между повышенным уровнем липопротеина(а) и риском развития АССЗ12–15. В мире у каждого 5 человека наблюдается повышенный уровень липопротеина(а)16, 17.
Сегодня можно говорить о том, что повышенный уровень липопротеина(а) – гиперлипопротеинемия(а) – является наиболее распространенным генетически обусловленным липидным нарушением, встречающимся примерно у 20% популяции, что составляет около 1,4 млрд человек во всем мире1. Гиперлипопротеинемия(а) также является одним из наиболее очевидных факторов риска сердечно-сосудистых осложнений у больных, достигших целевых уровней холестерина ЛНП (ХС ЛНП) на лекарственной терапии с использованием различных классов гиполипидемических препаратов3–5.
Результаты исследования INTERHEART показали, что медиана концентраций липопротеина(a) является самой высокой (27,2 мг/дл) у лиц африканского происхождения и самой низкой (7,8 мг/дл) у лиц китайского происхождения9. Уровни липопротеина(a) варьируют в зависимости от этнической принадлежности, что частично объясняется генетическими различиями между этническими группами10.
По данным исследования ЭССЕ-РФ, опубликованном в 2019 году и целью которого являлось изучение распределения липопротеина(a) в российской популяции и его ассоциаций с факторами риска ССЗ, средний уровень липопротеина(a) в российской популяции был в целом выше, чем в Европе. Объектом многоцентрового эпидемиологического исследования (Эпидемиология сердечно-сосудистых заболеваний в различных регионах Российской Федерации — ЭССЕ–РФ) были представительные выборки из неорганизованного мужского и женского населения в возрасте от 25–64 лет из 6 регионов РФ, в которых выполнено определение уровня липопротеина(a) в сыворотке крови. В анализ включили 10332 человек (3732 мужчин и 6600 женщин). В изучаемой выборке были построены кривые распределения липопротеина(a). Ассоциации липопротеина(a) изучались в зависимости от пола, возраста, уровня образования, который оценивали по категориям: ниже среднего, среднее и выше среднего; в зависимости от места проживания — город или сельская местность, статуса курения18.
У женщин уровень липопротеина(a) в крови на 12% был выше, чем у мужчин (95%ДИ 8–16%), и у больных с сахарным диабетом (СД) на 11% ниже по сравнению с лицами без СД18.
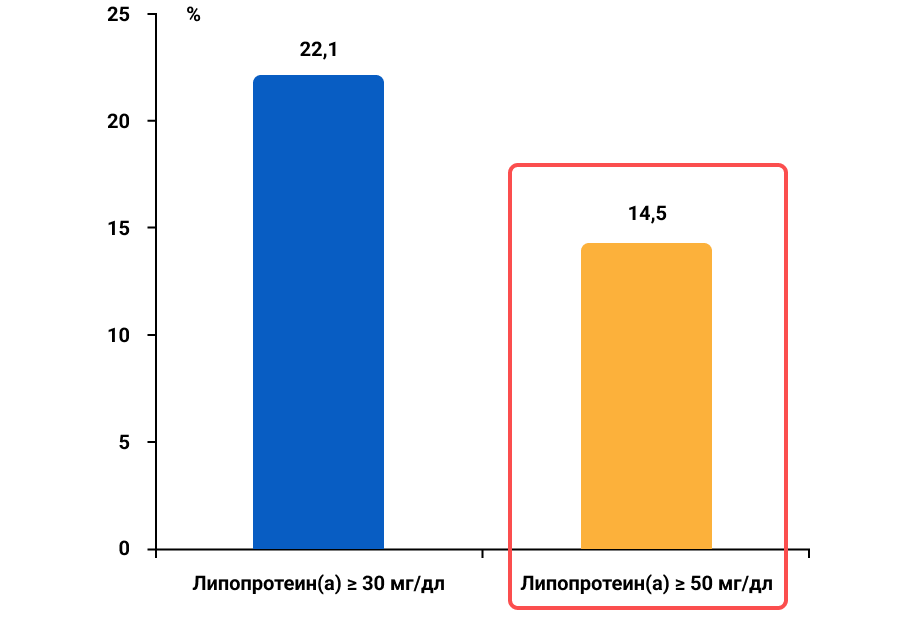
В 2023 г были опубликованы результаты многоцентрового перекрестного эпидемиологического исследования HERITAGE по оценке распространенности высокого уровня липопротеина(а) у пациентов с диагностированным АССЗ, в котором приняло участие 48 363 пациента с АССЗ из 48 стран мира. Было установлено, что уровень липопротеина(а) и ХС ЛНП был выше у женщин, чем у мужчин; у пациентов негроидной расы уровень липопротеина(а) был существенно выше (примерно в 3 раза), чем у пациентов европеоидной расы, испанцев или пациентов монголоидной расы; медиана уровня ХС ЛНП повышалась по мере повышения уровня липопротеина(а). Также было показано, что доля пациентов с АССЗ и уровнем липопротеина(а) ≥ 50 мг/дл составила 27,9%, доля пациентов с АССЗ и уровнем липопротеина(а) ≥ 70 мг/дл — 20,7%; доля пациентов с АССЗ и уровнем липопротеина(а) ≥ 90 мг/дл — 12,9%11.
Список литературы
- Tsimikas S, Fazio S, Ferdinand KC, et al. Recommendations to Reduce Lipoprotein(a)-Mediated Risk of Cardiovascular Disease and Aortic Stenosis. J Am Coll Cardiol. 2018;71(2):177–92. doi: 10.1016/j.jacc.2017.11.014;
- Afanasieva OI, Pokrovsky SN. Hyperlipoproteinemia(a) as a dangerous genetically determined violation of lipid metabolism and risk factor of atherothrombosis and cardiovascular diseases. Russian Journal of Cardiology 2019;24(5):101–8. Russian (Афанасьева ОИ, Покровский СН. Гиперлипопротеидемия(а) как опасное генетически обусловленное нарушение липидного обмена и фактор риска атеротромбоза и сердечно-сосудистых заболеваний. Российский кардиологический журнал. 2019;24(5):101–108);
- Willeit P, Ridker PM, Nestel PJ, et al. Baseline and on-statin treatment lipoprotein(a);
- levels for prediction of cardiovascular events: individual patient-data meta-analysis of statin outcome trials. Lancet 2018;392(10155):1311–20;
- O'Donoghue ML, Fazio S, Giugliano RP, Stroes ESG, et al Lipoprotein(a), PCSK9 Inhibition, and Cardiovascular Risk. Circulation. 2019;139(12):1483–92;
- Bittner VA, Szarek M, Aylward PE, et al. ODYSSEY OUTCOMES Committees and Investigators. Effect of Alirocumab on Lipoprotein(a) and Cardiovascular Risk After Acute Coronary Syndrome. J Am Coll Cardiol.2020;75(2):133–44;
- Sultan SM, Schupf N, Dowling MM, et al. Review of lipid and lipoprotein(a) abnormalities in childhood arterial ischemic stroke. Int J Stroke. 2014;9(1):79–87;
- Kamstrup PR, Benn M, Tybjaerg-Hansen A, Nordestgaard BG. Extreme lipoprotein(a) levels and risk of myocardial infarction in the general population: the Copenhagen City Heart Study. Circulation. 2008;117(2):176–84;
- Paré G, Caku A, McQueen M et al. Lipoprotein(a) Levels and the Risk of Myocardial Infarction Among 7 Ethnic Groups. Circulation 2019;139(12):1472–1482;
- Enkhmaa B, et al. Lipoprotein (a): impact by ethnicity and environmental and medical conditions. J Lipid Res. 2016;57(7):1111–1125;
- Nissen SE, Wolski K,Cho L, et al. Lipoprotein(a) levels in a global population with established atherosclerotic cardiovascular disease. Open Heart 2022;9:e002060.doi:10.1136/openhrt-2022–002060.
- Tsimikas S. J Am Coll Cardiol. 2017;69:692–711.
- Erqou S, et al. JAMA. 2009;302:412–423.
- Kamstrup PR, et al. JAMA. 2009;301:2331–2339.
- Clarke R, et al. N Engl J Med. 2009;361:2518–2528.
- Tsimikas S, et al. J Am Coll Cardiol. 2018;71(2):177–192.
- Tsimikas S, Stroes ESG. Atherosclerosis. 2020;300:1–9.
- Ezhov MV et al. Arch Med Sci 2021. doi:10.5114/aoms/131089
- Study Details | Assessing the Impact of Lipoprotein (a) Lowering with Pelacarsen (TQJ230) on Major Cardiovascular Events in Patients with CVD | ClinicalTrials.gov
- Plakogiannis R, Sorbera M, Fischetti B, Chen M. The Role of Antisense Therapies Targeting Lipoprotein(a). J Cardiovasc Pharmacol. 2021 Jul 1;78(1): e5-e11. doi: 10.1097/FJC.0000000000001045
- Viney NJ, van Capelleveen JC, Geary RS, et al. Antisense oligonucleotides targeting apolipoprotein(a) in people with raised lipoprotein(a): two randomized, double-blind, placebo-controlled, dose-ranging trials. Lancet 2016; 388:2239–2253.
- Nissen SE, Wolski K, Cho L, et al. Lipoprotein(a) levelsin a global population with established atherosclerotic cardiovascular disease. Open Heart 2022;9: e002060. doi:10.1136/openhrt-2022–002060
11233566/Pelac/Dig/07.24/0