Классификация апластических анемий (АА)1


Апластическая анемия2–7
Апластическая анемия (АА) — заболевание системы крови, характеризующееся панцитопенией, обусловленной аплазией костного мозга, связанной с нарушением иммунных механизмов регуляции кроветворения, количественным дефицитом и функциональными дефектами стволовой кроветворной клетки (СККк)2.
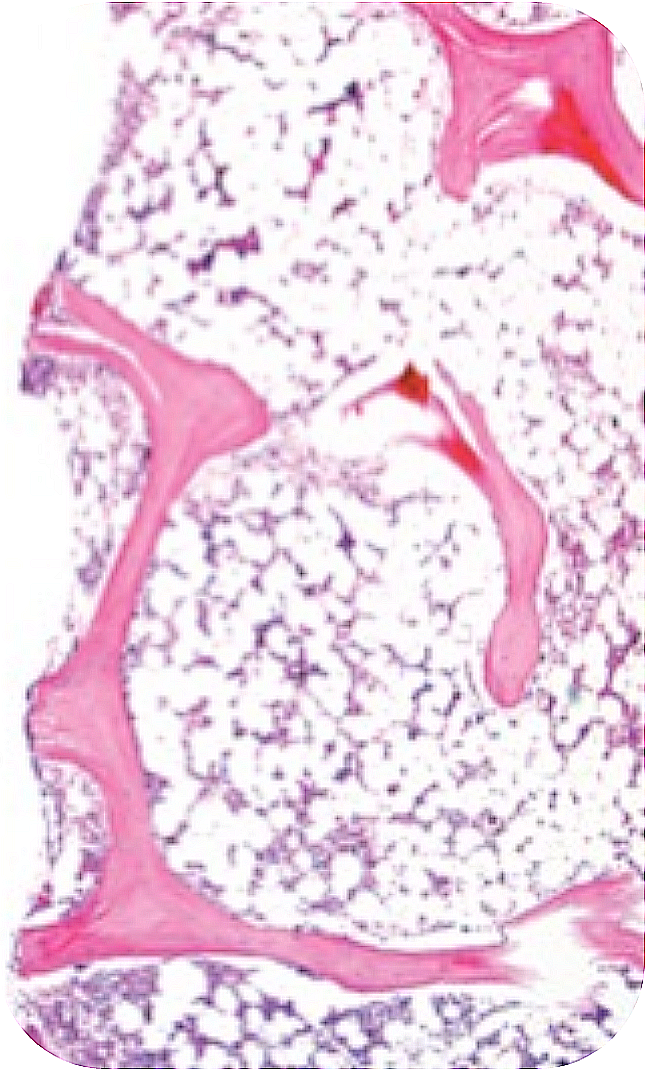
-
Панцитопения (не всегда сразу, возможен дебют с монолинейной цитопении)2.
-
Малоклеточный КМ (глубокий дефицит стволовых кроветворных клеток вследствие иммунноопосредованной атаки)2.
-
Нет тестов, обеспечивающих точную диагностику АА; АА — диагноз исключения5.
-
Высокая смертность: > 70% при проведении только поддерживающей терапии3,4.
Примечание.
* Рисунок из Olnes M.J. et al. N Engl J Med 2012;367:11–19.
Эпидемиология заболевания
-
Хотя АА может возникать в любом возрасте, однако наблюдается двухфазное распределение заболеваемости с пиками в двух возрастных группах8:
-
в возрасте от 10 до 25 лет;
-
старше 60 лет.
-
-
Ежегодная заболеваемость АА в Европе и Северной Америке составляет ~ 2 случая на миллион, в Восточной Азии она в 2–3 раза выше9.
-
Провоцирующий фактор определяется в ~ 10–15% случаев10:
-
например, химиотерапия или инфекции (включая вирусы гепатита).
-
-
Примерно в 70% случаев АА является идиопатической10.
-
Масштабные эпидемиологические исследования АА в России отсутствуют.
Эпидемиология АА (Швеция, Испания)11,12
| Ретроспективное исследование, Швеция11, 2000–2011, n = 257 | Проспективное исследование, Барселона12, 1980–2003, n = 235 | |
| Заболеваемость (новых случаев на 1 млн населения в год) | 2,35 (95% CI: 2,06–2,64) | 2,34 (95% CI: 2,06–2,66) |
| Медиана возраста на момент установления диагноза, годы | 60 | 53 |
| Степень тяжести |
|
|
| Пики заболеваемости |
|
|
Примечание.
НТАА — нетяжелая апластическая анемия; ТАА — тяжелая апластическая анемия; СТАА — среднетяжелая апластическая анемия.
Приобретенная апластическая анемия: этиология
-
Считается, что приобретенная (идиопатическая) АА возникает в результате опосредованной T-лимфоцитами аутоиммунной атаки ГСК13.
-
Аутоиммунный генез АА убедительно подтверждается эффективностью иммуносупрессии при данном заболевании13.
-
-
Некоторые лекарственные препараты могут выступать в роли триггерных факторов развития АА14.
-
Однако они обеспечивают лишь малую часть случаев приобретенной АА13.
-
-
Также АА может возникать после эпизода серонегативного гепатита (A, B или C)13,15.
-
Составляет ~ 5–10% от всех случаев АА13.
-
Приобретенная апластическая анемия: клинические проявления
Петехиальная сыпь
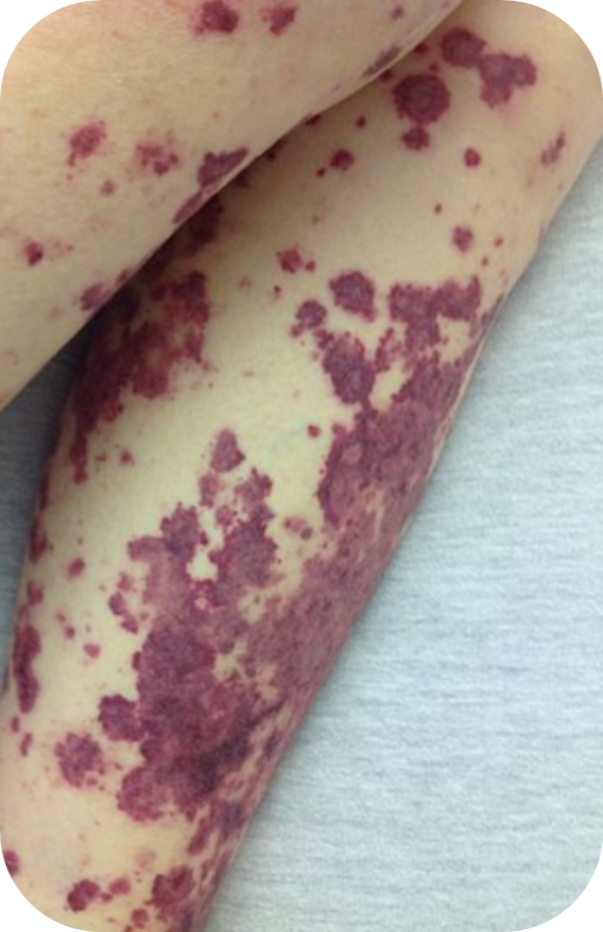
-
Симптомы АА могут возникать как внезапно (за несколько дней), так и в течение недель либо месяцев14.
-
Часто встречаются следующие симптомы:
-
Симптомы анемии вследствие снижения числа эритроцитов8 и уменьшения доставки кислорода в ткани15:
-
—Повышенная утомляемость, одышка при физической нагрузке14.
-
-
Кровоизлияния в кожу или слизистые вследствие снижения числа тромбоцитов8:
-
—Склонность к появлению кровоподтеков14.
-
—Петехии (красные или пурпурные пятна на коже)14.
-
—Кровотечения из десен14.
-
—Носовые кровотечения14.
-
-
Зрительные расстройства в результате кровоизлияний в сетчатку8.
-
Примечание.
Image: http://commons.wikimedia.org/wiki/File:petechial_rash.jpg. Ссылка активна на 8 июля 2020 года.
Патологический иммунный ответ, направленный против гемопоэтических стволовых клеток костного мозга
-
В крови и костном мозге пациентов с АА содержится повышенное количество активированных T-клеток16,17.
-
Активированные T-клетки вырабатывают лимфокины, включая:
-
Интерферон гамма (IFN-γ)14,17;
-
Фактор некроза опухоли (ФНО)14,17;
-
Интерлейкин-2 (IL-2)17.
-
-
IFN-γ и ФНО увеличивают количество рецепторов друг к другу, а также индуцируют экспрессию Fas-рецептора на клетках CD34+14,17.
-
Увеличение продукции IL-2 сопровождается поликлональной экспансией T-лимфоцитов17.
Апластическая анемия (ТАА) возникает в результате иммуноопосредованного разрушения костного мозга18
Цитотоксические T-клетки секретируют цитокины IFN-γ, ФНО-α, которые атакуют гемопоэтические стволовые клетки (ГСК) и прогениторные клетки18.
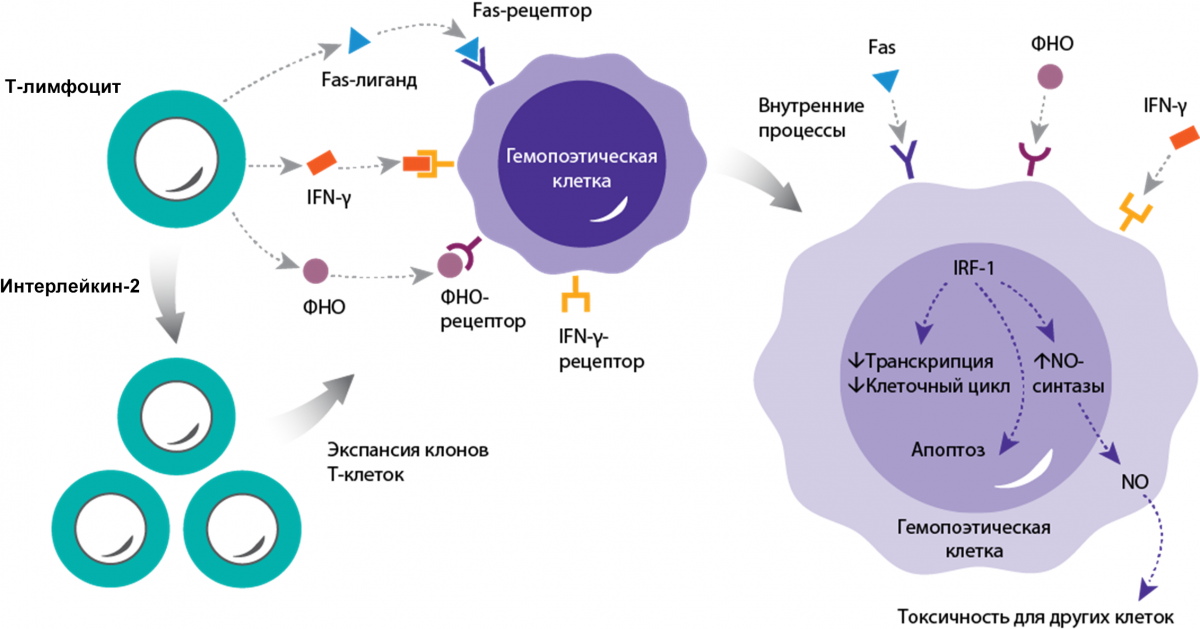
Опосредованная Т-клетками иммунная атака приводит к деструкции костного мозга и недостаточности гемопоэза18
Здоровый (слева) и апластический костный мозг (справа).
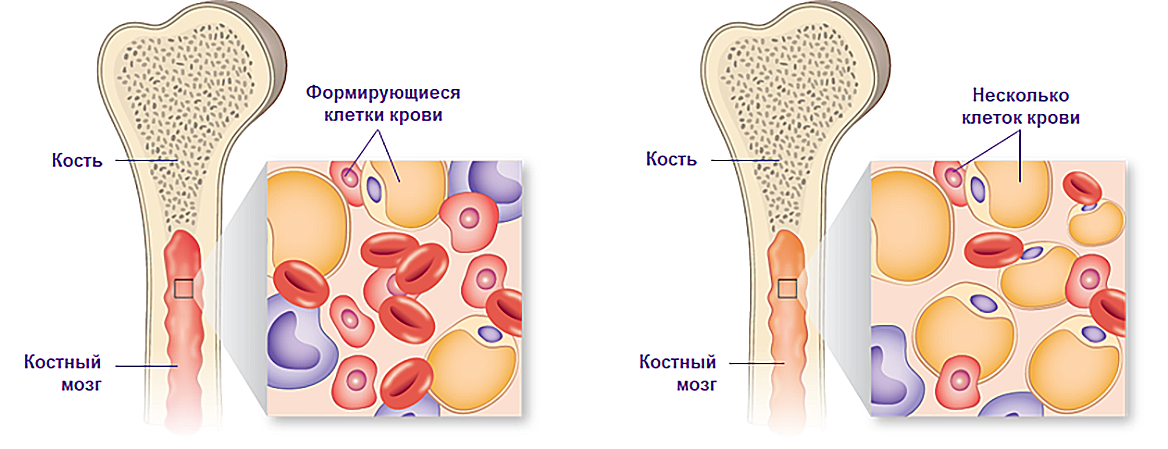
Примечание.
Иллюстрация адаптирована из: Медицинский центр Университета Миннесоты, Фэрвью. https://www.mhealth.org/patient-education/40317 по состоянию на 10.07.20.
Естественное течение приобретенной апластической анемии
-
Обычно пациенты обращаются за медицинской помощью в связи с появлением симптомов анемии либо кровотечений19.
-
Даже в случае наличия тяжелой нейтропении инфекции редко служат начальным проявлением заболевания.
-
Исходное снижение количества клеток крови может быть связано с одним типом клеток (цитопения одной линии клеток крови).
-
—Часто наблюдается изолированная тромбоцитопения либо анемия.
-
-
-
Активированные T-клетки вырабатывают лимфокины, включая:
-
Хорошо известным осложнением ТАА является возникновение цитогенетических нарушений в ГСК (процесс, называемый также клональной эволюцией)20.
-
Обычно пациенты обращаются за медицинской помощью в связи с появлением симптомов анемии либо кровотечений20.
-
ТАА может прогрессировать в миелодиспластический синдром (МДС) или лейкемию с частотой ~ 10–20% за 5–10 лет19–21;
-
Эволюция в МДС может происходить как на ранних, так и на поздних стадиях АА20.
-
-
У пациентов с ТАА наличие цитогенетических аномалий ухудшает прогноз по сравнению с их отсутствием19.
-
Нелеченная тяжелая панцитопения приводит к смерти пациентов в течение 1 года после постановки диагноза2.
Диагностика приобретенной АА
-
У всех новых пациентов с симптомами приобретенной АА необходимо22:
-
Подтвердить диагноз и исключить другие возможные причины панцитопении и гипоцеллюлярного костного мозга;
-
Классифицировать тяжесть заболевания с использованием критериев для показателей крови и костного мозга;
-
Документировать наличие сопутствующей пароксизмальной ночной гемоглобинурии (ПНГ) и цитогенетических клонов;
-
Исключить позднее развитие врожденных синдромов недостаточности костного мозга.
-
-
Диагноз часто устанавливается после того, как пациенты обращаются за медицинской помощью по поводу симптомов анемии или кровотечений, возникающих на фоне нарастания панцитопении и недостаточности ГСК19.
-
Диагноз приобретенной АА устанавливается путем исключения23.
-
У некоторых пациентов показатели клинического анализа крови могут оставаться стабильными в течение многих лет с отсутствием симптоматики14.
Дифференциальная диагностика панцитопении
-
Отсутствует единый метод, который позволил бы надежно установить диагноз приобретенной (идиопатической) АА23.
-
Однако повышение настороженности в отношении данного заболевания и эволюция диагностических методов, включая перечисленные ниже, облегчают диагностику других заболеваний, которые могут вызывать панцитопению23:
-
Генетический анализ;
-
Стандартный цитогенетический анализ;
-
Серологические исследования;
-
Инновационные диагностические алгоритмы.
-
-
Диагноз приобретенной АА устанавливается путем исключения23.
-
Высокочувствительные серологические методы обладают высокой ценностью для дифференциальной диагностики следующих заболеваний13:
-
ПНГ13;
-
МДС13.
-
Алгоритм диагностики и выбора метода лечения больных АА24
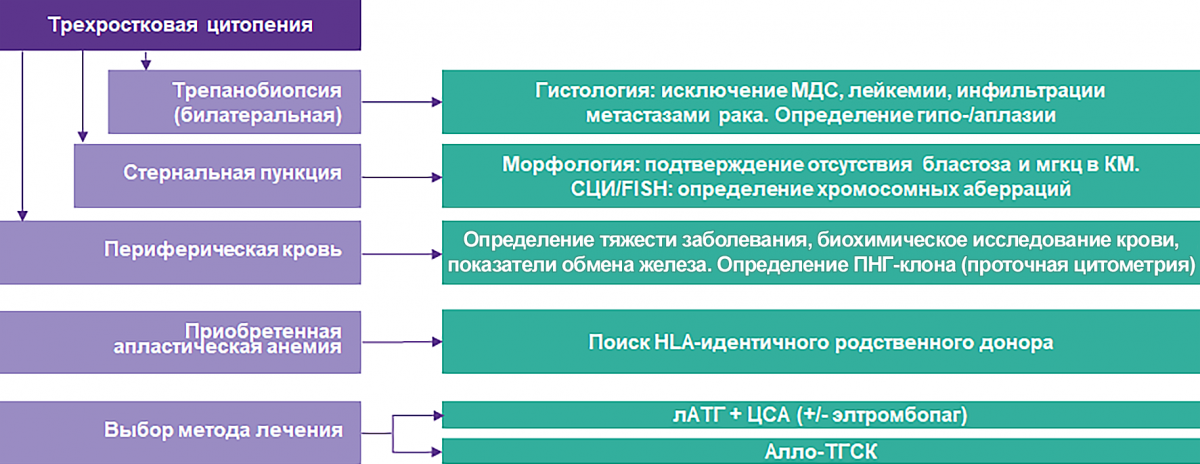
Диагностические критерии АА, рекомендации НГО7
Диагноз апластической анемии устанавливается на основании клинических проявлений болезни и данных лабораторного обследования.
| Трехростковая цитопения |
|
| Стернальная пункция |
|
| Билатеральная трепанобиопсия |
|
Классификация АА по степени тяжести, рекомендации НГО7
-
При определении тяжести АА учитываются результаты не менее трех анализов периферической крови на момент диагностики заболевания до начала лечения.
-
Рефрактерная АА диагностируется в случае отсутствия эффекта от комбинированной ИСТ через 6 месяцев от начала лечения или после второго курса АТГ.
| Нетяжелая |
|
| Тяжелая |
|
| Очень тяжелая |
|
Алгоритм лечения АА7,24
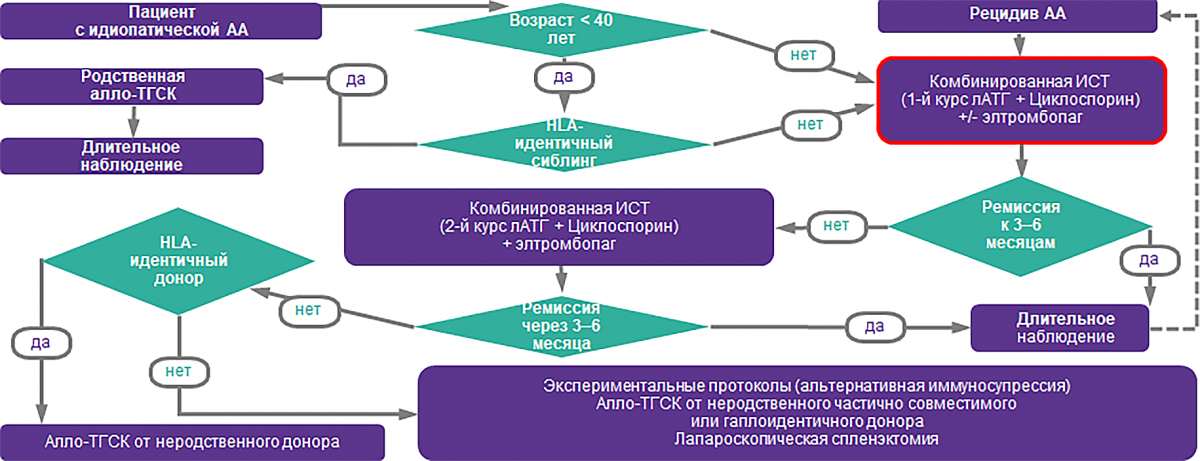
Проблемы терапии ТАА
-
HLA-совместимые доноры-сиблинги есть менее чем у 30% пациентов14.
-
Трансплантация сопровождается потенциально жизнеугрожающими осложнениями, включая реакцию «трансплантат против хозяина»14.
-
30% пациентов с ТАА не отвечают на стандартную ИСТ25.

-
~ 40% ответивших пациентов рецидивируют26.
Причиной неэффективности иммуносупрессивной терапии может быть доказанное снижение количества стволовых клеток и их неспособность воспроизвести гемопоэз в нужном объеме у пациентов с ТАА27,28.
Литературные источники:
- Алгоритмы диагностики и лечения заболеваний системы крови. Том 1, под ред. Савченко В.Г. «Практика», 2018, с. 215-216.
- Townsley D.M. et al. Int J Hematol 2013;98:48–55.
- Montané E. et al. Haematologica 2008;93:518–523.
- Camitta B.M. et al. Blood 1979;53:504–514.
- Killick S.B. et al. Br J Haematol 2016;172:187–207.
- DeZern A.E. & Sekeres M.A. Oncologist 2014;19:735–745.
- НГО, Клинические рекомендации по лечению апластической анемии (комбинированная иммуносупрессивная терапия), утверждены на IV Конгрессе гематологов России, апрель 2018.
- Marsh J.C.W. et al. Br J Haematol 2009;147:43.
- Scott A. Peslak et al. Diagnosis and Treatment of Aplastic Anemia. Curr Treat Options Oncol; 18(12): 70. doi:10.1007/s11864-017-0511-z.
- Dokal I. & Vulliamy T. Blood Reviews 2008; 22:141.
- Krista Vaht et al. Incidence And Outcome Of Acquired Aplastic Anemia—Real-World Data From Patients Diagnosed In Sweden From 2000–2011. Haematologica July 2017: haematol.2017.169862. Doi:10.3324/haematol.2017.169862.
- Eva Montané et al. Epidemiology Of Aplastic Anemia: A Prospective Multicenter Study. Haematologica April 2008 93: 518-523. Doi:10.3324/haematol.12020.
- Young N.S. Hematology Am Soc Hematol Educ Program 2006;72.
- Brodsky R.A. & Jones R.J. Lancet 2005;365:1647.
- Pallister C.J .& Watson M.S. In Haematology. Second edition, 3. 2011.
- Lu J. et al. Blood 2004;103:4588.
- Young N.S. & Maciejewski J. N Eng J Med 1997;336:1365.
- Neal S. Young, N Engl J Med 1997; 336:1365-1372.
- Scheinberg P. & Young N.S. Blood 2012;120:1185.
- Afable M.G. et al. Hematology Am Soc Hematol Educ Program 2011;90.
- Maciejewski J.P. & Selleri C. Leukaemia & Lymphoma; 2004:45:433.
- Marsh J.C.W .et al. Br J Haematol 2009;147:43.
- Guinan E.C. Hematology Am Soc Hematol Educ Program 2011:76.
- Михайлова Е.А. с соавт. Клинические рекомендации по диагностике и лечению апластической анемии (редакция 2019 г.). Гематология и трансфузиология. 2020; 65(2): 208–226.
- Desmond R. et al. Blood 2014;123:1818–1825.
- Scheinberg P. Current management of severe acquired aplastic anemia. Einstein (Sao Paulo). 2011;9(2):229-235.
- Young N.S. et al. Hematology Am Soc Hematol Educ Program 2013;76–81.
- Maciejewski J.P., Selleri C., Sato T., Anderson S., Young N.S. A severe and consistent deficit in marrow and circulating primitive hematopoietic cells (long‑term culture-initiating cells) in acquired aplastic anemia. Blood 1996; 88: 1983-91.
