
Чиж Григорий Алексеевич
химиотерапевт, выпускник Высшей школы онкологии, автор телеграм-канала «Очерки фундаментальной онкологии»
Амплификации гена ERBB2 (HER2) — всегда ли это HER2-enriched? Это может прозвучать странно, но амплификация гена ERBB2/HER2 не делает опухоль автоматически заболеванием HER2-enriched, о чем свидетельствует работа Anneleen Daemen & Gerard Manning, опубликованная в 2018 году [1]. Авторы и вовсе выражают позицию о том, что амплификация HER2 не является достаточным основанием для отнесения конкретного случая заболевания рака молочной железы к HER2-enriched-подтипу в плоскости классификации РАМ50. Аргументом в пользу этого выступают представленные результаты полногеномного анализа свыше 3000 тысяч образцов из базы TCGA, Metabric и USO1062 [2–4].:
Ключевые моменты:
- Амплификация гена HER2 может быть атрибутом любого биологического подтипа рака молочной железы.

Количество и процент опухолей с амплифицированным рецептором эпидермального фактора роста 2 (HER2A) в прогнозном анализе подтипов микрочипов 50 (PAM50) в Атласе генома рака (TCGA), Metabric и клиническом исследовании USO1062.
- Лишь 47% HER2-enriched-опухолей демонстрировали амплификацию HER2.
Амплификация гена HER2 выступает как драйверное событие, но, по заключению авторов, оно не является строго специфичным атрибутом подтипа HER2-enriched. Все оказывается сложнее.
Что на самом деле представляет из себя HER2-enriched и что он в себе скрывает
Давайте же тогда сформулируем, в контексте изложенных данных, что такое HER2-enriched-рак молочной железы. Это те случаи заболевания рака молочной железы, в которых наблюдается определенный паттерн (совокупность) генетических нарушений, связанных с амплификацией генов длинного плеча 17-й хромосомы [5]. Т. е. речь о строго специфическом сочетании экспрессии конкретного набора генов, а именно [6]:
- высокая экспрессия генов ERBB2 (HER2), GRB7, BLVRA, FGFR4;
- умеренная экспрессия BAG1, CDC20, CCNE1;
- низкая экспрессия генов ACTR3B, MYC, SFRP1.
Проиллюстрируем роль каждого гена c высокой экспрессией в HER2-enriched в жизни клетки — клинической значимости в этом гораздо больше, чем вам может показаться.
- GRB7 — Growth Factor Receptor Bound Protein 7 — протеин, опосредующий тирозинкиназа-ассоциированную активацию PLK1-сигнальных каскадов — АКТ/mTOR (приводящий к метаболическому перепрограммированию клетки и пролиферации), STAT3 (инвазия и метастазирование), FAK-опосредованной миграции клетки [7].
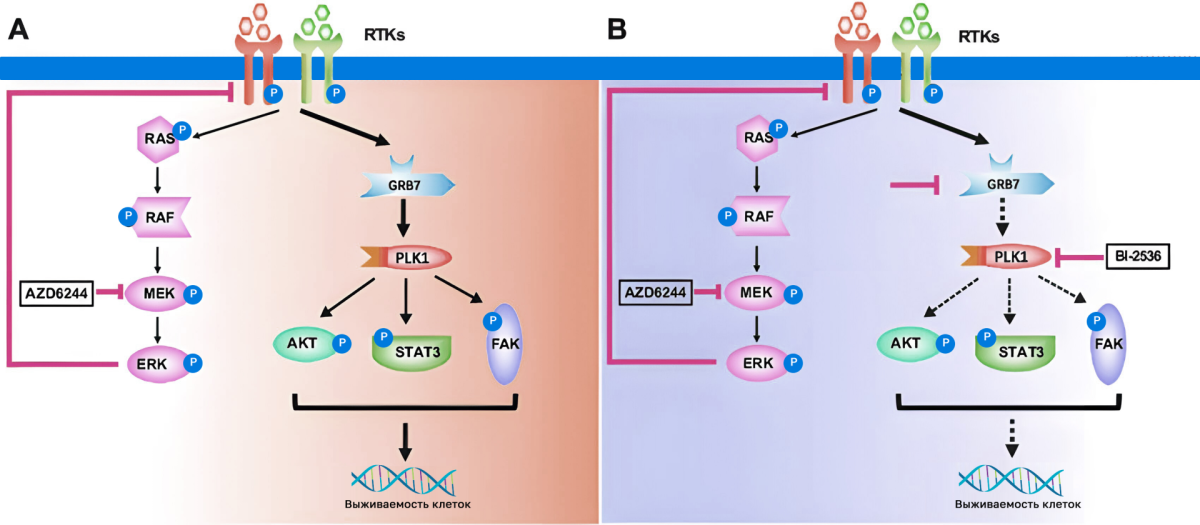
- BLVRA (биливердин-редуктаза А) — рассматривается как «катализатор» активации протоонкогенного Wnt/β-catenin-каскада, но о его терапевтическом потенциале и степени значимости в канцерогенезе рака молочной железы пока известно очень мало [8].
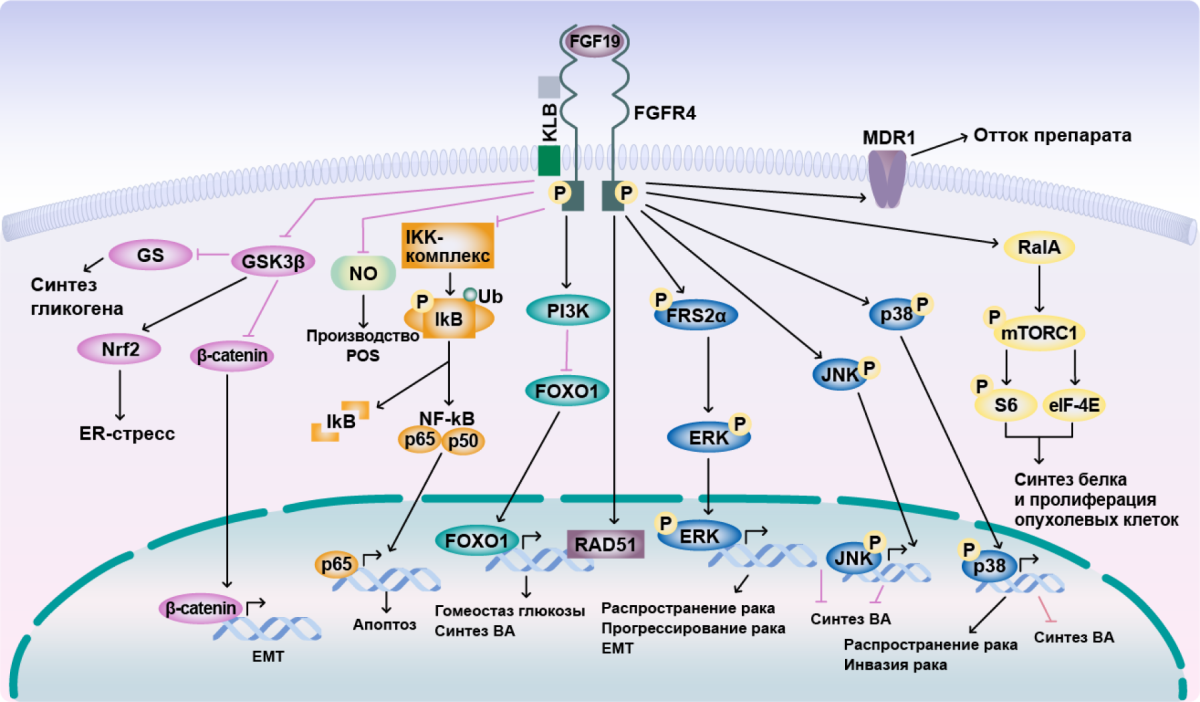
- FGFR4 — такой же белок, как HER2, только FGFR4 (fibroblast growth factor receptors).
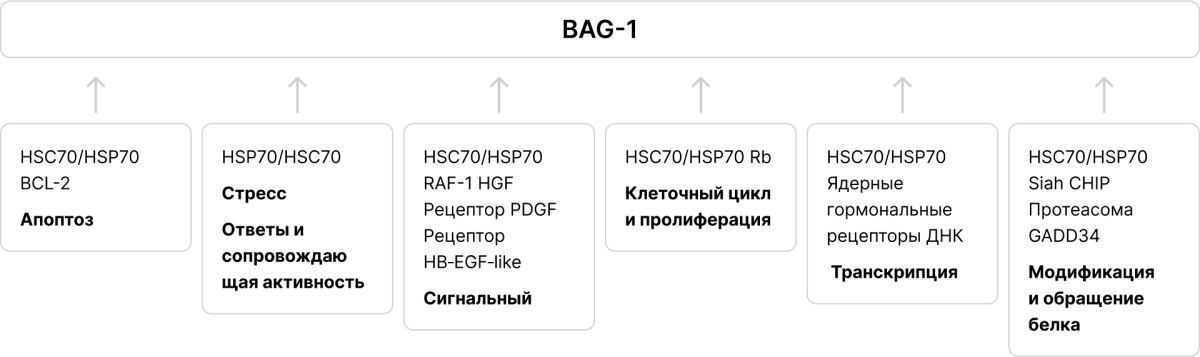
* Регулятор семейства шаперонов BAG1, который устраняет «баги», связанные с нарушениями функции шаперонов в клетке. BAG1 за счет тесного коннекта с шаперонами выступает как белок, реализующий огромное количество функций внутри клетки, направленных на выживание [9,10]:
- CDC20 разносторонне управляет клеточным циклом (преимущественно в митотическую фазу), в комплексе с АРС (adenomatous polyposis coli, который знаком многим по его роли в развитии колоректального рака) [11].
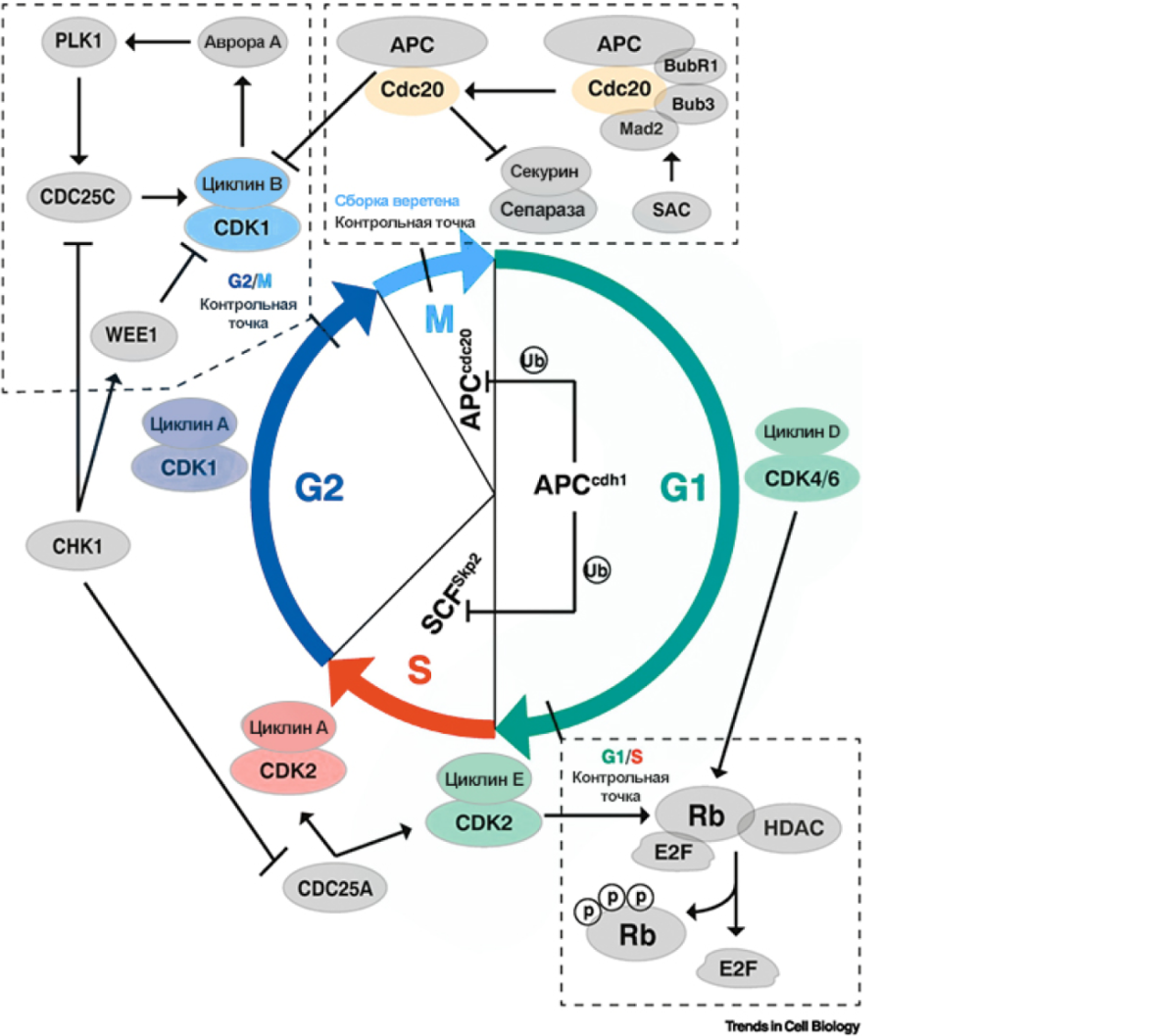
* CCNE1 — кодирует циклин Е. Этот белок проявляет себя в контексте регуляции клеточного цикла на этапе перехода из G1- в S-фазу [12].
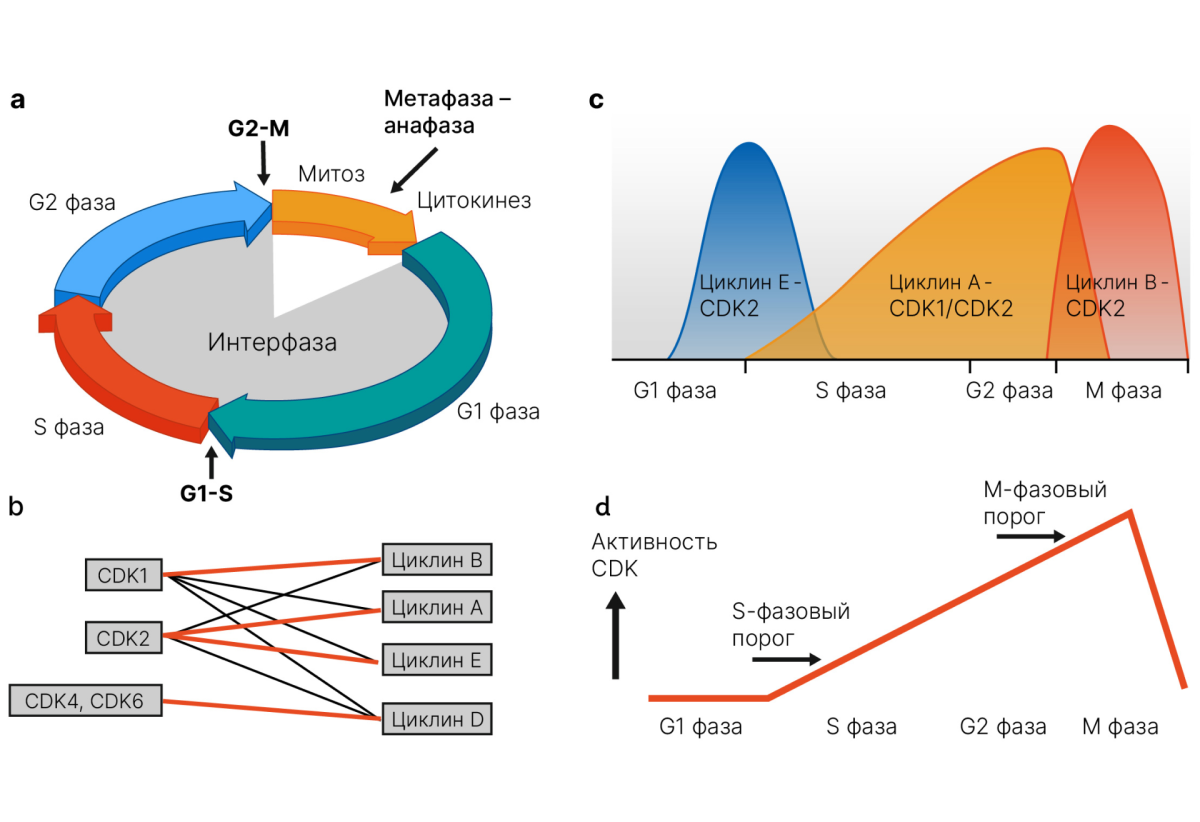
«На кой черт нам эти высокие молекулярные материи, если у нас нет РАМ50, зато на приеме 20 человек плюс комиссия?» — спросит кто-то.
- Понимание роли и патофизиологии представленных генетических нарушений дает представление о механизмах резистентности и обходных биохимических путях при таргетной анти-HER2-терапии.
В особенности это справедливо в отношении усиления сигналинга FGFR при HER2-терапии. А GRB7 рассматривается как один из предикторов устойчивости к химиотерапии антрациклинами и таксанами — препаратами, применяемыми при раннем раке молочной железы (несмотря на тенденцию отказа от антрациклинов в последние годы) [13–15].
- Понимание роли и патофизиологии представленных генетических нарушений дает представление о механизмах резистентности и обходных биохимических путях при гормонотерапии.
Как вы уже поняли, не всегда люминальный рак, определенный по иммуногистохимии, = люминальный рак по РАМ50 и по сути. Но при этом иммуногистохимическая картина люминального рака будет поводом для назначения гормонотерапии. Здесь уместно вспомнить о том, как ER-сигналинг способствует канцерогенезу при раке молочной железы. Посмотрите внимательнее и найдите с ходу потенциальный механизм резистентности:
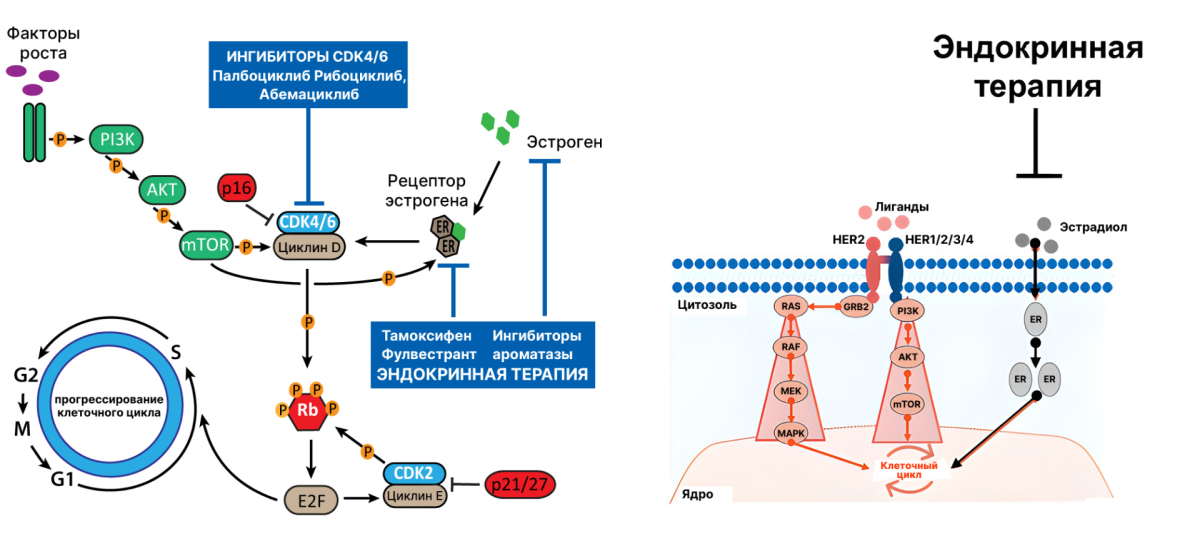
Применение одной только гормонотерапии не может предотвратить прогрессирование клеточного цикла, поскольку сигнальный путь, связанный с эстрогеновыми рецепторами, не является драйвером при подтипе HER2-E. И, как вы увидите дальше, назначение в условиях HER2-enriched гормонотерапии (ингибиторов ароматазы, тамоксифена и проч.) в монорежиме заранее обречено на провал — как с теоретической точки зрения, так и судя по имеющимся исследованиям [5].
Источники:
- Daemen A., Manning G. HER2 is not a cancer subtype but rather a pan-cancer event and is highly enriched in AR-driven breast tumors. Breast Cancer Res. 2018 Jan 30;20(1):8. doi: 10.1186/s13058-018-0933-y. PMID: 29382369; PMCID: PMC5791377.
- Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours. Nature. 2012 Oct 4;490(7418):61-70. doi: 10.1038/nature11412. Epub 2012 Sep 23. PMID: 23000897; PMCID: PMC3465532.
- Curtis C., Shah S.P., Chin S.F. et al. The genomic and transcriptomic architecture of 2,000 breast tumours reveals novel subgroups. Nature. 2012 Apr 18;486(7403):346-52. doi: 10.1038/nature10983. PMID: 22522925; PMCID: PMC3440846.
- Wilson T.R., Yu J., Lu X. et al. The molecular landscape of high-risk early breast cancer: comprehensive biomarker analysis of a phase III adjuvant population. NPJ Breast Cancer. 2016 Jul 13;2:16022. doi: 10.1038/npjbcancer.2016.22. PMID: 28721382; PMCID: PMC5515335.
- Bergamino M.A., López-Knowles E., Morani G. et al. POETIC investigators. HER2-enriched subtype and novel molecular subgroups drive aromatase inhibitor resistance and an increased risk of relapse in early ER+/HER2+ breast cancer. EBioMedicine. 2022 Sep;83:104205. doi: 10.1016/j.ebiom.2022.104205. Epub 2022 Aug 16. PMID: 35985932; PMCID: PMC9482930.
- Parker J.S., Mullins M., Cheang M.C. et al. Supervised risk predictor of breast cancer based on intrinsic subtypes. J Clin Oncol. 2009 Mar 10;27(8):1160-7. doi: 10.1200/JCO.2008.18.1370. Epub 2009 Feb 9. PMID: 19204204; PMCID: PMC2667820.
- Chu Pei-Yu, Yu-Ling Tai, Tang-Long Shen. 2019. "Grb7, a Critical Mediator of EGFR/ErbB Signaling, in Cancer Development and as a Potential Therapeutic Target" Cells 8, no. 5: 435. https://doi.org/10.3390/cells8050435
- Mao H., Xu Y., Zhang Z. et al. Biliverdin Reductase A (BLVRA) Promotes Colorectal Cancer Cell Progression by Activating the Wnt/β-Catenin Signaling Pathway. Cancer Manag Res. 2020 Apr 23;12:2697-2709. doi: 10.2147/CMAR.S242531. PMID: 32425592; PMCID: PMC7187560.
- Cutress R., Townsend P., Brimmell M. et al. BAG-1 expression and function in human cancer. Br J Cancer 87, 834–839 (2002). https://doi.org/10.1038/sj.bjc.6600538
- Townsend P.A., Stephanou A., Packham G., Latchman D.S. BAG-1: a multi-functional pro-survival molecule. Int J Biochem Cell Biol. 2005 Feb;37(2):251-9. doi: 10.1016/j.biocel.2004.03.016. PMID: 15474970.
- Wang Z., Wan L., Zhong J. et al. Cdc20: a potential novel therapeutic target for cancer treatment. Curr Pharm Des. 2013;19(18):3210-4. doi: 10.2174/1381612811319180005. PMID: 23151139; PMCID: PMC4014638.
- Hochegge H., Takeda S., Hunt T. Cyclin-dependent kinases and cell-cycle transitions: does one fit all?. Nat Rev Mol Cell Biol 9, 910–916 (2008). https://doi.org/10.1038/nrm2510
- Hanker A.B., Garrett J.T., Estrada M.V. et al. HER2-Overexpressing Breast Cancers Amplify FGFR Signaling upon Acquisition of Resistance to Dual Therapeutic Blockade of HER2. Clin Cancer Res. 2017 Aug 1;23(15):4323-4334. doi: 10.1158/1078-0432.CCR-16-2287. Epub 2017 Apr 5. Erratum in: Clin Cancer Res. 2019 Feb 15;25(4):1434. PMID: 28381415; PMCID: PMC5540793.
- Gaibar M., Novillo A., Romero-Lorca A. et al. FGFR1 Amplification and Response to Neoadjuvant Anti-HER2 Treatment in Early HER2-Positive Breast Cancer. Pharmaceutics. 2022 Jan 20;14(2):242. doi: 10.3390/pharmaceutics14020242. PMID: 35213975; PMCID: PMC8875219.
- van Ramshorst M.S., van der Voort A., van Werkhoven E.D. et al. Dutch Breast Cancer Research Group (BOOG). Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018 Dec;19(12):1630-1640. doi: 10.1016/S1470-2045(18)30570-9. Epub 2018 Nov 6. PMID: 30413379.
778504/web/gen/03.24/1

