
Чиж Григорий Алексеевич
химиотерапевт, выпускник Высшей школы онкологии, автор телеграм-канала «Очерки фундаментальной онкологии»
Рак молочной железы может вести себя совершенно по-разному. Несмотря на существование стандартов лечения данного заболевания, основанных на рандомизированных клинических исследованиях, одни пациентки после проведенного лечения живут долго и счастливо. В то время как другие, несмотря ни на что, сталкиваются с неуклонным прогрессированием заболевания. Бывает и так, что пациентки не спешат проходить лечение — по самым разным причинам, и в одних случаях мы видим медленное, индолентное течение заболевания, с которым пациентки живут годами, а в других — отсутствие лечения приводит к гибели чрезвычайно быстро, демонстрируя то, насколько быстротечна жизнь.
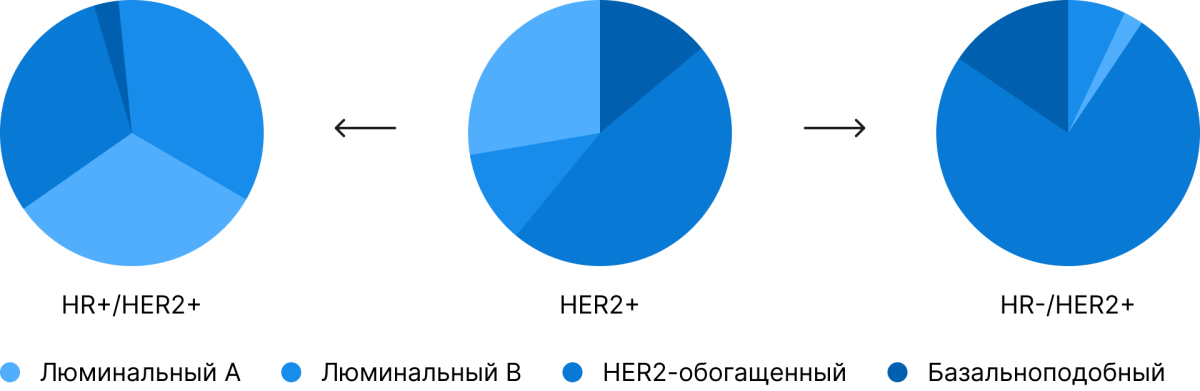
«Взглянуть» непосредственно на геном позволяет, к примеру, тестирование РАМ50 (Prediction Analysis of Microarray 50) [1]. Суть данного теста сводится к оценке экспрессии в клетке 50 генов, экспрессия которых в различных типах рака молочной железы различается. По сочетанию экспрессии конкретных генов делается заключение о принадлежности изучаемой опухоли к конкретному биологическому подтипу — люминальному, HER2-обогащенному или basal-like, который многими идентифицируются (пусть и не совсем корректно) как трижды негативный:
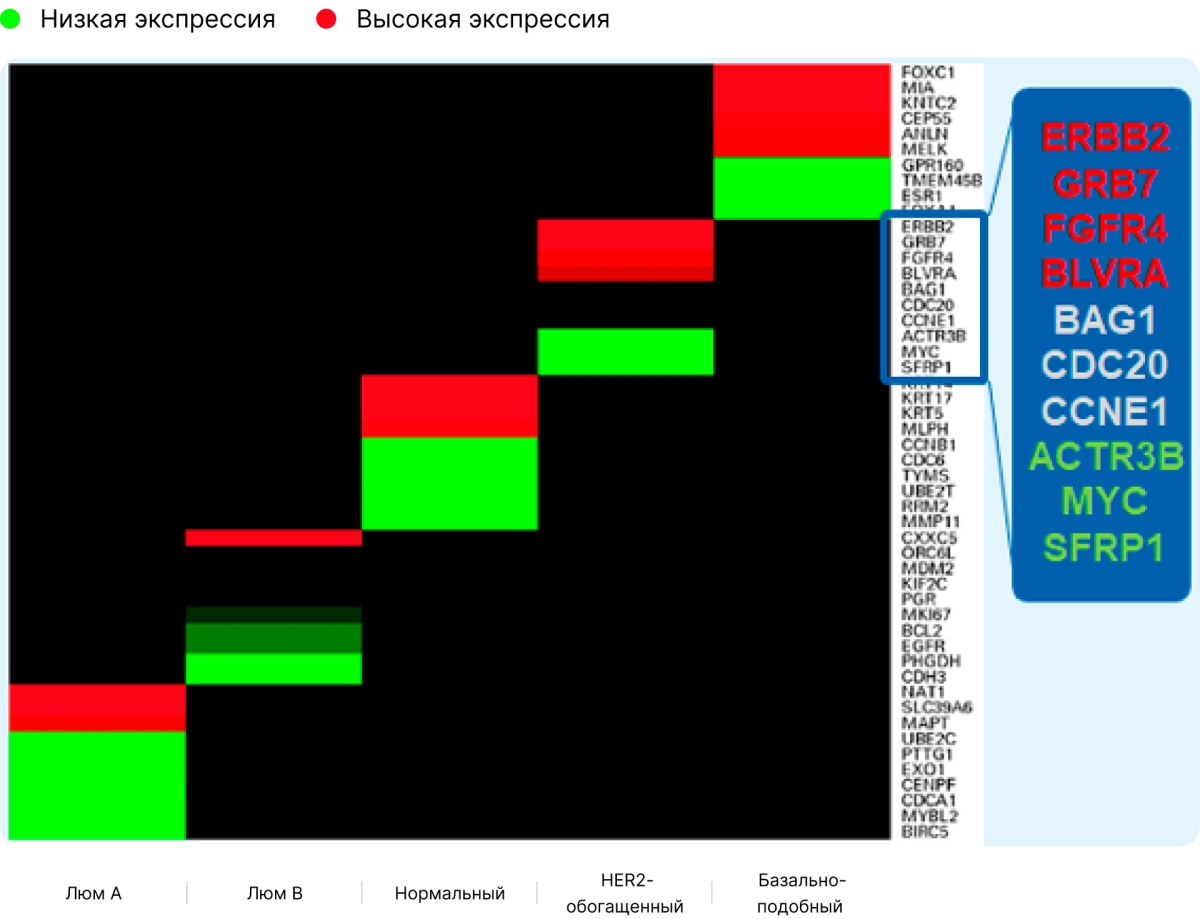
Почему важно упоминание о генетических тестированиях? Иммуногистохимическая картина не всегда может соответствовать биологии конкретной опухоли, что в ряде случаев приводит к некорректному назначению лекарственной терапии.
Несоответствие иммуногистохимической картины тому, что обнаруживалось по данным тестирования РАМ50, наблюдалось при осуществлении ретроспективного анализа (Edith A Perez) почти 1,4 тысячи опухолевых образцов, выполненного в рамках проспективного исследования N9831 North Central Cancer Treatment Group (Alliance) (химиотерапия ± трастузумаб в рамках адъювантной терапии раннего HER2+ РМЖ) [2,3].
Опухолевые образцы, полученные от пациенток, были классифицированы с помощью иммуногистохимического и/или FISH-исследования как HER2+ рак молочной железы. После рандомизации пациенток почти 1400 образцов подвергались молекулярно-генетическому тестированию РАМ50.
Их определение позволило более достоверно оценить выживаемость пациенток, получавших трастузумаб в рамках экспериментального лечения в адъювантном режиме. Так, для basal-like HER2-положительного рака молочной железы эффект от трастузумаба оказался менее выраженным и ярким, чем для общей популяции пациенток:
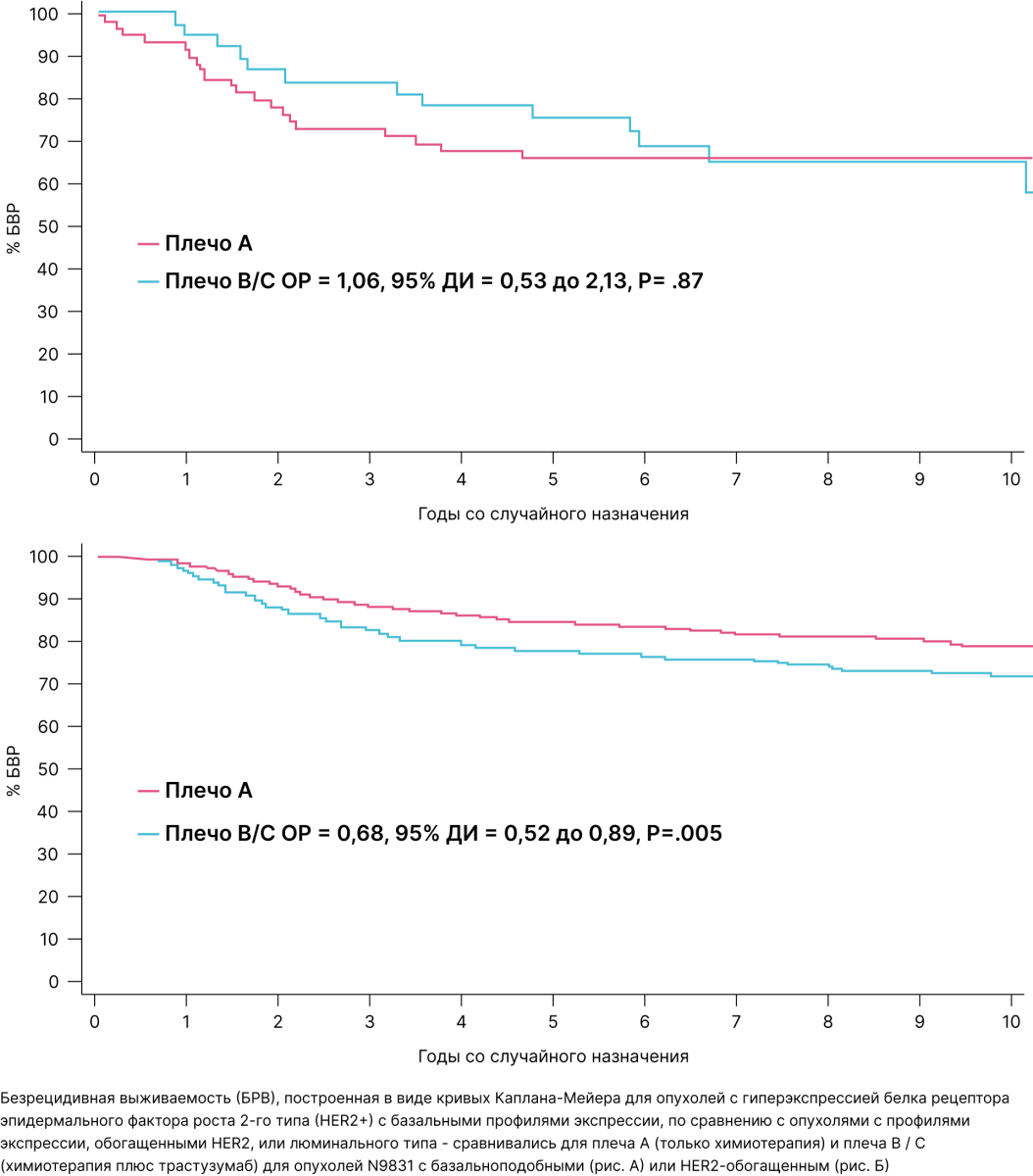
Справедливости ради стоит заметить, что это само по себе не говорит о том, что трастузумаб у данных пациенток неэффективен! Количество пациенток могло (и, скорее всего, так и получилось) быть слишком маленьким для достаточного количества неблагоприятных эвентов и получения статистически значимых различий в выживаемости. Однако это повод задуматься о необходимости более тщательного отбора пациенток в клинические исследования. Данный поданализ свидетельствует о рисках ложноотрицательных результатов при слепой вере иммуногистохимии и недооценке влияния внутреннего молекулярного подтипа опухоли.
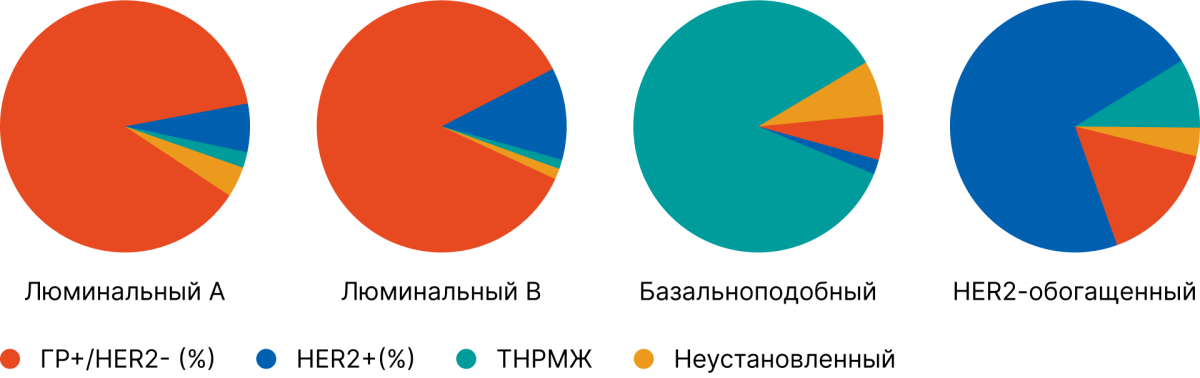
О несоответствии внутренних подтипов, определенных PAM50, тому, что видит иммуногистохимия (ИГХ) у пациенток с раком молочной железы, сообщали и Hee Kyung Kim et al. в 2019 году [6]. К ужасу авторов, у 233 пациенток (38,4%) обнаружено несоответствие между подтипом, выявленным на основе ИГХ, и внутренним подтипом PAM50:
- Среди 278 пациенток с HR+/HER2- нелюминальным A/B типом РМЖ, HER2-enriched по РАМ50 был обнаружен у 4% пациенток, базальноподобный — у 6%.
- Среди пациенток с HR-/HER2+ 26% были не HER2-enriched.
- Из 151 пациентки с верифицированным трижды негативным подтипом РМЖ у 2% был люминальный тип А (т. е. диаметрально противоположная опухоль по биологии и прогнозу), а у 13% — HER2-обогащенный тип.

Это значит, что 26% пациенток с HER2-положительным (по ИГХ или FISH) раком молочной железы по своей биологии, по набору экспрессируемых в них генах, могут быть вовсе не HER2-позитивными. В то время как у каждой десятой пациентки с трижды негативным либо люминальным HER-негативным раком молочной железы (верифицированным по ИГХ) биология опухоли соответствовала HER2-enriched, а значит, пациентки в данном случае могли бы получить пользу от таргетной анти-HER2-терапии.
О чем свидетельствуют представленные данные
HER2-положительный рак молочной железы, таким образом, это не столько про экспрессию HER2, определяемого по иммуногистохимии, сколько про набор молекулярно-генетических нарушений, ассоциированный с активной экспрессией в клетке гена ERBB2.
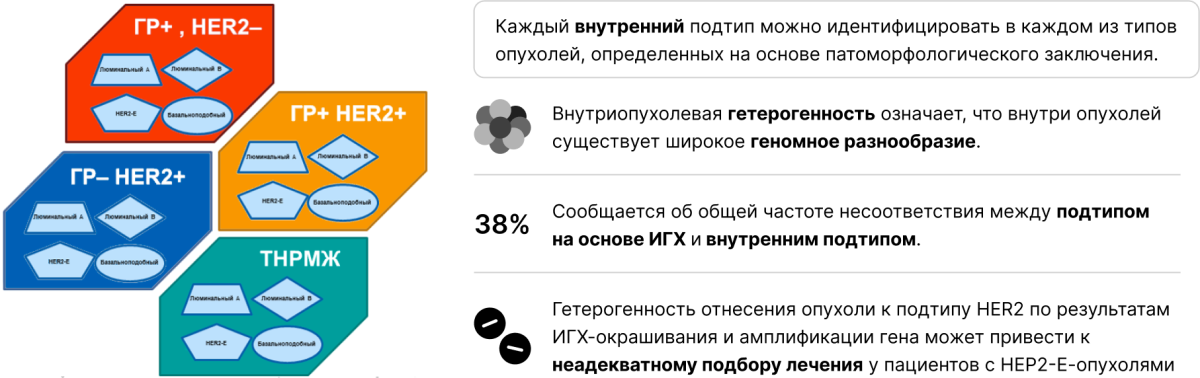
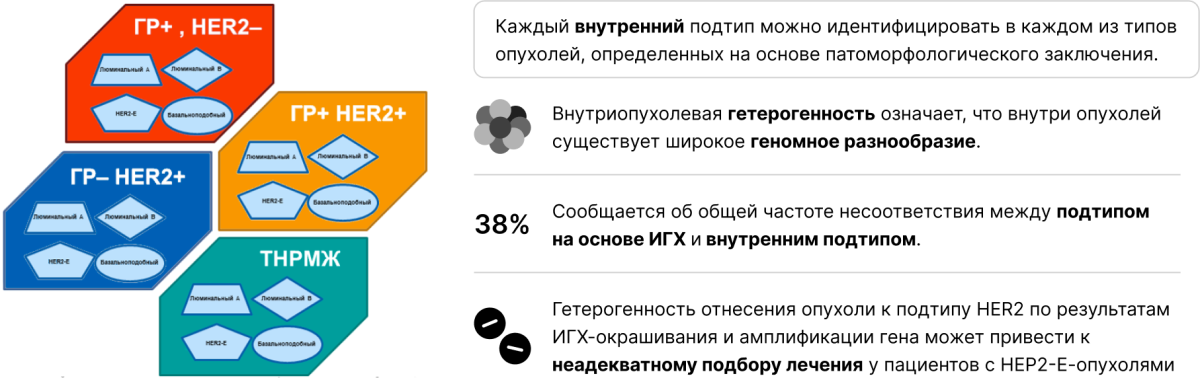
Каждый внутренний подтип РАМ50, т. е. подтип с определенным спектром генетических нарушений, может обнаруживаться при любом гистопатологическом типе рака молочной железы, выявленном с помощью иммуногистохимии [5].
А значит, часть пациенток рискует получить лекарственное лечение, не отвечающее биологии ее опухоли.
Добавьте к этому характерное для солидных злокачественных новообразований (и для рака молочной железы в частности) явление внутриопухолевой гетерогенности — и получите многократное усложнение молекулярно-генетического ландшафта опухоли конкретной пациентки [8]. Не говоря уже о молекулярных различиях первичной опухоли и метастатической [9].
Каждый внутренний подтип можно идентифицировать в каждом из типов опухолей, определенных на основе патоморфологического заключения
Между тем противоречия существуют не только в контексте иммуногистохимической диагностики. Далее мы поговорим о том, что же представляет из себя HER2-enriched-рак молочной железы и почему амплификация гена ERBB2 еще не говорит о том, что мы имеем дело с данным биологическим подтипом.
Источники:
- Russnes H.G., Lingjærde O.C., Børresen-Dale A.L., Caldas C. Breast Cancer Molecular Stratification: From Intrinsic Subtypes to Integrative Clusters. Am J Pathol. 2017 Oct;187(10):2152-2162. doi: 10.1016/j.ajpath.2017.04.022. Epub 2017 Jul 19. PMID: 28733194.
- Perez E.A., Ballman K.V., Mashadi-Hossein A. et al. Intrinsic Subtype and Therapeutic Response Among HER2-Positive Breaty st Tumors from the NCCTG (Alliance) N9831 Trial. J Natl Cancer Inst. 2016 Oct 28;109(2):djw207. doi: 10.1093/jnci/djw207. PMID: 27794124; PMCID: PMC5903647.
- Perez E.A., Romond E.H., Suman V.J. et al. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: joint analysis of data from NCCTG N9831 and NSABP B-31. J Clin Oncol. 2011 Sep 1;29(25):3366-73. doi: 10.1200/JCO.2011.35.0868. Epub 2011 Jul 18. PMID: 21768458; PMCID: PMC3164242.
- Perez E.A., Ballman K.V., Mashadi-Hossein A. et al. Intrinsic Subtype and Therapeutic Response Among HER2-Positive Breaty st Tumors from the NCCTG (Alliance) N9831 Trial. J Natl Cancer Inst. 2016 Oct 28;109(2):djw207. doi: 10.1093/jnci/djw207. PMID: 27794124; PMCID: PMC5903647.
- Godoy-Ortiz A., Sanchez-Muñoz A., Chica Parrado M.R. et al. Deciphering HER2 Breast Cancer Disease: Biological and Clinical Implications. Front Oncol. 2019 Oct 29;9:1124. doi: 10.3389/fonc.2019.01124. PMID: 31737566; PMCID: PMC6828840.
- Kim H.K., Park K.H., Kim Y. et al. Discordance of the PAM50 Intrinsic Subtypes Compared with Immunohistochemistry-Based Surrogate in Breast Cancer Patients: Potential Implication of Genomic Alterations of Discordance. Cancer Res Treat. 2019 Apr;51(2):737-747. doi: 10.4143/crt.2018.342. Epub 2018 Sep 5. PMID: 30189722; PMCID: PMC6473265.
- Schettini F., Prat A. Dissecting the biological heterogeneity of HER2-positive breast cancer. Breast. 2021 Oct;59:339-350. doi: 10.1016/j.breast.2021.07.019. Epub 2021 Aug 5. PMID: 34392185; PMCID: PMC8374722.
- Lüönd F., Tiede S., Christofori G. Breast cancer as an example of tumour heterogeneity and tumour cell plasticity during malignant progression. Br J Cancer 125, 164–175 (2021). https://doi.org/10.1038/s41416-021-01328-7
- Nguyen B. et al. Genomic characterization of metastatic patterns from prospective clinical sequencing of 25,000 patients. Cell. 2022 Feb 3;185(3):563-575.e11. doi: 10.1016/j.cell.2022.01.003. PMID: 35120664; PMCID: PMC9147702.
778504/web/gen/03.24/1

