Значительное число белков, закодированных в геноме человека, не поддаются воздействию стандартными средствами для лечения1,2. Открытие в 2001 году механизма РНК-интерференции, за которое американские генетики Крейг Мелло и Эндрю Файер получили Нобелевскую премию, позволило разработать инновационный класс РНК-таргетных препаратов1. Их эффект подобен истинному снижению экспрессии генов. Теоретически они могут воздействовать на любую генетическую мишень1,3.
РНК-интерференция
РНК-интерференция — это естественный клеточный процесс, который подавляет экспрессию гена, способствуя деградации молекул матричной РНК (мРНК) с определенной последовательностью, и контролирует синтез белка4–6. Этапы РНК‑интерференции представлены на рисунке 1.
-
1 —
Длинные двухцепочечные РНК (дцРНК) — транскрибированные или экзогенные — опосредуют мощное и специфичное подавление экспрессии генов. Они разрезаются ферментами Dicer (РНКаза) в цитоплазме до малых интерферирующих РНК (миРНК)4.
На разрезанную миРНК воздействует РНК-индуцируемый комплекс выключения гена (RISC)4,5.
-
2 —
Фермент в составе комплекса RISC Argonaute-2 разрезает и расщепляет сопровождающую цепь короткой интерферирующей РНК (киРНК)6.
-
3 —
Направляющая цепь направляет RISC к таргетной мРНК с помощью комплементарного спаривания оснований4.
-
4 —
Белок Argonaute-2 в составе комплекса RISC разрезает таргетную мРНК и препятствует трансляции и синтезу белка4,5.
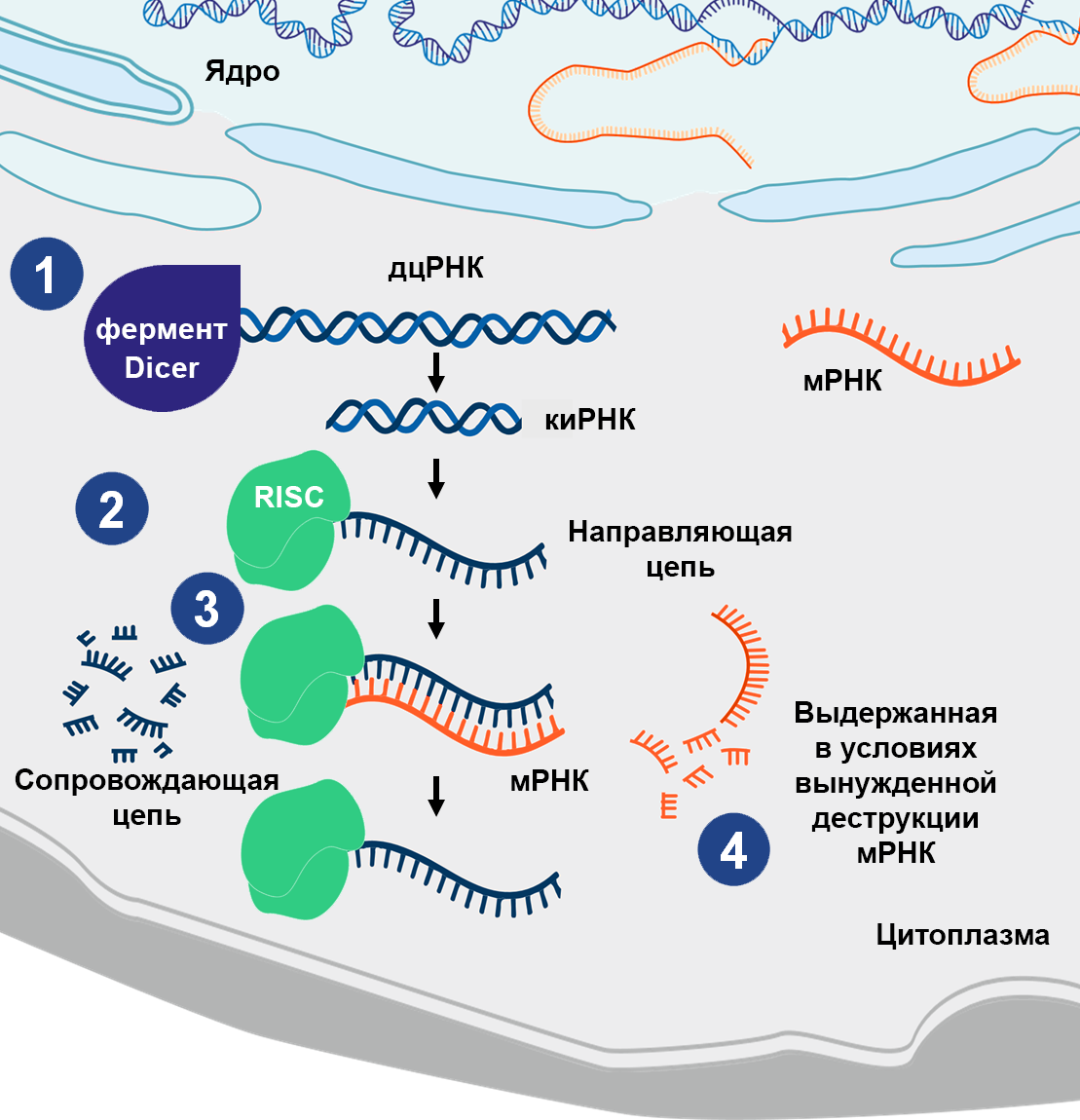
Рисунок 1 — Процесс РНК-интерференции
РНК-таргетные препараты
Препараты на основе РНК-интерференции задействуют ее естественный биологический путь для регуляции экспрессии определенных генов4. Разработка РНК-препаратов фокусируется на подавлении экспрессии гена с помощью коротких синтетических некодирующих РНК (нкРНК), в том числе киРНК, для регуляции и/или выключения таргетных генов2,4.
На сегодняшний день различают два основных типа РНК-таргетных препаратов — антисмысловой олигонуклеотид (АСО) и миРНК. Их основные характеристики указаны в таблице 1.
Таблица 1 — Сравнительные характеристики молекул АСО и миРНК
| АСО | миРНК | |
|
Механизм действия
|
Деградация таргетной РНК посредством РНКазы Н1, пространственное блокирование РНК (изменение сплайсинга, блокирование трансляции) | Деградация РНК белком Ago2 из комплекса RISC |
|
Локализация действия
|
Ядро и цитоплазма | Цитоплазма |
|
Способ доставки
|
Солевой раствор — подкожно | Липосомы (дополнительно требуются стероиды); солевой раствор — подкожно, другое |
|
Соединение, направляющее в печень
|
GalNAc | GalNAc |
|
Захват/период полувыведения/ выведение
|
Быстрый захват, период полураспределения менее 1 ч, период полувыведения из гепатоцитов 2–4 недели, выведение экзонуклеазами и эндонуклеазами | Быстрый захват, период полураспределения менее 1 ч, период полувыведения из гепатоцитов 2–4 недели, выведение экзонуклеазами и эндонуклеазами |
Примечание.
GalNAc — N-ацетилгалактозамин.
Механизм действия АСО
Существует несколько механизмов действия АСО (рис. 2).
-
Частота госпитализаций
РНКаза H1 присутствует в большинстве клеток и обеспечивает расщепление РНК в гетеродуплексе РНК-ДНК7. Это приводит к избирательному расщеплению цепочек РНК, в то время как синтетическая цепь ДНК остается интактной и связывается с таргетной мРНК8. Нокдаун таргетной мРНК в конечном счете снижает синтез белка, вызывающего заболевание8.
-
Пространственное блокирование трансляции
АСО может блокировать трансляцию белка, связываясь с его таргетной РНК и предотвращая фиксацию рибосомы9.
-
Модуляция сплайсинга
АСО могут связываться с некодирующими последовательностями пре-мРНК и изменять ее сплайсинг9.
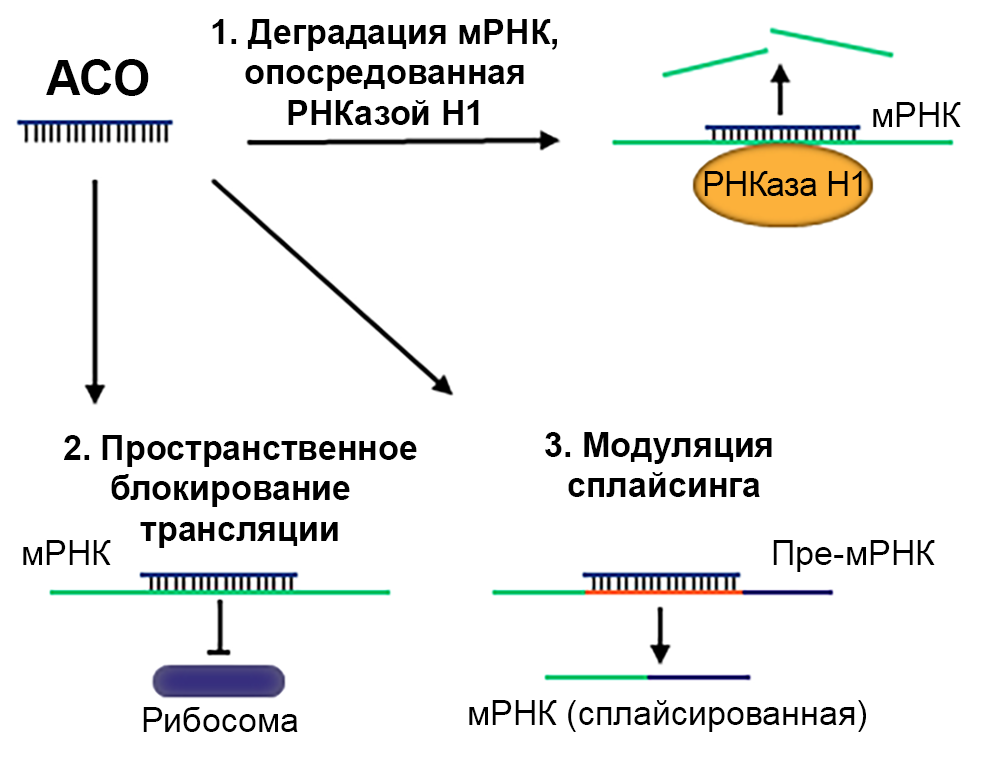
Рисунок 2 — Механизм действия АСО
Механизм действия миРНК
С помощью миРНК удается таргетно и эффективно воздействовать на результат экспрессии гена: синтез конечного продукта снижается на 99%7,8. МиРНК содержит нуклеотидные последовательности, комплементарные мРНК, транскрибирующей целевой ген. Таким образом, воздействуя на путь эндогенной РНК-интерференции, удается подвергнуть деградации определенную мРНК7–9.
Оценка безопасности РНК-препаратов
Эволюция химической структуры и комбинированное применение различных химических модификаций было поворотным моментом в улучшении показателей эффективности и профиля безопасности РНК-препаратов. Так, при использовании АСО и миРНК, конъюгированных с GalNAc, показатели активности повышались при значительно более низких концентрациях в плазме крови10–12. Токсические эффекты развиваются редко и обычно на фоне высоких доз10.
GalNAc — это высокоаффинный лиганд асиалогликопротеинового рецептора (ASGPR)13,14. ASGPR в большом количестве (0,5–1 млн копий/клетка) экспрессируется на поверхности гепатоцитов и в течение 15 минут возвращается в повторный цикл (рис. 3)1,13. Конъюгация трехвалентных групп GalNAc (GalNAc3) с АСО или миРНК способствует таргетной доставке в гепатоциты, исключительной стабильности и продолжительному эффекту14.
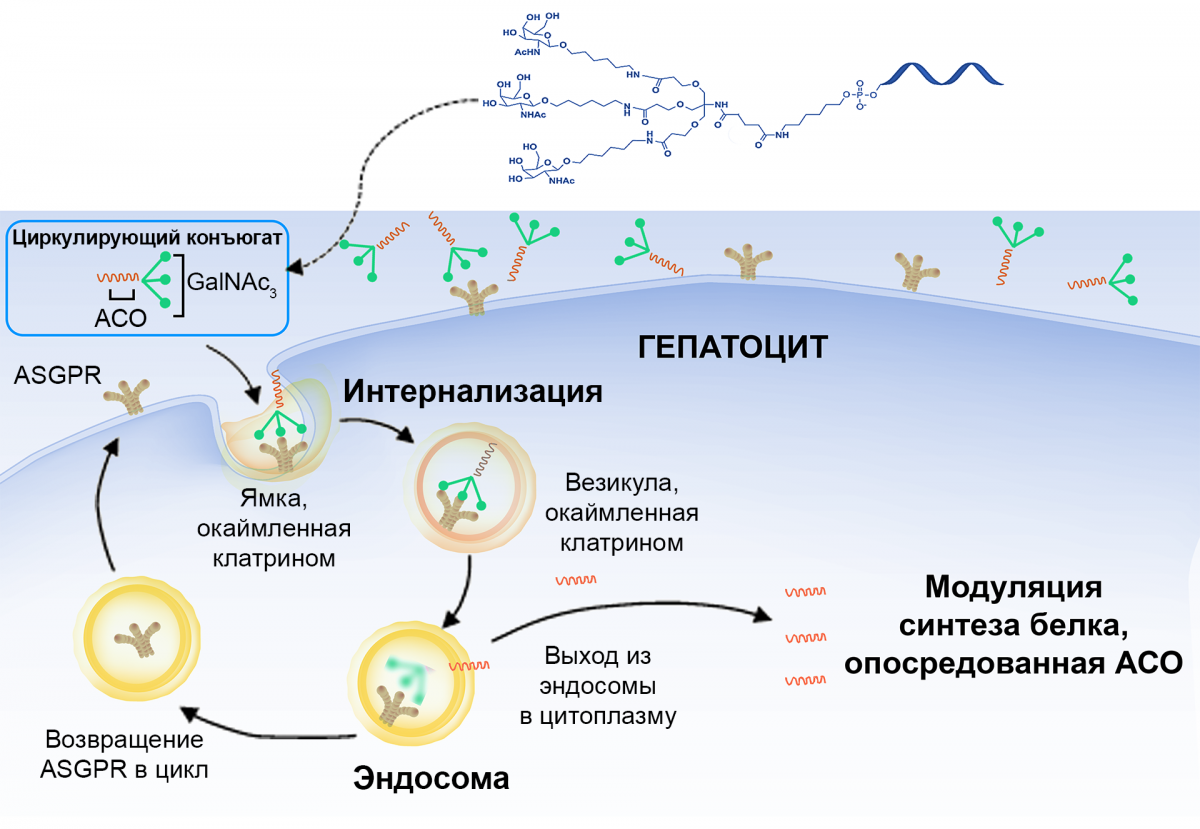
Рисунок 3 — Механизм таргетной доставки в гепатоциты
Понимание молекулярных механизмов действия РНК-препаратов и усовершенствование химической структуры приводят к неизменному улучшению их клинических характеристик (табл. 2).
Таблица 2 — Обзор нежелательных явлений при использовании различных АСО и миРНК
| Местные реакции* | Тромбоцитопения | НЯ со стороны почек и печени | ||
| 1998 г. | Фомивирсена (АСО с ФТ связями) | ++2 | – | – |
| 2004 г. | Пегаптанибb (2’‑F / 2’‑O‑MOЭ АСО) | ++2,15 | – | ++2,15 |
| 2013 г. | Мипомерсен (2’‑MOЭ / ДНК ФТ АСО) |
++2 | +22 | ++2 |
| 2016 г. | Нусинерсен (полностью модифицированный 2’‑MOЭ АСО) | +16 | +16 | – |
| 2016 г. | Этеплирсенc (ФМО АСО) | +17 | – | +17 |
| 2018 г. | Инотерсен (полностью модифицированный 2’-MOЭ АСО) | ++18 | ++2,18 | +2,18 |
| 2019 г. | Голодирсен (ФМО АСО) | ++19 | – | – |
| 2019 г. | Воланесорсен (2’‑MOЭ ФТ АСО) | ++20,21 | ++20,21 | – |
| 2018 г. | Патисиран† (2’‑O‑метил киРНК) | ++2 | – | – |
| 2019 г. | Гивосиран (ФТ, 2’‑метокси, 2’‑фтор, GalNAc3киРНК) | ++23 | – | +23 |
| В настоящие дни | GalNAc3-конъгированные соединения (исследования продолжаются) | + | – | – |
Примечание.
++ Высокая частота развития; + Низкая частота развития; – НЯ отсутствуют.
* Местные реакции включают реакции в месте инъекции и гриппоподобный синдром.
† Периферический отек обычно отмечался как симптом, связанный с инфузией.
a Повышение внутриглазного давления и внутриглазное воспаление от легкой до умеренной степени тяжести (продажи препарата были остановлены в связи со значительным снижением заболеваемости цитомегаловирусным ретинитом и соответствующим снижением клинической потребности)2.
b Реакции в месте инъекции, повышение уровня трансаминаз, жировой гепатоз; доля рынка снизилась из-за других конкурирующих препаратов2.
с Противоречивые доказательства относительно эффективности и фармакодинамического эффекта2.
НЯ — нежелательные явления; 2’-O-Me — 2’-O-метил; 2’-F — 2’-фтор; 2’-O-MOЭ — 2’-O-метоксиэтил; GalNАc3 — трехантенный N-ацетилгалактозамин; ФМО — фосфородиамидат морфолиновый олигонуклеотид; ФТ — фосфотиоат.
Список источников:
- Yu A.M. et al. RNA Therapy: Are We Using the Right Molecules? Pharmacol Ther. 2019;196:91-104.
- Crooke S.T. et al. RNA-Targeted Therapeutics. Cell Metab. 2018;27(4):714-739.
- Tsimikas S. RNA-targeted therapeutics for lipid disorders. Curr Opin Lipidol. 2018;29(6):459-466.
- Lam J.K.W. et al. siRNA Versus miRNA as Therapeutics for Gene Silencing. Mol Ther Nucleic Acids. 2015;4:e252.
- Wilson R.C., Doudna J.A. Molecular Mechanisms of RNA Interference. Annu Rev Biophys. 2013;42:217-239.
- Rand T.A. et al. Argonaute2 cleaves the anti-guide strand of siRNA during RISC activation. Cell. 2005;123:621-629.
- Bennet С.F. et al. Antisense Oligonucleotide Therapies for Neurodegenerative Diseases. Annu Rev Med. 2019;70:307-321.
- Yin W., Rogge M. Targeting RNA: A Transformative Therapeutic Strategy. Clin & Transl Sci. 2019, 12:98-112.
- Rossor A.M. et al. Antisense oligonucleotides and other genetic therapies made simple. Pract Neurol 2018;18:126-131.
- Chi X. et al. Safety of antisense oligonucleotide and siRNA-based therapeutics. Drug Discov Today. 2017;22(5):823-833.
- Smit E., Zain R. Therapeutic Oligonucleotides: State of the Art. Ann Rev Pharma & Toxicol, 2019; 59: 605-630.
- Khvorova A. et al. The chemical evolution of oligonucleotide therapies of clinical utility. Nat Biotech, 2017, 35: 238-248.
- Shen Х., Corey R., Nucl Acid Res, 2018, 46: 1584-1600.
- Levin A. et al. Targeting Therapeutic Oligonucleotides. N Engl J Med. 2017 Jan 5;376(1):86-88.
- Hegele R.A. et al. Lipid-Lowering Agents. Circ Res. 2019;124(3):386-404.
- Stolte B. et al. Feasibility and safety of intrathecal treatment with nusinersen in adult patients with spinal muscular atrophy. Ther Adv Neurol Disord. 2018;11:1756286418803246.
- Lim K.R.Q. et al. Eteplirsen in the treatment of Duchenne muscular dystrophy. Drug Des Devel Ther. 2017 28;11:533-545.
- Brannagan T.H. et al. Early data on long‐term efficacy and safety of inotersen in patients with hereditary transthyretin amyloidosis. Eur J Neurol. 2020. doi: 10.1111/ene.14285.
- Heo W. et al. Drugs. 2020 Feb;80(3):329-333.
- Mansoor M. et al. Advances in antisense oligonucleotide development for target identification, validation, and as novel therapeutics. Gene Regul Syst Bio. 2008;2:275-95.
- Witztum J.L. et al. Volanesorsen and Triglyceride Levels in Familial Chylomicronemia Syndrome. N Engl J Med. 2019;381(6):531-542.
- Reeskamp L.F. et al. Safety and efficacy of mipomersen in patients with heterozygous familial hypercholesterolemia. Atherosclerosis. 2019;280:109-117.
- Scott L.J et al. Givosiran: First Approval. Drugs. 2020;80(3):335-339.
