Острый миелоидный лейкоз (ОМЛ) — клональное опухлевое заболевание, связанное с мутацией в клетке-предшественнице гемопоэза, следствием которой становятся блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток1.
Точные причины возникновения ОМЛ неизвестны, считается, что заболевание развивается при сочетании определенных факторов. К немодифицируемым факторам риска развития заболевания относятся генетические особенности, возраст старше 65 лет, мужской пол. Среди модифицируемых факторов риска строгая взаимосвязь с развитием ОМЛ показана для курения, контакта с рядом химических веществ, действия ионизирующего излучения, в том числе при лечении онкологических заболеваний2–4.
Классификация заболевания
Согласно классификации Всемирной организации здравоохранения (ВОЗ) 2016 года выделяют следующие категории ОМЛ5:

ОМЛ с устойчиво выявляемыми генетическими аномалиями:
-
ОМЛ с t(8;21)(q22;q22); RUNX1-RUNX1T1;
-
ОМЛ с inv(16)(p13.1q22) или t(16;16)(p13.1;q22); CBFB-MYH11;
-
острый промиелоцитарный лейкоз с t(15;17)(q22;q12); PML-RARA;
-
ОМЛ с t(9;11)(p22;q23); MLLT3-KMT2A;
-
ОМЛ с t(6;9)(p23;q34); DEK-NUP214;
-
ОМЛ с inv(3)(q21q26.2) или t(3;3)(q21;q26.2); RPN1-EVI1;
-
ОМЛ (мегакариобластный) с t(1;22)(p13;q13); RBM15-MKL1;
-
ОМЛ с BCR-ABL1.

ОМЛ с генными мутациями:
-
ОМЛ с мутированным геном NPM1;
-
ОМЛ с биаллельной мутацией гена CEBPA;
-
ОМЛ с мутированным геном RUNX1.
ОМЛ с изменениями, связанными с миелодисплазией.
Миелоидные неоплазии, связанные с предшествующей ХТ.

ОМЛ, по-другому не специфицированные (NOS):
-
острый миелобластный лейкоз с минимальной дифференцировкой;
-
острый миелобластный лейкоз без созревания;
-
острый миелобластный лейкоз с созреванием;
-
острый миеломонобластный лейкоз;
-
острый монобластный/моноцитарный лейкоз;
-
острый эритромиелоз;
-
острый мегакариобластный лейкоз;
-
острый лейкоз из базофилов;
-
острый панмиелоз с миелофиброзом (синонимы: острый миелофиброз, острый миелосклероз).

Миелоидная саркома (синонимы: экстрамедуллярная миелоидная опухоль, гранулоцитарная саркома, хлорома).

Миелоидные опухоли, связанные с синдромом Дауна:
-
транзиторный аномальный миелопоэз (синоним: транзиторное миелопролиферативное заболевание (МПЗ));
-
миелоидный лейкоз, связанный с синдромом Дауна.

Опухоль из плазмоцитоидных дендритных клеток.

Острые лейкозы неопределенной линии дифференцировки:
-
острый недифференцированный лейкоз;
-
острый лейкоз смешанного фенотипа (ОЛСФ) с t(9;22)(q34;q11.2); BCR-ABL1;
-
ОЛСФ с t(v;11q23.3); реаранжировка гена KMT2A;
-
ОЛСФ, B/миелоидный, NOS;
-
ОЛСФ, T/миелоидный, NOS;
-
ОЛСФ NOS;
-
ОЛ неопределенной линии дифференцировки NOS.
Мутации в гене fms-связанной тирозинкиназы 3 (fms-related tyrosine kinase, FLT3) могут проводить к повышенной пролиферации опухолевых клеток и их устойчивости к апоптозу. Несмотря на то, что ОМЛ с мутациями FLT3 (FLT3+) не рассматривается как отдельная категория, скрининг этих мутаций имеет прогностическую значимость. Мутации в гене FLT3 присутствуют примерно у 30% пациентов с впервые выявленным ОМЛ. У большей части пациентов обнаруживается мутация внутреннего тандемного дублирования (ITD), ассоциированная с неблагоприятным прогнозом заболевания и высокой частотой рецидивов, особенно при высоком соотношении (> 0,5) мутантного аллеля и аллеля дикого типа. У части пациентов обнаруживается точечная мутация в домене тирозинкиназы (TKD)6.
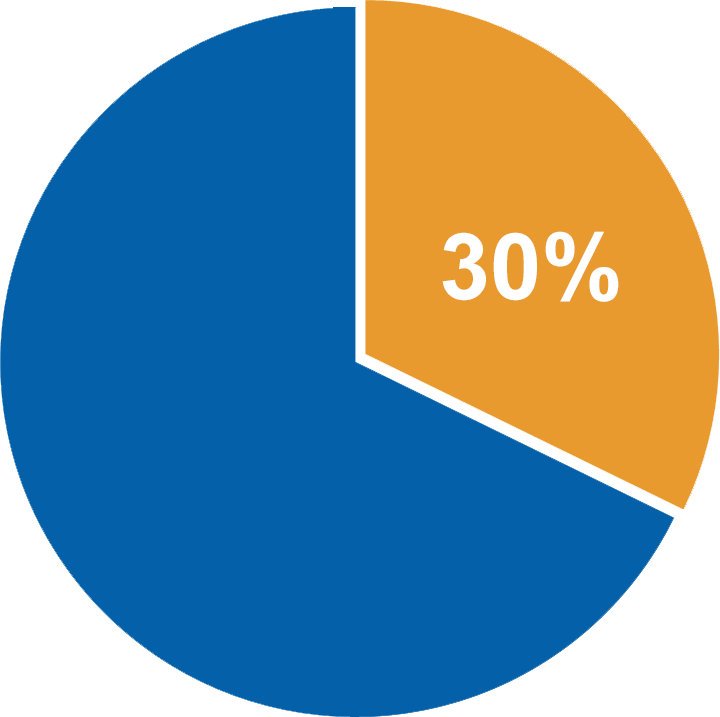
Рисунок 1. Вероятность выживания без признаков заболевания через 3 года при FLT3-TKD
Так, у пациентов с впервые выявленным FLT3-TKD ОМЛ с нормальным кариотипом, достигших полной ремиссии после химиотерапии, вероятность выживания без признаков заболевания спустя 3 года — около 30% (рис. 1). Тогда как у пациентов с FLT3-WT («дикого типа» — наиболее часто встречающийся вариант) ОМЛ этот показатель был равен примерно 60%7 (рис. 2).
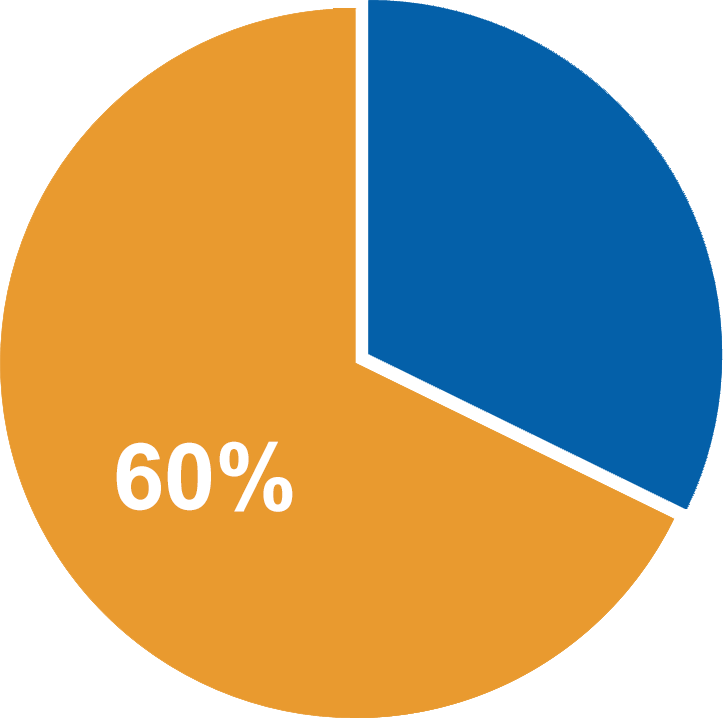
Рисунок 2. Вероятность выживания без признаков заболевания через 3 года при FLT3-WT
Однако прогностическое значение мутаций FLT3-TKD полностью не изучено, так как в ряде случаев у пациентов с такими мутациями наблюдается более низкая кумулятивная частота рецидивов, более высокие уровни безрецидивной выживаемости и общей выживаемости8, в связи с чем влияние данной мутации обсуждается.
Диагностика заболевания
Диагноз ОМЛ устанавливают при обнаружении ≥ 20% бластных миелоидных клеток в пунктате костного мозга или периферической крови, либо, вне зависимости от количества бластных клеток, при наличии характерных для ОМЛ генетических аномалий: t(8;21) (q22; q22) AML/ETO, t(15;17)(q12; q11-12) PML/RAR-α, inv(16) или t(16;16)(p12; q23) CBF/MYH11, t(1;22)1,5,9.
Для подтверждения диагноза ОМЛ рекомендовано проведение следующих лабораторных исследований1,9:
-
общий (клинический) развернутый анализ крови;
-
цитологическое исследование мазка костного мозга (миелограмма);
-
иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге (ИФТ-исследование);
-
цитогенетическое исследование кариотипа аспирата костного мозга;
-
скрининг мутаций в генах, ассоциированных с ОМЛ.
Методы лечения ОМЛ
Выбор оптимальной тактики лечения ОМЛ зависит от индивидуальной клинической картины заболевания у пациента. На сегодняшний день главный принцип терапии ОМЛ — максимально эффективное лечение с минимальными нежелательными последствиями для пациента. Эффективность и безопасность терапии ОМЛ зависят от специфичности цитостатического воздействия и достаточного сопроводительного лечения.
Терапия ОМЛ состоит из нескольких этапов1,5,9:

индукция ремиссии;


консолидация ремиссии / ± алло-ТГСК;


поддерживающая терапия.

Индукция ремиссии — начальный период лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии.
Консолидация ремиссии — Вторым этапом терапии острого лейкоза (ОЛ) является закрепление достигнутого противоопухолевого эффекта (обычно 1–2 курса). В настоящее время в большинстве случаев консолидация – наиболее агрессивный и высокодозный этап при лечении ОЛ. Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток1.
Поддерживающее лечение — продолжение цитостатического воздействия в меньших дозах, чем в период индукции/консолидации ремиссии, или иного (таргетного) воздействия на возможно остающийся опухолевый клон1.
Профилактика нейролейкемии необходима при лечении некоторых вариантов ОМЛ — промиелоцитарного с лейкоцитозом > 10 × 109/л, миеломоно- и монобластного, ОМЛ с экстрамедуллярными поражениями, ОМЛ с инициальным лейкоцитозом 30 × 109/л и более. Профилактика нейролейкемии проводится на всех этапах лечения ОМЛ, начиная с индукции ремиссии.
Индукционную терапию ОМЛ цитостатическими препаратами рекомендовано начинать сразу после подтверждения диагноза при отсутствии противопоказаний1,9,10. В тех случаях, когда необходимо проведение дополнительных лабораторных исследований для детальной характеристики клинико-патологических особенностей заболевания и выбора оптимальной тактики лечения, допустима отсрочка начала терапии9. Отсрочка начала терапии на короткий период (5–7 дней) от начала диагностики заболевания не влияет на эффективность терапии, показатели ранней летальности, а также отдаленные результаты терапии ОМЛ.
Пациентам групп высокого и промежуточного риска, пациентам с нормальным кариотипом и неблагоприятными молекулярными маркерами рекомендовано проведение аллогенной трансплантации костного мозга (алло-ТКМ) или трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК) на этапе постремиссионной терапии. Пациентам группы благоприятного прогноза также рекомендовано проведение алло-ТКМ/алло-ТГСК при недостижении постоянной ремиссии после 1-го курса индукции1,10.
На рисунках 3 и 4 представлены обобщающие схемы рекомендуемого лечения ОМЛ у разных возрастных групп пациентов в соответствии с клиническими рекомендациями Ассоциации онкологов России и Национального гематологического общества 2020 года1.
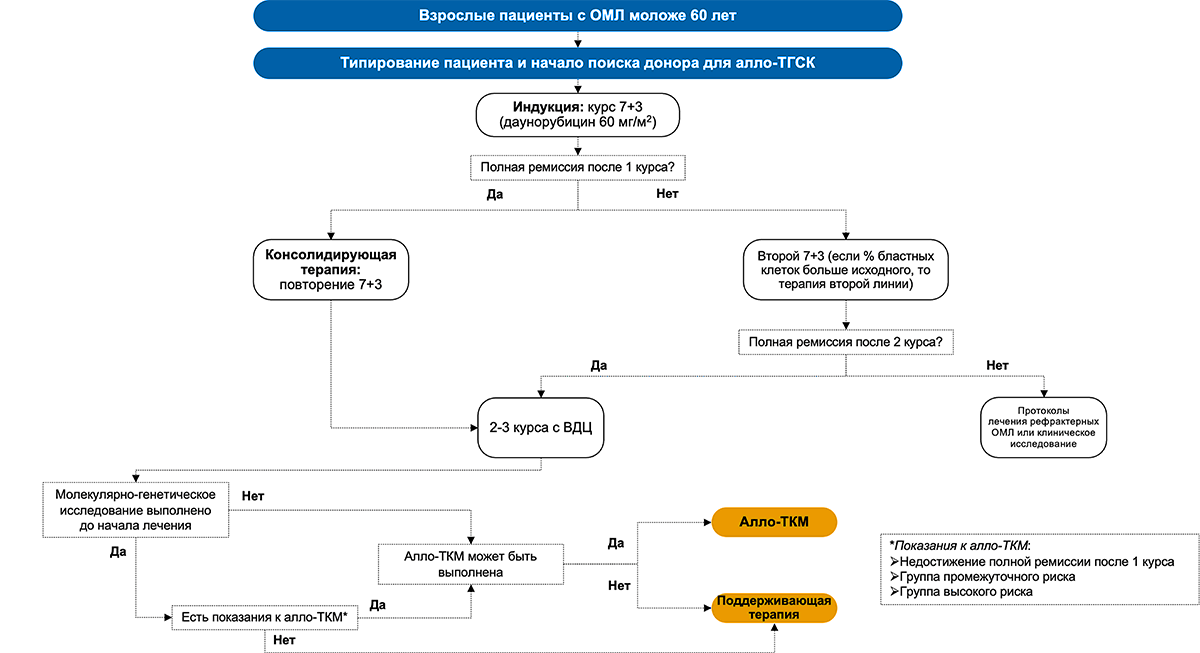
Рисунок 3. Схема лечения ОМЛ у пациентов возрастом до 60 лет
Примечание.
Курс 7 + 3:
1) цитарабин 100 мг/м2 в/в 2 раза в сутки в 1–7-й дни в комбинации с даунорубицином 60 мг/м2 в/в 1 раз в день в 1–3-й дни или митоксантроном 10 мг/м2 в/в 1 раз в день в 1–3-й дни или идарубицином 12 мг/м2 в/в 1 раз в день в 1–3-й дни;
2) цитарабин 200 мг/м2 в/в круглосуточно в 1–7-й дни в комбинации с даунорубицином 60 мг/м2 в/в 1 раз в день в 3–5-й дни или митоксантроном 10 мг/м2 в/в 1 раз в день в 3–5-й дни или идарубицином 12 мг/м2 в/в 1 раз в день в 3–5-й дни.
ВДЦ — высокие дозы цитарабина.
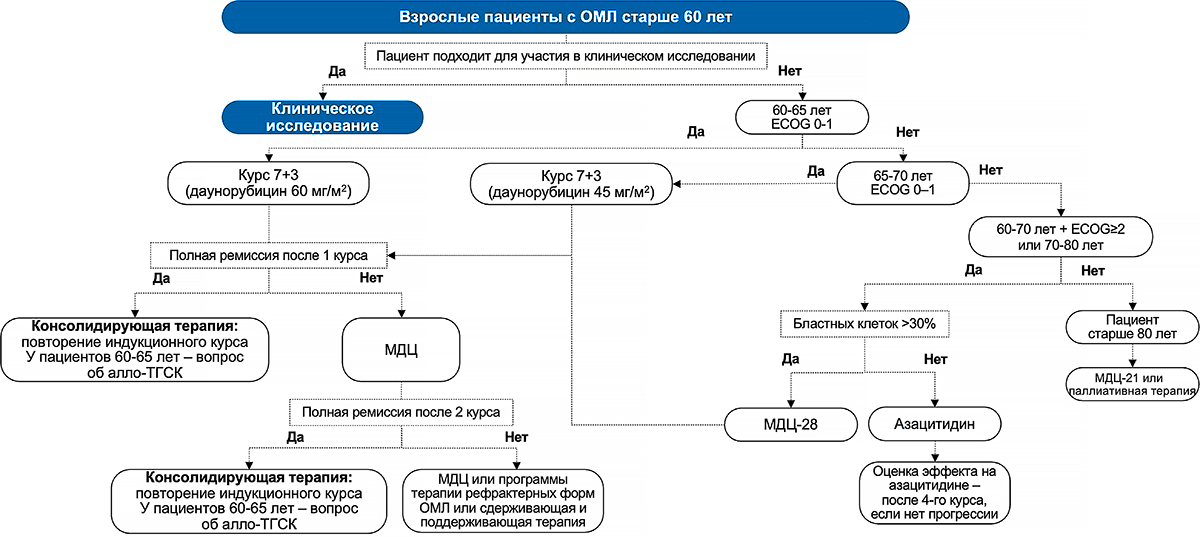
Рисунок 4. Схема лечения ОМЛ у пациентов старше 60 лет
Примечание.
ECOG — Шкала оценки общего состояния пациента Восточной объединенной онкологической группы (The ECOG Scale of Performance Status); МДЦ — малые дозы цитарабина.
Список литературы:
- Острые миелоидные лейкозы. Клинические рекомендации Ассоциации онкологов России и Национального гематологического общества. (2020).
- Juliusson G. et al. Prevalence and characteristics of survivors from acute myeloid leukemia in Sweden. Leukemia 31, (2017).
- Shallis R.M., Wang R., Davidoff A., Ma X. & Zeidan A.M. Epidemiology of acute myeloid leukemia: Recent progress and enduring challenges. Blood Reviews 36, (2019).
- Granfeldt Østgård L.S. et al. Epidemiology and Clinical Significance of Secondary and Therapy-Related Acute Myeloid Leukemia: A National Population-Based Cohort Study. Journal of Clinical Oncology 33, (2015).
- Arber D.A. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 127, (2016).
- Stone R.M. et al. Midostaurin plus Chemotherapy for Acute Myeloid Leukemia with a FLT3 Mutation. New England Journal of Medicine 377, (2017).
- Whitman S.P. et al. FLT3 D835/I836 mutations are associated with poor disease-free survival and a distinct gene-expression signature among younger adults with de novo cytogenetically normal acute myeloid leukemia lacking FLT3 internal tandem duplications. Blood 111, 1552–1559 (2008).
- Mead A. et al. FLT3 tyrosine kinase domain mutations are biologically distinct from and have a significantly more favorable prognosis than FLT3 internal tandem duplications in patients with acute myeloid leukemia. Blood 110, 1262–1270 (2007).
- Döhner H. et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 129, (2017).
- Heuser M. et al. Acute myeloid leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 31, (2020).
11213597/RYD/WEB/062024/1
