Использование анти-VEGF-препаратов в лечении макулярного отека при окклюзии вен сетчатки (ОВС) позволяет прервать патофизиологический каскад неоваскуляризации и прогрессирования заболевания на относительно ранних стадиях. Одним из таких препаратов является ранибизумаб, эффективность и безопасность которого продемонстрированы и продолжают исследоваться в серии контролируемых рандомизированных исследований, включивших пациентов отдельно с окклюзией центральной вены сетчатки (ОЦВС)1–3 или с окклюзией ветви центральной вены сетчатки (ОВВС)34,37,42, а также больных с ОВС вне зависимости от уровня поражения35,38,40.
Результаты двух крупных исследований — BRAVO4,7 и CRUISE1,8,9 — показали, что терапия ранибизумабом приводит к значимому улучшению остроты зрения через полгода после начала терапии и обеспечивает сохранение достигнутого улучшения с 6 по 12 мес. При этом профиль безопасности препарата соответствовал данным, полученным в ранее проведенных исследованиях III фазы10, а новых нежелательных явлений выявлено не было.
Дизайн исследований
Первичные цели:
-
Оценить эффективность интравитреальных инъекций ранибизумаба, назначавшегося ежемесячно в течение 6 месяцев, на основании среднего изменения максимально корригированной остроты зрения (МКОЗ) от исходного значения до значения через 6 месяцев (первичная конечная точка эффективности).
-
Оценить безопасность интравитреальных инъекций ранибизумаба через 6 и 12 месяцев — во время периода ежемесячного лечения и периода лечения по мере необходимости, согласно определенным протоколом критериям возобновления лечения (первичная конечная точка безопасности).
Вторичные цели:
-
Оценить эффективность ранибизумаба в отношении:
-
среднего изменения МКОЗ с течением времени;
-
количества пациентов, достигших улучшения МКОЗ более чем на 15 букв ETDRS (Early Treatment Diabetic Retinopathy Study) с течением времени;
-
среднего изменения толщины центральной зоны сетчатки (ТЦЗС) с течением времени;
-
субъективных исходов зрительной функции с помощью оценки скорости чтения и данных опросника NEI-VFQ 25 (например, общий балл, зрение в целом, показатели, характеризующие деятельность, связанную со зрением вблизи и вдаль).
-
Дизайн исследований BRAVO4,7 и CRUISE1,8,9 представлен на рис. 1 и 2.
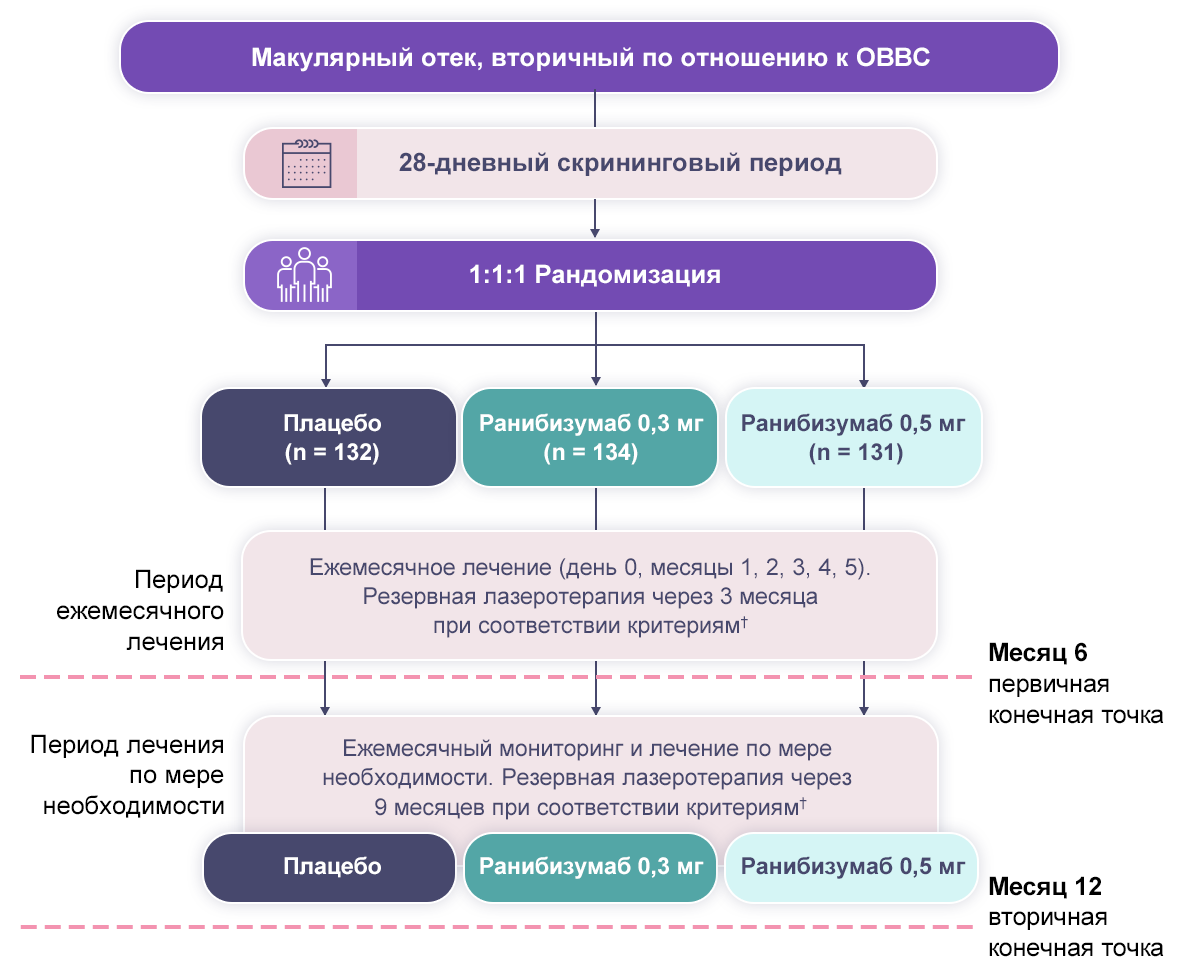
Примечания.
† Лечили, если МКОЗ составляла 20/40 или хуже или при средней ТЦЗС ≥ 250 мкм.
† Кровоизлияния достаточно рассосались для применения лазеротерапии И ОЗ составляет 20/40 в эквиваленте таблицы Снеллена или хуже, либо при ТЦЗС ≥ 250 мкм И МКОЗ, увеличившейся на > чем 5 букв, либо при ТЦЗС, уменьшившейся на > чем 50 мкм в сравнении с визитом за 3 месяца перед настоящим визитом.
ОВВС — окклюзия ветвей центральной вены сетчатки; PRN — pro re nata (по мере необходимости).
Рисунок 1. Дизайн исследования BRAVO
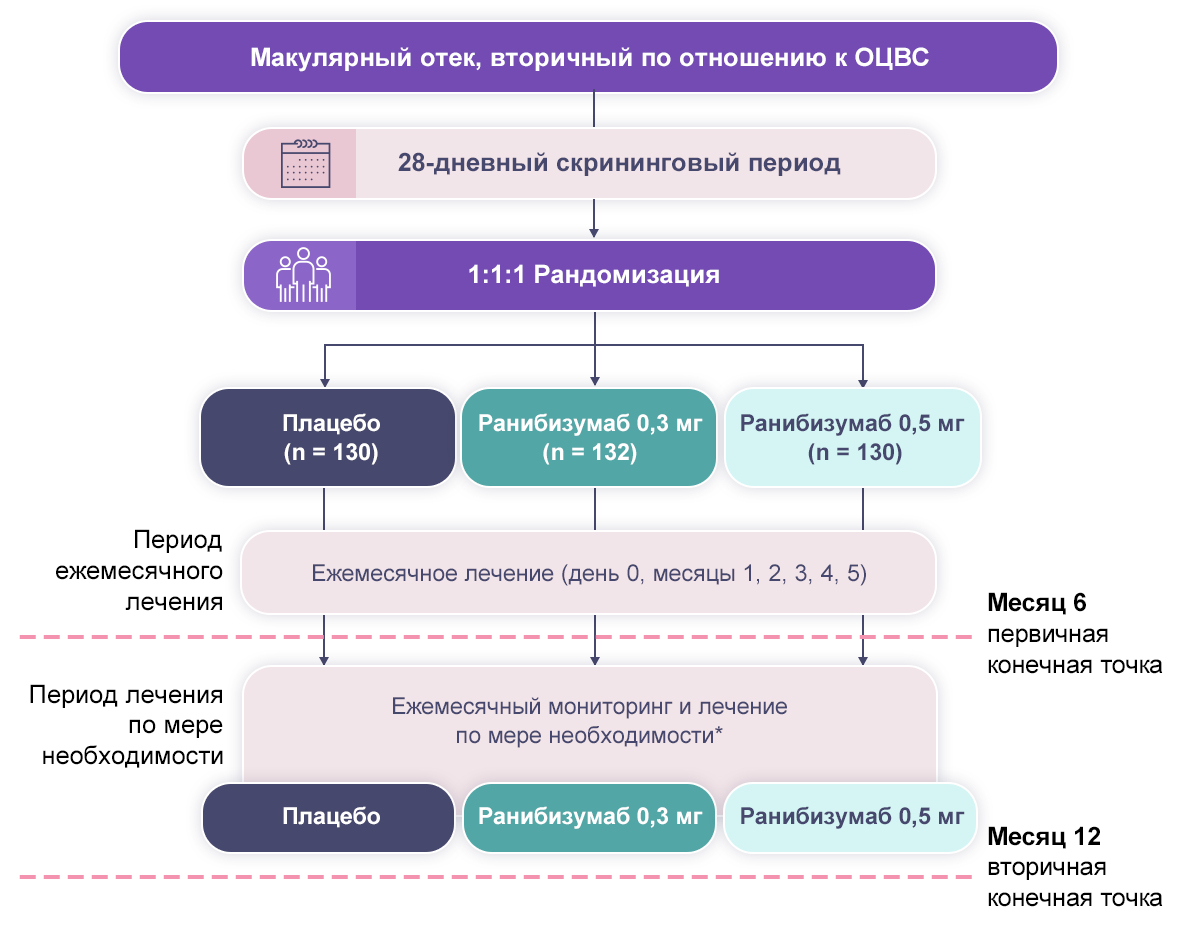
Примечание.
* Лечили, если МКОЗ составляла 20/40 в эквиваленте таблицы Снеллена или хуже или при средней ТЦЗС ≥ 250 мкм.
Рисунок 2. Дизайн исследования CRUISE
Критерии включения и исключения
Ключевые критерии включения в исследования и исключения обозначены в табл. 1.
Таблица 1 — Критерии включения и исключения
| Критерии включения | Критерии исключения |
|
|
Примечание.
* Применяется к исследуемому глазу.
Результаты
Оценка эффективности
Результаты продемонстрировали значимое улучшение остроты зрения через полгода после начала лечения ранибизумабом по сравнению с исходным уровнем и группой плацебо (первичная конечная точка). Быстрый и значимый функциональный и анатомический ответ наблюдался уже на 7-е сутки. Было зарегистрировано сохранение достигнутого улучшения зрения с 6 по 12 месяц при переключении с ежемесячного режима на режим PRN. Однако улучшение ОЗ к 12 месяцу было более выражено в группе пациентов, получавших ранибизумаб с самого начала исследования.
У пациентов из группы плацебо, которые с 6-го месяца были переведены на ранибизумаб 0,5 мг, наблюдалось улучшение зрения:
-
с +7,3 (6 месяц) до +12,1 (12 месяц) буквы (BRAVO) (рис. 3);
-
с +0,8 (6 месяц) до +7,3 (12 месяц) буквы (CRUISE) (рис. 4).
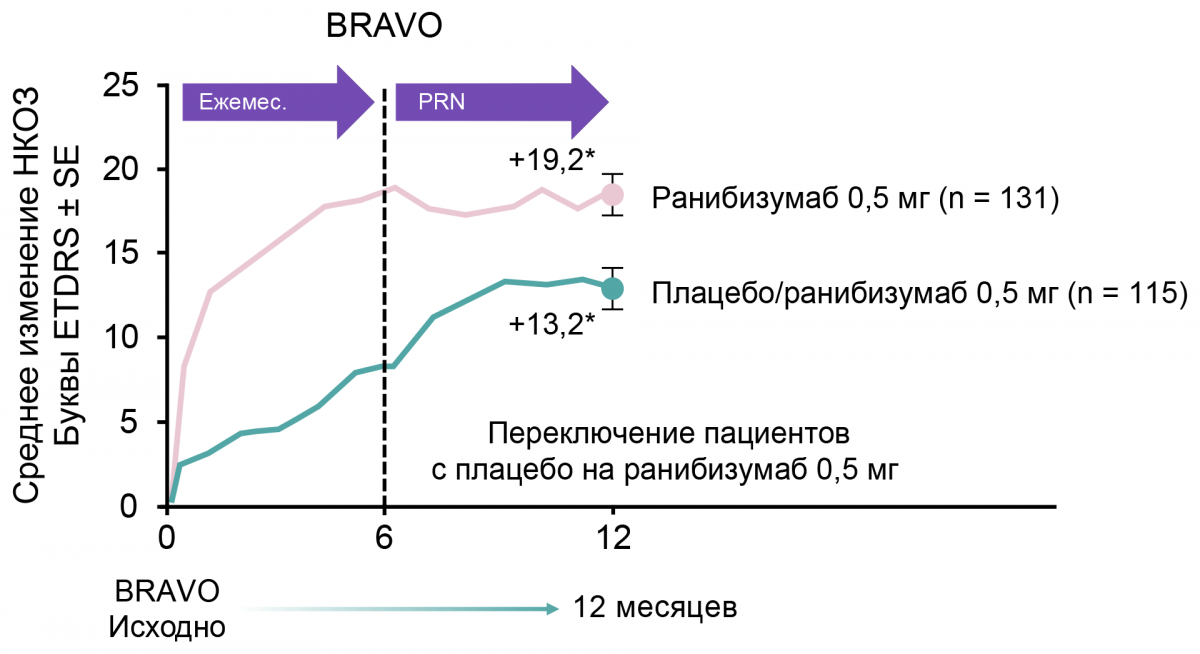
Примечание.
ETDRS — Early Treatment Diabetic Retinopathy Study; SE — стандартная ошибка.
Рисунок 3. Динамика улучшения зрения у пациентов с ОВВС в течение 12 месяцев терапии ранибизумабом в исследовании BRAVO
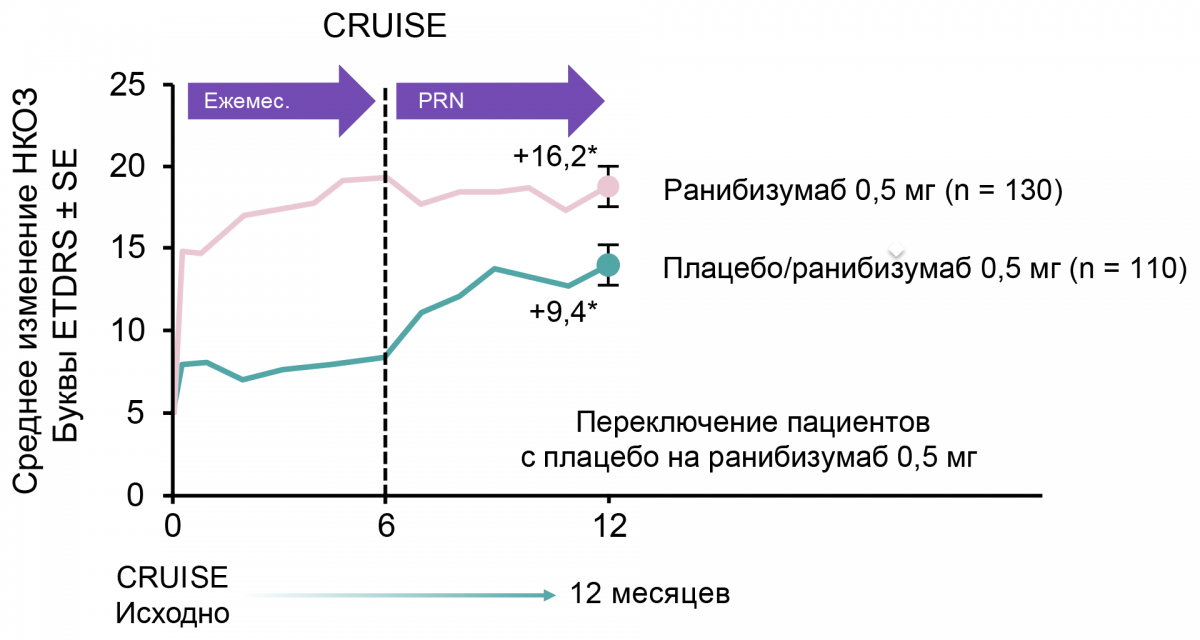
Рисунок 4. Улучшение зрения у пациентов с ОЦВС в течение 12 месяцев терапии ранибизумабом в исследовании CRUISE
Оценка безопасности
Профиль безопасности соответствовал данным, полученным в ранее проведенных исследованиях ранибизумаба III фазы10. У пациентов с ОВВС7 и ОЦВС8 не было выявлено каких-либо новых нежелательных явлений (табл. 2).
Таблица 2 — Обобщение данных по безопасности
BRAVO
-
Ни одного случая эндофтальмита.
-
Ни одного случая отслойки сетчатки.
-
Низкая частота серьезных тромбоэмболий (2,3%) через 12 месяцев терапии.
-
Два случая летальных исходов (в группе плацебо и в группе ранибизумаба 0,5 мг).
CRUISE
-
Один случай эндофтальмита (в группе ранибизумаба 0,5 мг).
-
Один случай отслойки сетчатки (в группе ранибизумаба 0,3 мг).
-
Низкая частота серьезных тромбоэмболий (0,7–2,35%) через 12 месяцев терапии.
-
Три случая летальных исходов (в каждой группе лечения).
Список источников:
- www.clinicaltrials.gov/show/NCT00485836 (CRUISE).
- www.clinicaltrials.gov/ct2/show/NCT01535261 (CRYSTAL).
- www.clinicaltrials.gov/show/NCT01396083 (COMRADE-C).
- www.clinicaltrials.gov/ct2/show/NCT00486018 (BRAVO).
- www.clinicaltrials.gov/ct2/show/NCT01599650 (BRIGHTER).
- www.clinicaltrials.gov/ct2/show/NCT01396057 (COMRADE-B).
- Campochiaroet al. Ranibizumabfor macular edema following branch retinal vein occlusion: six-month primary end point results of a phase III study. Ophthalmology 2010, 117(6):1102-1112.e1.
- Brown et al. Ranibizumabfor macular edema following central retinal vein occlusion: six-month primary end point results of a phase III study.Ophthalmology 2010, 117(6):1124-1133.e1.
- CampochiaroPAet.al., Sustained benefits from ranibizumabfor macular edema following central retinal vein occlusion: twelve-month outcomes of a phase III study. Ophthalmology. 2011 Oct;118(10):2041-9.
- Brown et.al. Sustained benefits from ranibizumabfor macular edema following branch retinal vein occlusion: 12-month outcomes of a phase III study. Ophthalmology. 2011. 118(8):1594-602.
450572/LUC/WEB/052024/1
