Развитие таргетной терапии изменило парадигму лечения немелкоклеточного рака легкого. В связи с ростом числа таргетных методов лечения НМРЛ текущие рекомендации Национальной комплексной онкологической сети (NCCN), а также действующие рекомендации Минздрава РФ советуют проводить комплексное молекулярное генотипирование перед началом терапии первой линии для всех пациентов, у которых впервые диагностирован распространенный и метастатический неплоскоклеточный НМРЛ, для обеспечения возможности проведения персонализированного лечения1,2.
Появление ингибиторов иммунных контрольных точек также повысило значимость молекулярно-генетической диагностики (МГД), поскольку пациенты с терапевтически значимыми геномными изменениями, особенно с мутациями в гене EGFR и транслокацией гена ALK редко отвечают на иммунотерапию даже при наличии высокой экспрессии PD-L1, что делает выбор таргетной терапии в случае таких пациентов наиболее предпочтительным3. Все это свидетельствует в пользу того, что наличие результатов МГД до терапии первой линии будет определять выбор оптимальной индивидуальной терапии и, следовательно, будет связано с лучшей выживаемостью.
В исследовании Charu Aggarwal et al., опубликованном в журнале Precision Medicine, впервые проверяется гипотеза о том, что наличие результатов молекулярно-генетической диагностики до начала терапии первой линии связано с увеличением общей выживаемости пациентов4.
Дизайн
Ретроспективное сравнительное когортное исследование реальной клинической практики, в котором использовались данные электронных медицинских записей (EHR; Epic Systems, Мэдисон, Висконсин), собранных в Университете Пенсильвании. Первичная когорта (N=335) включала вновь диагностированных пациентов с метастатическим неплоскоклеточным НМРЛ, ранее не получавших лечение, которые совершили не менее двух визитов к врачу в период с 1 января 2019 по 31 декабря 2020 года.
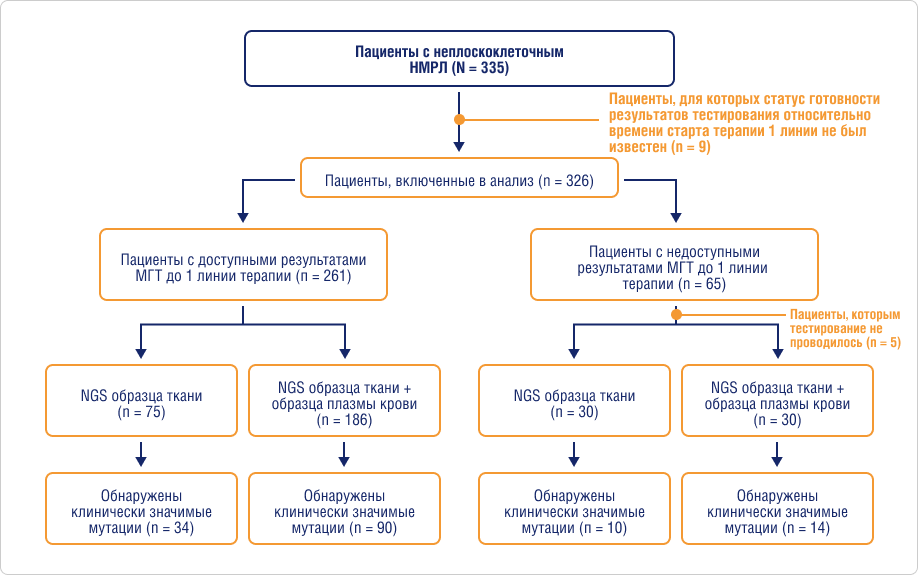
Далее пациенты были разделены на две группы в зависимости от сроков получения результатов МГД: «доступная» группа включала пациентов с результатами МГД до начала терапии первой линии и «недоступная» группа, включавшая пациентов, у которых не было результатов молекулярного генотипирования до начала терапии первой линии (рис. 1).
Рис. 1. Схема, иллюстрирующая отбор пациентов, их распределение по когортам и количество обнаруженных клинически значимых мутаций (EGFR, ALK, BRAF, ROS1, MET, RET, NTRK1, 2 и 3, KRAS G12C и ErbB2)
Первичной целью исследования было изучение связи между общей выживаемостью и наличием/отсутствием результатов молекулярного генотипирования до старта терапии первой линии. Общая выживаемость определялась как время между датой постановки диагноза и датой смерти или цензурированная при последнем наблюдении или прекращении сбора данных (31 декабря 2021 года).
Кроме того, для оценки связи между доступностью и полнотой (комплексное vs неполное) молекулярно-генетического тестирования и ОВ использовалась четырехуровневая категориальная переменная для определения групп пациентов с (1) доступным + комплексным тестированием, (2) недоступным + комплексным тестированием, (3) доступным + неполным тестированием и (4) недоступным + неполным тестированием/отсутствием тестирования.
Комплексное тестирование определялось как наличие результатов тестирования для 7 клинически значимых генов: EGFR, ALK, BRAF, ROS1, MET, RET и NTRK. Неполное тестирование определялось наличием результатов для ≤6 генов из списка выше.
Вторичной целью исследования было изучение связи между модальностью тестирования (одновременное тестирование ткани и плазмы крови по сравнению с тестированием только ткани) и доступностью результатов тестирования до начала первой линии терапии.
Результаты
Связь между доступностью результатов тестирования и общей выживаемостью
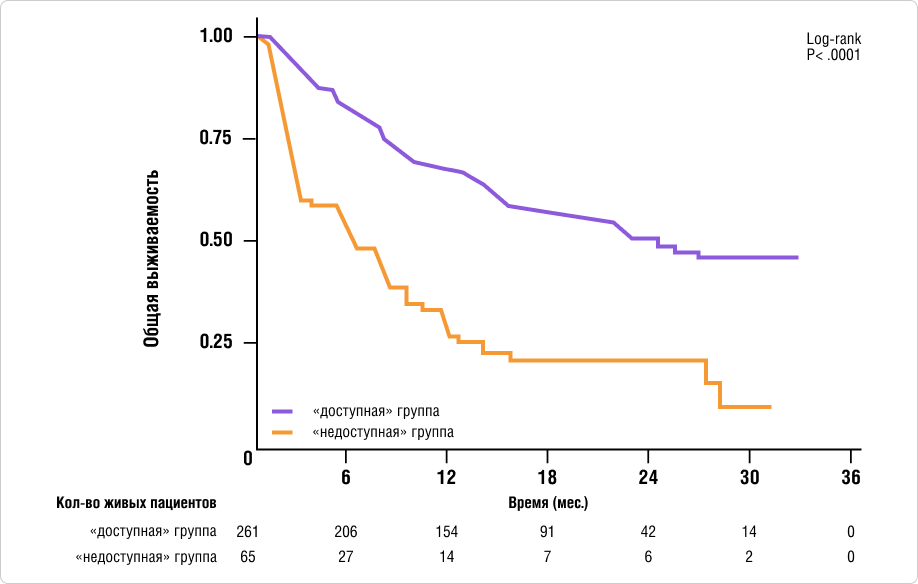
В нескорректированном анализе выживаемости с медианой наблюдения 14,2 месяца пациенты в «доступной» группе тестирования имели значительно большую выживаемость по сравнению с «недоступной» группой тестирования:
Медиана ОВ составила 24,6 мес. для доступной группы (95% ДИ: 18,6 – НД) и 6,2 мес. для недоступной группы (95% ДИ: 2,8 - 10,3; log rank P <0,0001) (рис.2).
Рис. 2. Кривая Каплана-Мейера для общей выживаемости в нескорректированном анализе выживаемости. ОВ на основании наличия результатов тестирования до терапии первой линии.
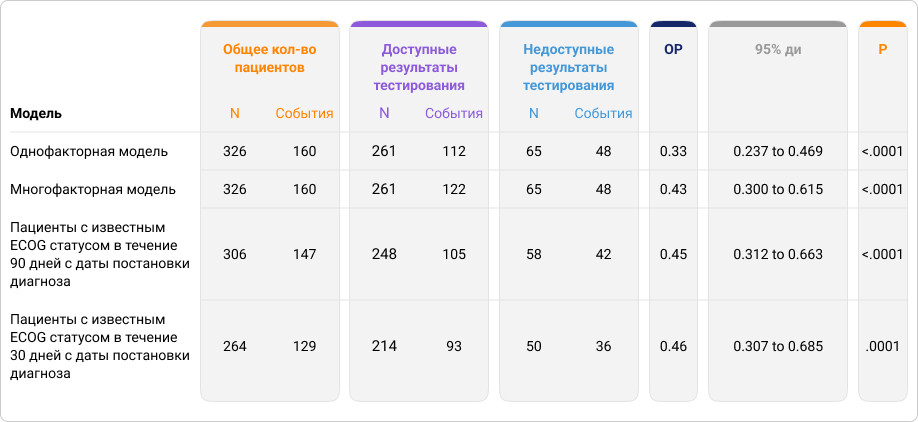
В скорректированных регрессионных моделях Кокса «доступная» группа также была связана со значительно более длительной медианой ОВ по сравнению с «недоступной» группой тестирования. (ОР = 0,43; 95% ДИ: 0,30 - 0,62; P < 0,0001;) (табл.1).
Табл. 1. Результаты однофакторного, многофакторного регрессионного анализа Кокса для оценки влияния наличия результатов тестирования на медиану ОВ
Поскольку статус ECOG — одна из ключевых переменных, влияющая на общую выживаемость, для оценки чувствительности отношения рисков (ОР) к отсутствию в данных значений статуса ECOG было проведено два дополнительных анализа с учетом (1) только тех пациентов, для которых ECOG-статус был доступен в течение 90 дней с даты постановки диагноза (n=306) и (2) пациентов со статусом ECOG, доступным в течение 30 дней с даты постановки диагноза (n=64).
В таблице 1 также показаны результаты анализа полных наблюдений после исключения пациентов с отсутствующим ECOG-статусом. Даже после исключения пациентов с отсутствующим ECOG статусом, «доступная» группа тестирования по-прежнему связана с более высокой медианой ОВ, чем «недоступная» группа тестирования.
Связь между доступностью результатов тестирования, полнотой тестирования и общей выживаемостью
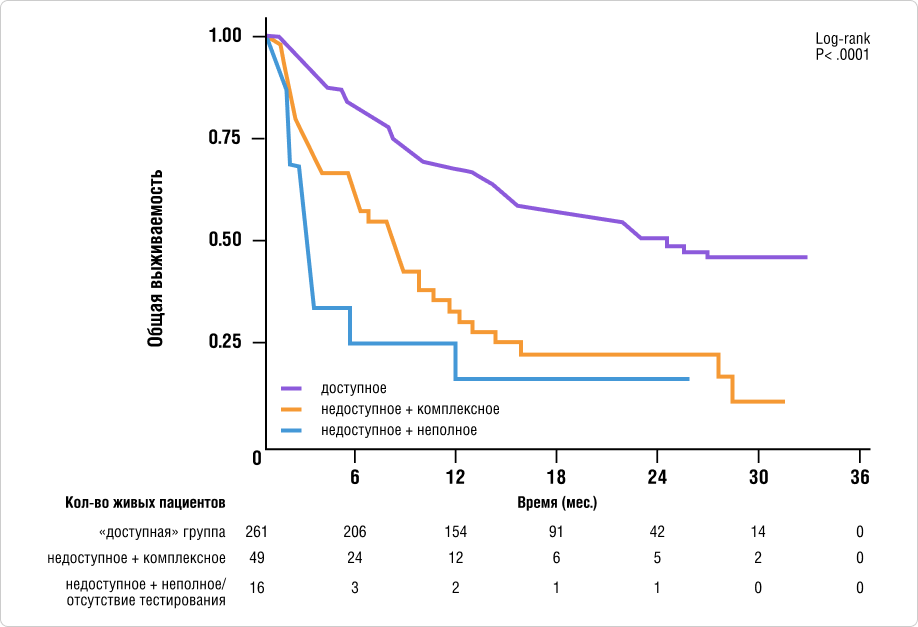
Поскольку группы с «доступным» комплексным и «доступным» неполным тестированием показали схожие результаты выживаемости при нескорректированном анализе, далее эти группы были объединены в единую «доступную» группу тестирования.
На рисунке 3 представлены кривые выживаемости для (1) «доступной» группы тестирования по сравнению с группами с (2) недоступным + комплексным тестированием и (3) недоступным + неполным тестированием. Между тремя группами наблюдалась значительная разница в медиане общей выживаемости (log-rank P <0,001), что согласуется с результатом применения скорректированной модели пропорциональных рисков.
Рис. 3. ОВ на основании полноты тестирования и наличия результатов до терапии первой линии. Нескорректированные кривые выживаемости для «доступной» группы тестирования (как с комплексным, так и неполным тестированием) по сравнению с «недоступной» группой + комплексным тестированием и «недоступной» группой + неполным тестированием
Связь между наличием результатов тестирования и общей выживаемостью среди пациентов, не получавших таргетную терапию
После поправки на прочие переменные статистически значимого взаимодействия между доступностью результатов тестирования до начала терапии первой линии и использованием таргетной терапии обнаружено не было.
В подгруппе пациентов, которые не имели клинически значимых мутаций и, следовательно, не получали таргетную терапию (n=233), пациенты с «доступными» результатами тестирования имели значительно большую выживаемость по сравнению с «недоступной» группой тестирования, с медианой ОВ, равной 18,2 мес. (95% ДИ: 13,4–24,6) по сравнению с 5,4 мес. (95% ДИ: 2,8 до 9,2; log-rank P <0,0001). После поправки на другие переменные среди пациентов, не получавших таргетную терапию, «доступная» группа по-прежнему демонстрировала значительно более длительную выживаемость по сравнению с «недоступной» группой тестирования (ОР 0,46; 95% ДИ: 0,32–0,68; P <0,0001).
Связь между модальностью теста и доступностью результатов теста до терапии первой линии
После поправки на прочие переменные одновременное тестирование тканей и плазмы крови было связано со значительно более высокими шансами получения результатов теста до начала терапии первой линии по сравнению с тестированием только тканей (скорректированное отношение шансов 2,06; 95% ДИ: 1,09–3,90; P=0,026).
Основные ограничения настоящего исследования
Настоящие результаты имеют ряд ограничений, связанных с ретроспективным наблюдательным характером исследования. Медиана общей выживаемости в «недоступной» группе тестирования оказалась ниже ожидаемой, что может быть связано с влиянием других факторов, таких как необходимость быстрого начала терапии из-за быстрого ухудшения клинического статуса пациента, что подразумевает необходимость лечения эмпирически, не дожидаясь результатов исследования биомаркеров. Кроме того, в «недоступной» группе тестирования было больше пациентов со статусом ECOG=2, что также могло способствовать худшей выживаемости.
Тем не менее, после учета различий в ECOG-статусе между «доступной» и «недоступной» группами с помощью модели пропорциональных рисков значимое существенное различие в медиане общей выживаемости между исследуемыми группами сохранялось.
Выводы
Среди пациентов с метастатическим неплоскоклеточным НМРЛ в реальной когорте наличие результатов молекулярного генотипирования до начала терапии первой линии было связано со значительно лучшей общей выживаемостью, а одновременное тестирование образцов ткани и плазмы крови было связано с более высокой вероятностью получения результатов теста до начала терапии первой линии.
Полученные результаты подчеркивают особую важность готовности результатов молекулярного тестирования до старта терапии первой линии.
Источники
- Клинические рекомендации Минздрава. Немелкоклеточный рак легкого. 2022.
- NCCN Guidelines. Non-small cell lung cancer. Version 3.2023.
- Lisberg A, Cummings A, Goldman JW, et al: A phase II study of pembrolizumab in EGFR-mutant, PD-L11, tyrosine kinase inhibitor naive patients with advanced NSCLC. J Thorac Oncol 13: 1138-1145, 2018.
- Aggarwal C, Marmarelis ME, Hwang WT, et al. Association Between Availability of Molecular Genotyping Results and Overall Survival in Patients With Advanced Nonsquamous Non-Small-Cell Lung Cancer. JCO Precis Oncol. 2023;7:e2300191. doi:10.1200/PO.23.00191.
11338310/ONCO/DIG/12.24/0