Цели терапии1
По данным исследования MPN Landmark Survey, представления пациентов и врачей о целях терапии расходятся.
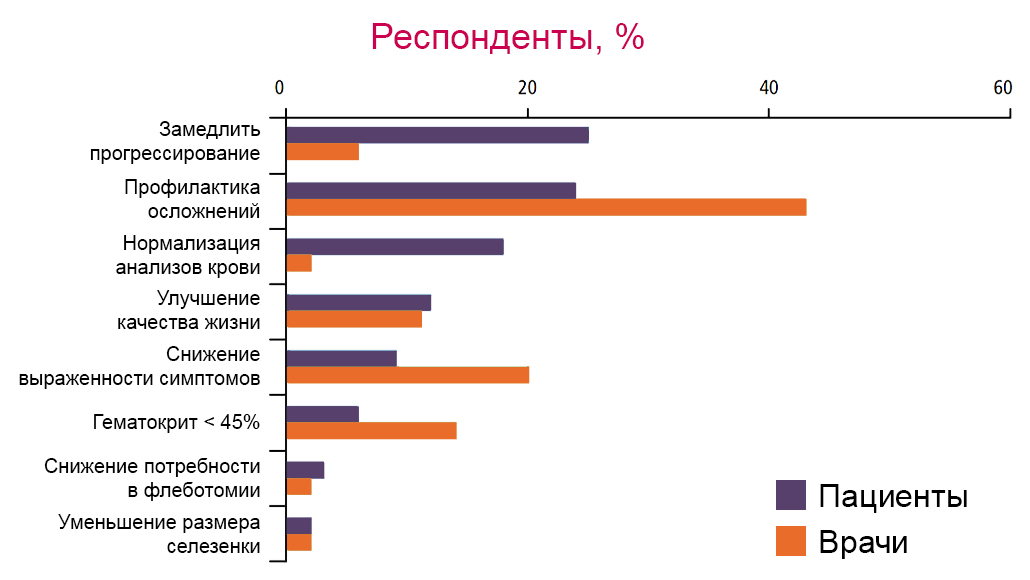
ИП — истинная полицитемия; ЭПО — эритропоэтин; ОАК — общий анализ крови; ПЦР — полимеразная цепная реакция; ИГХ — иммуногистохимическое исследование; УЗИ — ультразвуковое исследование
Излечение при ИП возможно только при выполнении аллогенной трансплантации костного мозга (алло-ТГСК).
Однако в связи с высокой ожидаемой продолжительностью жизни при ИП и высоким риском от лечения алло-ТГСК проводится только в случае трансформации в пост-ИП МФ и ОМЛ.
Пациенты в хронической фазе ИП получают циторедуктивную терапию по показаниям и терапию антиагрегантами.
ИП — истинная полицитемия; ЭПО — эритропоэтин; ОАК — общий анализ крови; ПЦР — полимеразная цепная реакция; ИГХ — иммуногистохимическое исследование; УЗИ — ультразвуковое исследование
По этой причине главная цель лечения—достижение контроля над симптомами заболевания, снижение риска тромботических осложнений, портальной гипертензии.
Стратегия терапии должна соответствовать индивидуальным потребностям пациента7
Прогрессирование истинной полицитемии
Трансформация ИП в пост-ИП МФ или ОМЛ кратно снижает ожидаемую продолжительность жизни.

3-7месяцев Медиана общей выживаемости при трансформации в ОМЛ7
ИП — истинная полицитемия; пост-ИП МФ — постполицитемический миелофиброз; ОМЛ — острый миелобластный лейкоз
Риск прогрессирования истинной полицитемии
Факторы риска трансформации в ОМЛ
-
Лейкоцитоз > 15 x 109/л2-4
-
Независимыми факторами риска безрецидивной выживаемости являются атипичный кариотип и возраст старше 61 года5
-
Число циркулирующих CD34+клеток на момент диагноза ОМЛ связано с безрецидивной выживаемостью2
-
Применение радиоактивного фосфора (32P),бусульфана независимо повышает риск трансформации ИП в ОМЛ5.
Факторы риска прогрессирования в пост-ИП МФ
-
Лейкоцитоз > 15 x 109/л2 на момент диагноза.
-
Аллельная нагрузка JAK2 > 50%3
ИП — истинная полицитемия; пост-ИП МФ — постполицитемический миелофиброз; ОМЛ — острый миелобластный лейкоз
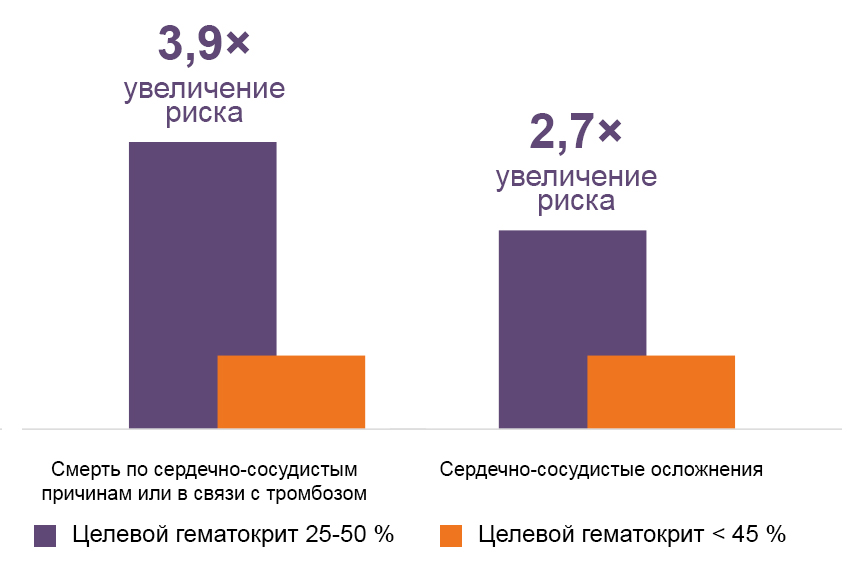
Значимость контроля гематокрита: CYTO-PV
Первичная конечная точка — время до смерти от сердечно-сосудистых или тромботических осложнений.
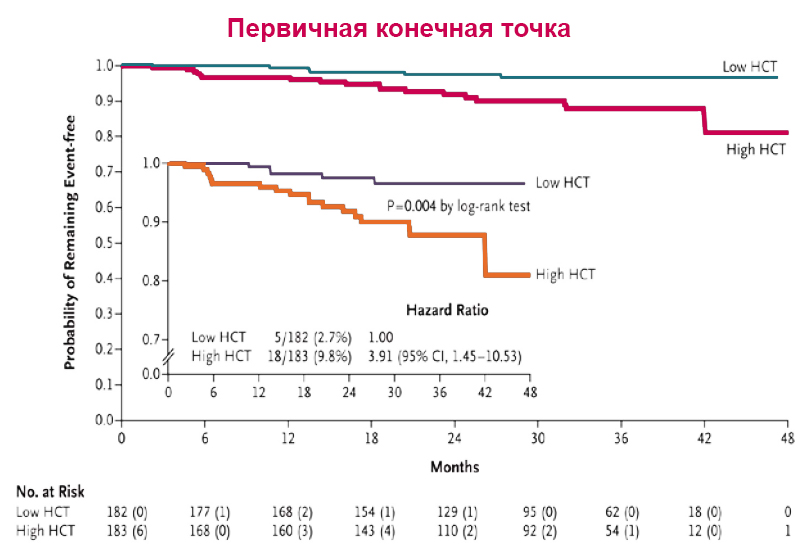
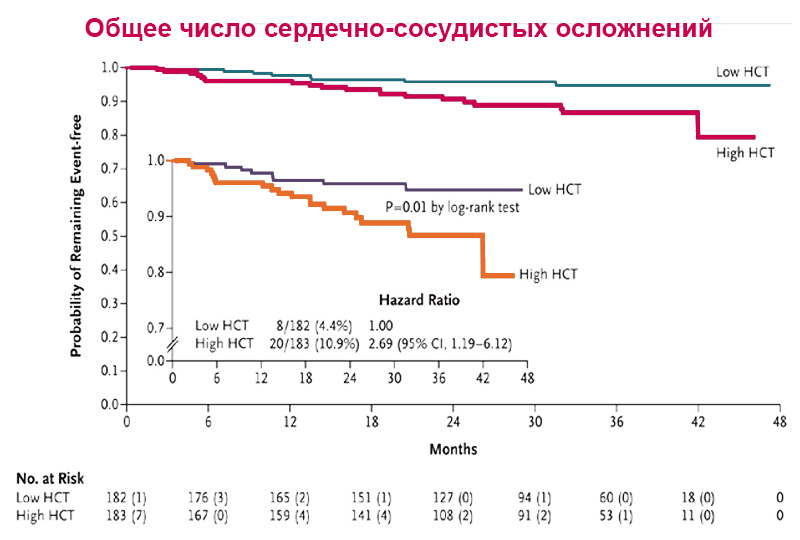
Гематокрит <45%связан:
-
со снижением риска от сердечно-сосудистых осложнений в четыре раза;
-
снижением частоты сердечно-сосудистых осложнений в три раза.
Доступные терапевтические опции
-
Антиагреганты
-
Флеботомия
-
Циторедуктивная терапия
-
Симптоматическая терапия
Выбор тактики лечения
Рекомендации European Leukemia Net (ELN) основаны на учете возраста и риска тромбозов.
Низкий риск10,11Моложе 60 лет, без тромбозов в анамнезе
Ацетилсалициловая кислота в низких дозах
Флеботомия
Согласно рекомендациям ELN, возможность назначения циторедуктивной терапии у пациентов с низким риском стоит рассмотреть при наличии спленомегалии, прогрессировании лейкоцитоза и тромбоцитоза, отсутствии контроля симптомов, плохой переносимости флеботомии или частой потребности в ней10
Высокий риск10,11Старше 60 лет +/-тромбозы в анамнезе
Ацетилсалициловая кислота в низких дозах
Флеботомия
Бусульфан
Гидроксикарбамид
Интерфероны
Руксолитиниб
Антиагрегантная терапия
В настоящее время всем пациентам с ИП рекомендуется прием препаратов кислоты в низких дозах (40–320 мг в сутки)13.
В исследовании ECLAP(n=518)показана эффективность такого режима дозирования ацетилсалициловой кислоты14.
Применявшиеся в прошлом высокие дозы ацетилсалициловой кислоты приводили в высокой частоте кровотечений из желудочно-кишечного тракта.
При непереносимости возможно применение клопидогрела 75 мг в сутки. При неэффективности клопидогрела назначают тикагрелор 90 мг в сутки.
Доступные терапевтические опции13-16
Симптоматическая терапия
Спленэктомия является паллиативным методом лечения, может сопровождаться осложнениями и летальным исходом. В связи с этим спленэктомия применяется только в экстренных случаях: например, разрыв селезенки, спленомегалия с компрессионным синдромом, резистентная к циторедуктивной терапии, при лечении портальной гипертензии и наличии рецидивирующего кровотечения из варикозно-расширенных вен пищевода.
К симптоматическим мерам при кожном зуде относят применение антигистаминных препаратов, увлажнение кожи, ПУВА-терапия.
Флеботомия
-
Флеботомия (кровопускание) — забор крови с целью уменьшения массы циркулирующих эритроцитов17,18
-
Поддержание целевого уровня гематокрита улучшает циркуляцию крови и снижает риск тромбозов и острых событий9,17-20
-
Флеботомия снижает выраженность симптомов
-
Наилучший эффект флеботомии достигается среди пациентов низкого риска на ранних стадиях болезни
-
Прогрессирование болезни зачастую требует назначения циторедуктивной терапии9,17,20
-
Флеботомия не должна проводиться чаще одного раза в три месяца.
-
Ссылка на изображение: t.ly/DXX7G
Ограничение использования флеботомии
-
Флеботомия не влияет на уровень тромбоцитов и лейкоцитов22,23 и не эффективна в достижении контроля над кожным зудом22,24.
-
Применение флеботомии может привести к изменению морфологии эритроцитов, вызвать реактивный тромбоцитоз22,24, а также приводить к снижению уровня липидов и глюкозы у больных сахарным диабетом25.
-
Может усиливать симптомы железодефицита27.
-
Длительное наблюдение (более 15 лет) продемонстрировало невозможность долговременного использования флеботомии для контроля ИП в силу:
-
высокого риска сосудистых и тромботических осложнений;
-
низкой комплаентности пациентов;
-
плохой переносимости;
-
высокого риска раннего перехода в пост-ИП МФ26.
-
Циторедуктивная терапия
Решение о назначении циторедуктивной терапии принимают на основании рекомендаций ELN.
Низкий риск10,11Моложе 60 лет, без тромбозов в анамнезе
Отсутствие контроля симптомов на фоне стандартной терапии, признаков прогрессирования, частой потребности в флеботомии (более одного раза в три месяца) или плохой переносимости процедуры.
Высокий риск10,11Старше 60 лет +/-тромбозы в анамнезе
Всем пациентам, выбор препарата определяется возрастом и линией терапии.
Доступные в России препараты:
-
Гидроксикарбамид
-
Интерферон
-
Бусульфан
-
Руксолитиниб
Распределение линий циторедуктивной терапии13
| 1-я линия → | 2-я линия → | 3-я линия | |
| <50 лет |
Гидроксикарбамид
Интерферон α
|
Гидроксикарбамид
|
Руксолитиниб
|
| 50–70 лет |
Гидроксикарбамид
|
Руксолитиниб
Интерферон α
|
Интерферон α
Руксолитиниб
|
| >70 лет |
Бусульфан
Гидроксикарбамид
|
Гидроксикарбамид
Бусульфан
|
Руксолитиниб
|
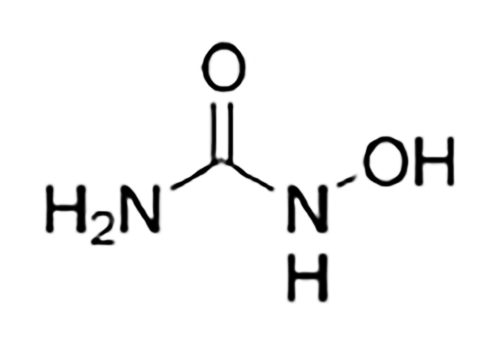
Гидроксикарбамид (гидроксимочевина)
-
Цитотоксическое и антинеопластическое действие28
-
Точный механизм мало изучен28
Гидроксикарбамид позволяет контролировать симптомы ИП, спленомегалию, тромбоцитоз и уровень гематокрита30.
Исторически является первым препаратом для циторедуктивной терапии у пациентов с ИП группы высокого риска22,31.
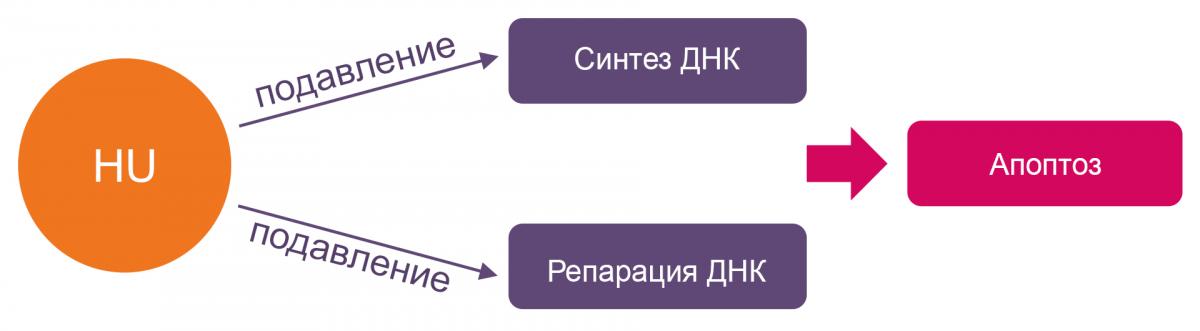
HU — гидроксимочевина
Нежелательные явления связаны с подавлением деления в здоровых клетках29.
Переносимость гидроксикарбамида
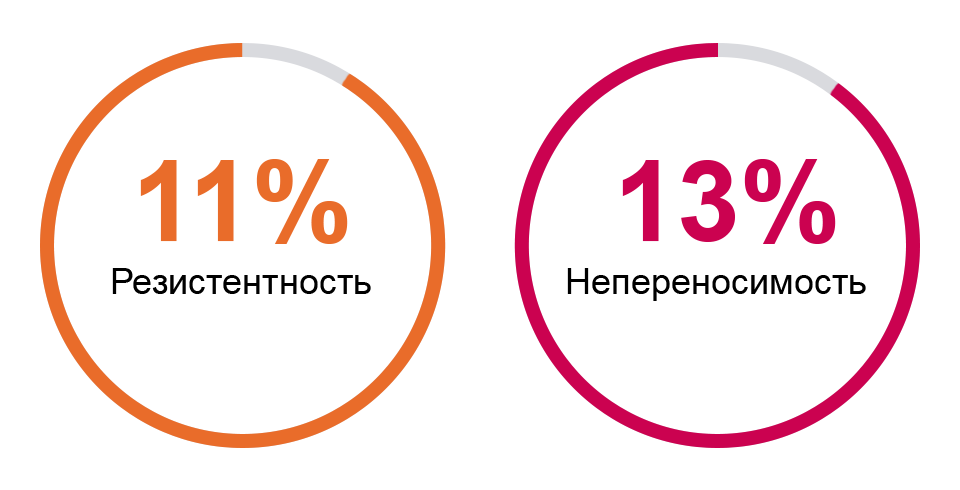
261 пациент, принимавший гидроксимочевину в среднем в течение 4,4 года.
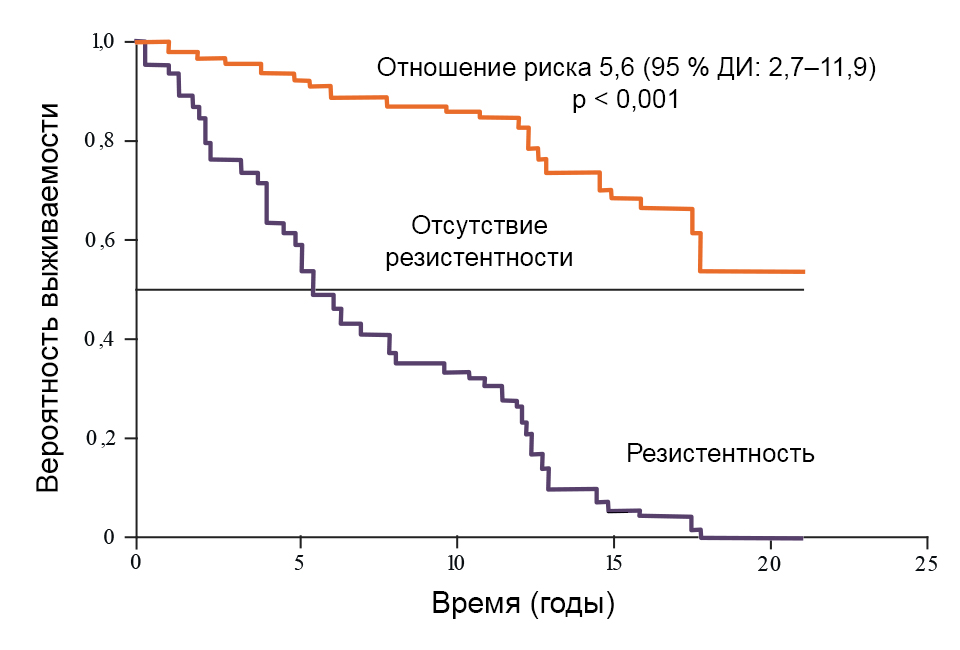
Медиана общей выживаемости у пациентов с развившейся резистентностью к гидроксимочевине составляет 1,2 года (диапазон 0,1–4,3).
НЯ — нежелательное явление, ГМ — гидроксимочевина
Оценка переносимости и резистентности к гидроксимочевине на основании рекомендаций ELN
Резистентность к ГМ
-
Потребность во флеботомии для поддержания гематокрита <45% после трех месяцев приема ГМ в дозе ≥2 г/сут.
-
Неконтролируемая миелопролиферация (тромбоциты >400 x 109/л и лейкоциты >10 x 109/л) после трех месяцев приема ГМ в дозе ≥2 г/сут.
-
Отсутствие редукции размера селезенки при выраженной спленомегалии на >50% при пальпаторной оценке или невозможность достижения полной клинической ремиссии после трех месяцев приема ГМ в дозе ≥2 г/сут.
Непереносимость ГМ
-
Число нейтрофилов <1,0 x 109/лилитромбоцитов <100 x 109/л,илигемоглобин <100 г/л на фоне приема минимальной дозы ГМ, необходимой для достижения полного или частичного клинико-гематологического ответа.
-
Язвы на нижних конечностях или неприемлемая негематологическая токсичность, включая проявления на коже и слизистых оболочках, симптомы со стороны ЖКТ, пневмонит или наличие лихорадки на фоне приема любой дозы ГМ.
ГМ — гидроксимочевина
Переносимость гидроксикарбамида
Нежелательные явления на фоне приема ГМ у 133 больных ИП по данным больше 2 лет наблюдения34.

Более одного из восьми пациентов с ИП, принимающих ГМ, страдают от непереносимости в соответствии с критериями ELN2.35.
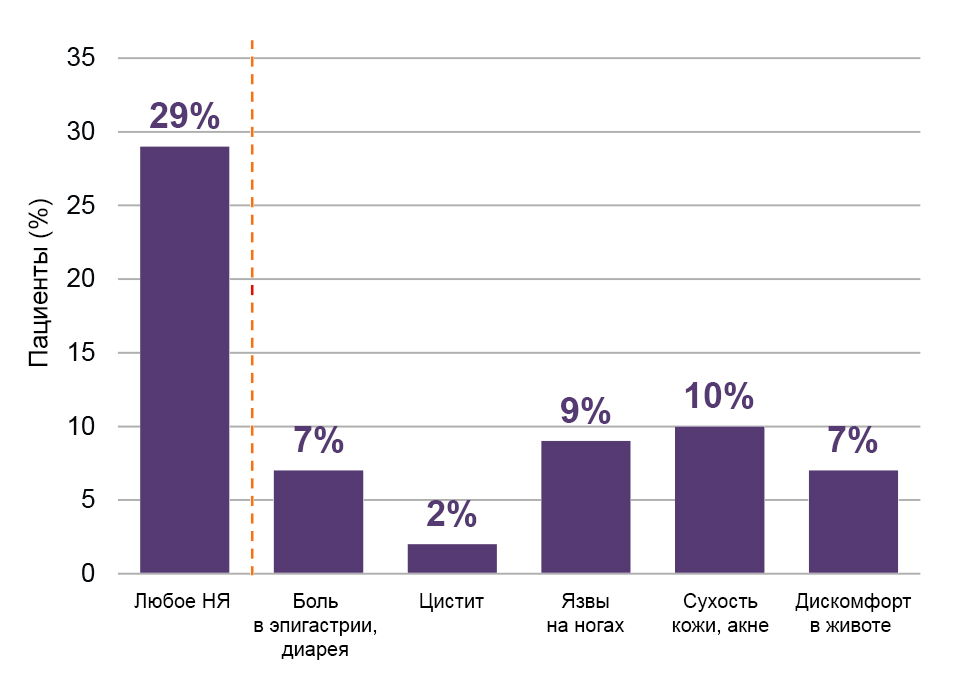
НЯ — нежелательное явление, ГМ — гидроксимочевина
Влияние терапии на исходы в исследовании ECLAP36,37
При терапии гидроксимочевиной у ряда пациентов сохраняется относительно высокий риск смерти и осложнений.
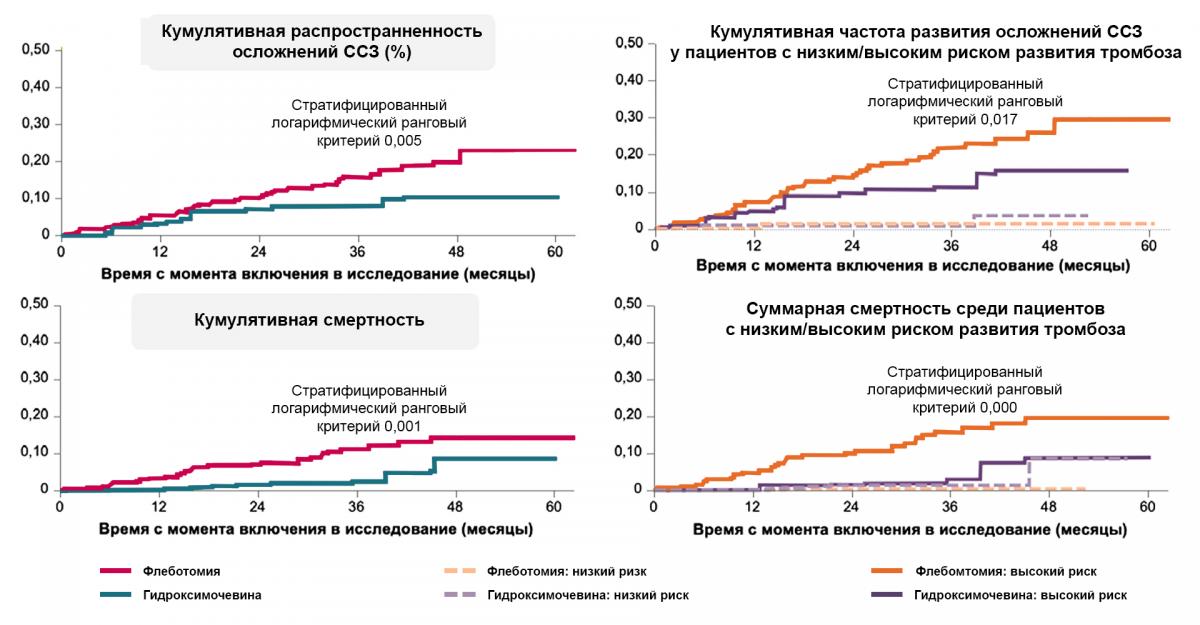
ССЗ — сердечно-сосудистые заболевания
Применение препаратов интерферона
-
ИФН-aоказывает антипролиферативное и проапоптотическое действие.
-
Несколько исследований показали, что ИФН-aподавляет активность теломеразы.
-
У пациентов с низким уровнем NK-клеток ИФН-aвызывает рост уровня CD56+ и снижение числа CD56-.
-
На фоне терапии ИФН-aповышается число регуляторных Т-лимфоцитов.
-
Механизмы действия ИФН-aу больных ИП требуют более детального изучения.
-
ИФН-a является средством циторедуктивной терапии, которое применяется для лечения ряда злокачественных и вирусных заболеваний более 25 лет39-41.
-
ИФН-a обладает неблагоприятным профилем токсичности и плохо переносится больными.
-
Пегилированный ИФН-aобладает лучшим профилем безопасности и переносится лучше ИФН-a39,40,42,43.
-
Частота отмены терапии Пег-ИФН-a:15–25%.
-
Частота отмены терапии ИФН-a: 14–42%.
-
-
ИФН-a не должен использоваться у пациентов, резистентных или не толерантных к терапии ГМ10,11.
-
Проведенные исследования не доказали преимущества Пег-ИФН-aв отношении долговременных исходов и выживаемости пациентов при сравнении с ГМ44,45.
-
Пегилированный интерферон-aв настоящее время не зарегистрирован в РФ для терапии ИП.
-
ИНФ-a — интерферон-а; ИП — истинная полицитемия; NK — клетки—натуральные киллеры
Влияние рекомбинантного интерферона на ОВ и вторичный миелофиброз
Цель Исследования
-
Оценить влияние рИНФ-a (n = 75) ОВ и частоту прогрессии в пост-ИП МФ в сравнении с флеботомией (n = 60) и ГМ (n = 134).
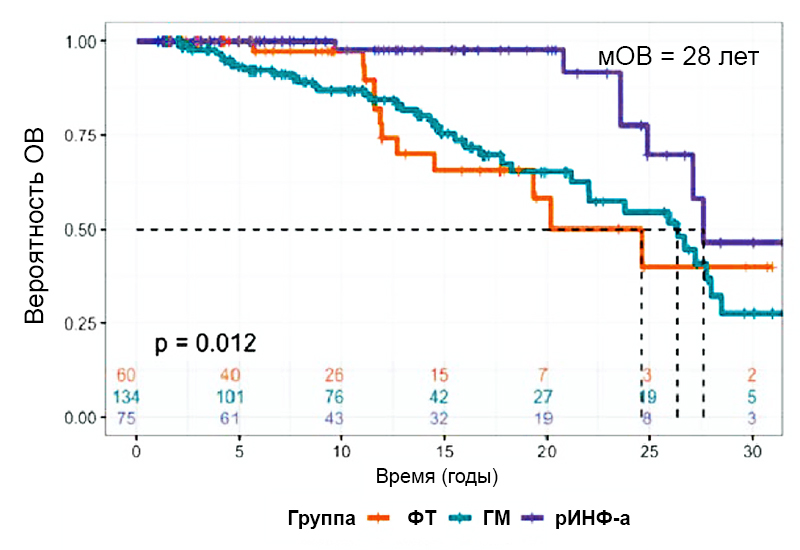
Результаты
-
Применение рИНФ-aприводило к снижению риска смерти на 8% (ОР=0,92, p<0,01) и пост-ИП МФ на 7 % (ОР = 0,93, p=0,01).
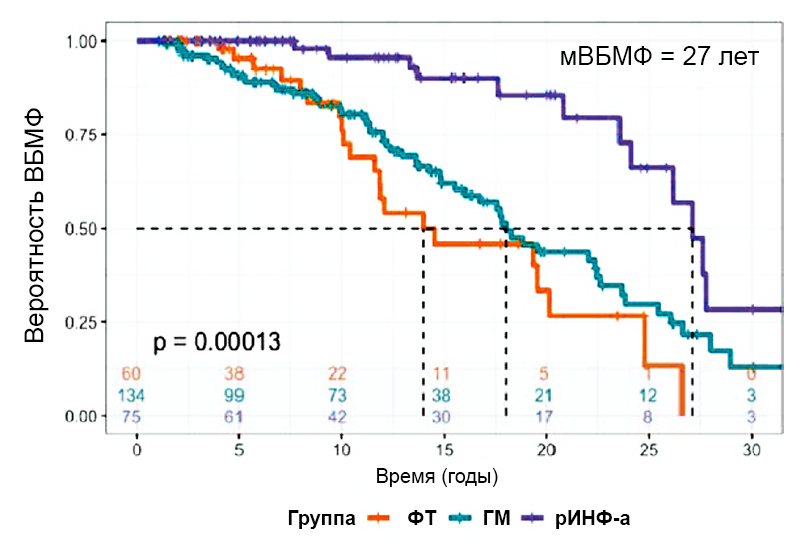
ОВ — общая выживаемость; ВБМФ — выживаемость без миелофиброза; ФТ — флеботомия; рИНФ-a — рекомбинантный интерферон-а; пост-ИП МФ — постполицитемический миелофиброз
Эффективность традиционной терапии: резюме
В настоящее время существуют классические опции терапии для пациентов с ИП низкого и высокого риска
В то же время традиционные методы терапии связаны с риском непереносимости и токсичности
ГМ, флеботомия и антиагрегантная терапия позволяют добиться контроля над симптомами заболевания и снизить риск осложнений
Среди классических методов лечения ИП отсутствовали стратегии эффективной терапии пациентов, резистентных к ГМ
- Mesa et al. Poster presentation at ASH Annual Congress; Dec 06-09, 2015. Abstract 4827.
- Tefferi A, Barbui T. Am J Hematol. 2015;90:162-73.
- Gangat N, et al. J Clin Oncol. 2011;29:392-7.
- Passamonti F, et al. Leukemia. 2010;24:1574-9.
- Passamonti F, et al. Blood. 2008;111:3383-7.
- National Cancer Institute. SEER Stat Fact Sheets. Leukemia—Acute Myeloid Leukemia. Available from: httрs://sееr.cancer.gov/statfacts/html/amyl.html. Accessed June 24, 2019.
- Tallarico et al. Curr Hematol Malig Rep.2015 Jun;10(2):112-7.
- Tefferi A, et al. Leukemia. 2013;27:1874-81.
- Marchioli R, et al. N Engl J Med. 2013;368:22-33.
- Barbui T, et al. J Clin Oncol. 2011;29:761-70.
- Barbui T, et al. Leukemia. 2018;32:1057-69.
- Spivak JL. Polycythemia vera and other myeloproliferative diseases. In: Longo D, et al., editors. Harrison’s principles of internal medicine, 18th ed. New York: McGraw-Hill: 2012; p. 898-904.
- Меликян А.Л. с соавт. Национальные клинические рекомендации по диагностике и терапии Ph-негативных миелопролиферативных заболеваний. Редакция 2018.
- Landolfi R, et al. N Engl J Med. 2004;350:114-24.
- Logan MS, et al. Am Surg. 2009;75:363-8.
- NHS. Available from: www.пhs.uk/соnditiоns/Itching/Pages/Treatment.aspx.Accessed May 2019.
- Tibes R, Mesa RA. Expert Opin Emerg Drugs. 2013;18:393-404.
- Passamonti F. Blood. 2012;120:275-84.
- Leukemia & Lymphoma Society. Available from: www.!Is.оrg/sitеs/default/files/file_assets/FS13_PolycythemiaVera_FactSheet.pdf. Accessed May 2019.
- Marchioli R, et al. Thrombosis. 2011;2011:794240.
- Tefferi A, Spivak JL. Semin Hematol. 2005;42:206-20.
- Passamonti F. Blood. 2012;120:275-84.
- PrchalJT, Prcha l JF. Polycythemia vera. In: Lichtman MA, et al. Williams hematology, 8th ed. Available from: httрs://accessmеdicine.mhmedical.com/book.aspx?bookid=358. Accessed May 2019.
- Hensley B, et al. Expert Opin Pharmacother. 2013;14:609-17.
- Bofill C, et al. Metabolism. 1994;43:614-20.
- Najean Y, et al. Br J Haematol. 1994;86:233-5.
- Ginzburg et al. Leukemia. 2018 Oct;32(10):210 5-2116.
- Singh A, Xu Y-J. Genes. 2016;7(11):99.
- Spivak JL, Hasselbalch H. Expert Review of Anticancer Ther. 2014;11(3):403-414.
- Alvarez-Larrán A, et al. Blood. 2012;119:1363-9.
- Prchal JT, Prchal JF. Polycythemia vera. In: Lichtman MA, et al. Williams hematology, 8th ed. Available from: https://асcеssmedicine.mhmedical.com/book.aspx?bookid=358. Accessed May 2019.
- Alvarez-Larrán A, et al. Br J Haematol. 2016;172:786-93.
- McMullin MF, et al. Br J Haematol. 2019;184:176-91.
- Najean Y, Rain J-D. Blood. 1997;90(9):3370-3377.
- Alvarez-Larrán A et al. Blood. 2012;119(6):1363-1369.
- Barbui T, et al. Am J Hematol. 2017;92:1131-6.
- Barbui T, et al. Blood Cancer J. 2018;8:124.
- Hasselbach et al. Semin Immunopathol. 2019 Jan;41(1):5-19
- Kiladjian JJ, et al. Blood. 2011;117:4706-15.
- Pestka S. J Biol Chem. 2007;282:20047-51.
- Barosi G, et al. Expert Opin Pharmacother. 2011;12:1597-611.
- Mascarenhas J, et al. Haematologica. 2014;99:945-9.
- Foster GR. Drugs. 2010;70:147-65.
- Crisà E, et al. J Hematol Oncol. 2017;10:15.
- Tefferi A. Am J Hematol. 2016;91:50-8.
- Zeinah G, et al. Poster presentation at ASH Annual Congress, 7-10 Dec 2019, [2942].
667427/HEMA/DIG/06.2023/0
