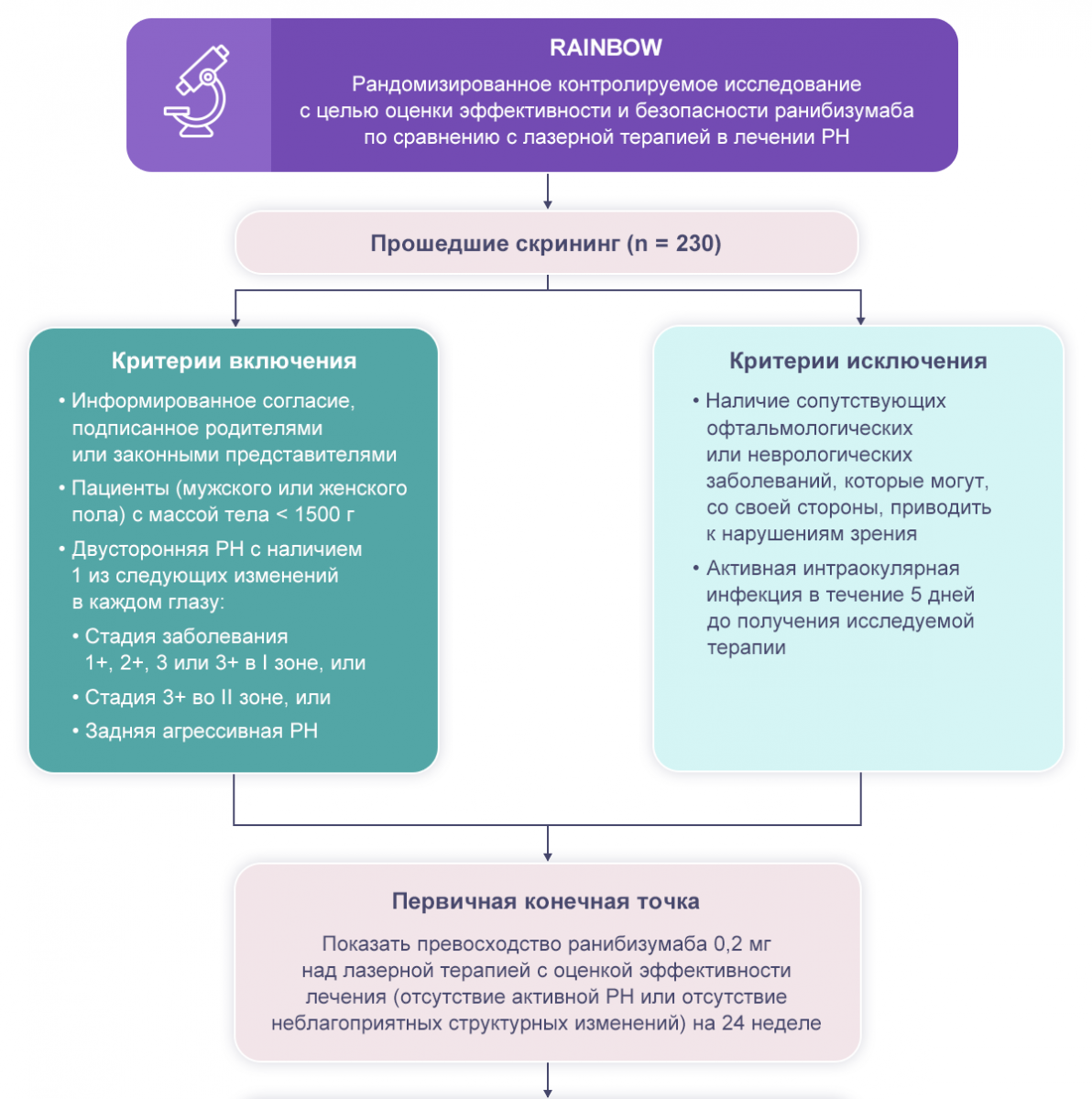
На данный момент продолжается многоцентровое рандомизированное контролируемое исследование RAINBOW, направленное на определение эффективности и безопасности препарата ранибизумаб по сравнению с лазеркоагуляцией сетчатки для лечения ретинопатии недоношенных (РН)1.
Дизайн исследования
Критерии включения в исследование:
-
информированное согласие, данное родителями или законными представителями пациента;
-
масса тела пациента до 1500 г;
-
двусторонняя РН с наличием одного из перечисленных изменений в каждом глазу — первая, вторая или третья стадия РН в первой зоне с «плюс-болезнью», третья стадия РН в первой зоне без «плюс-болезни», третья стадия во второй зоне с «плюс-болезнью» или наличие задней агрессивной РН.
Из исследования исключались пациенты с сопутствующими офтальмологическими и неврологическими заболеваниями, которые могли приводить к нарушению зрения и искажению результатов. Также к критериям исключения отнесли активную внутриглазную инфекцию в течение пяти дней до получения терапии.
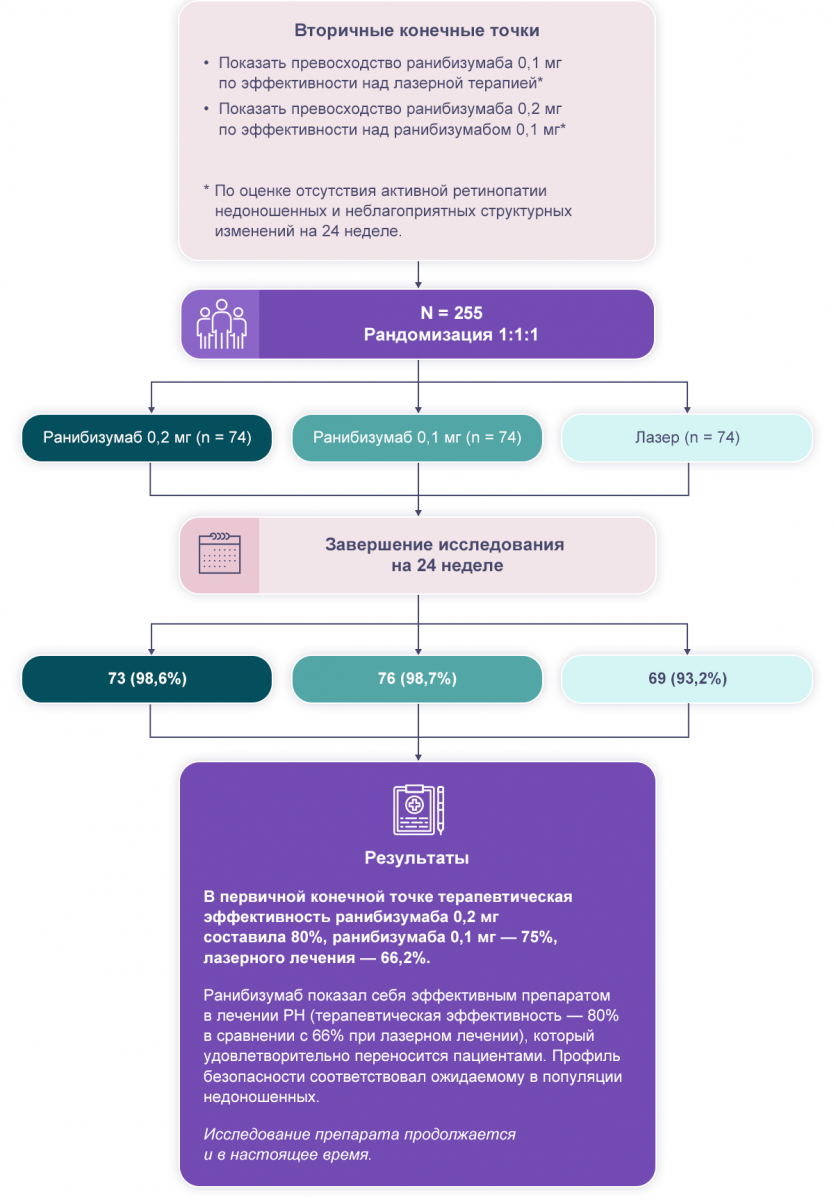
В ходе исследования RAINBOW проводилось и продолжает проводиться сравнение трех параллельных групп пациентов с оценкой первичной конечной точки на 24 неделе исследования с возможностью продлить наблюдение для мониторинга долгосрочных результатов.
Характеристики пациентов
В первую группу были включены пациенты, которые получили ранибизумаб 0,2 мг в каждый глаз в первый день исследования и могли получить до двух дополнительных инъекций в каждый глаз с интервалом не менее 28 дней между инъекциями по показаниям. Вторая группа отличалась дозировкой ранибизумаба — 0,1 мг препарата. В третью группу были включены пациенты с лазерным лечением.
Исходные характеристики пациентов представлены в таблице 1.
Таблица 1 — Исходные характеристики пациентов
| Характеристики | Ранибизумаб 0,2 мг, n = 74 | Ранибизумаб 0,1 мг, n = 77 | Лазер, n = 74 |
| Географический регион, n (%) | |||
| Регион 1 | 45 (60.8) | 45 (58.4) | 44 (59.5) |
| Регион 2 | 29 (39.2) | 32 (41.6) | 30 (40.5) |
| Пол, n (%) | |||
| Женский | 41 (55.4) | 40 (51.9) | 37 (50.0) |
| Раса или этническое происхождение матери, n (%) | |||
| Европеоидная | 43 (58.1) | 45 (58.4) | 45 (60.8) |
| Темнокожая | 0 (0.0) | 4 (5.2) | 6 (4.1) |
| Азиатская | 27 (36.5) | 22 (28.6) | 23 (31.1) |
| Другое | 4 (5.4) | 6 (7.8) | 3 (4.1) |
| Гестационный возраст, медиана (недели) | 25 (23–32) | 26 (23–32) | 26 (23–32) |
| Гестационный возраст, распределение по группам, n (%) | |||
| ≤ 24 недели | 32 (43.2) | 22 (28.6) | 29 (39.2) |
| > 24 — < 27 недели | 18 (24.3) | 21 (27.3) | 17 (23.0) |
| ≥ 27 недели | 24 (32.4) | 34 (44.2) | 28 (37.8) |
| Масса тела при рождении, г | |||
| Среднее | 791 (244) | 886 (299) | 831 (284) |
| Количество детей при рождении, n (%) | |||
| Единственный ребенок | 52 (70.3) | 55 (71.4) | 48 (64.9) |
| Близнецы | 18 (24.4) | 18 (23.4) | 18 (24.3) |
| Отсутствие данных | 4 (5.4) | 4 (5.2) | 8 (10.8) |
| Постконцептуальный возраст при получении терапии, медиана (диапазон в неделях) | 36.7 (30.3–51.9) | 36.9 (31.9–54.9) | 36.6 (30.6–55.3) |
Результаты
В исследовании приняли участие 225 пациентов, из них 218 завершили его на 24 неделе, как запланировано. 7 пациентов выбыли из исследования по следующим причинам: 3 — по решению врача, 2 — по решению родителей или опекунов, 1 — из‑за нежелательных явлений (пациент находился в группе, получавшей лазерное лечение), 1 — из-за выпадения из‑под наблюдения (группа лазерного лечения).
В ходе исследования было выявлено, что РН чаще локализовалась во второй зоне (59,7–62,2% во всех группах). У 60% всех пациентов во второй зоне наблюдалась третья стадия РН с «плюс-болезнью».
Оценка эффективности
В первичной конечной точке терапевтическая эффективность ранибизумаба 0,2 мг составила 80%, ранибизумаба 0,1 мг — 75%, лазерного лечения — 66,2%.
Критериями недостижения первичной конечной точки стали:
-
активная РН (3 пациента в группе ранибизумаба 0,1 мг);
-
неблагоприятные структурные изменения (1 пациент в группе ранибизумаба 0,2 мг, 5 пациентов в группе ранибизумаба 0,1 мг, 7 пациентов в группе лазерного лечения);
-
переключение на другую терапию (11, 13 и 18 пациентов соответственно);
-
смерть пациента (по 4 случая в каждой группе).
Стоит отметить, что частота неблагоприятных структурных изменений была наиболее низкой в группе ранибизумаба 0,2 мг2.
Оценка безопасности
Был также проведен анализ безопасности в трех группах лечения с исследованием офтальмологических серьезных нежелательных явлений (СНЯ) и неофтальмологических СНЯ, развившихся в промежуток времени после начала лечения до завершения исследования.
Частота офтальмологических СНЯ составила в первой группе 5,5%, во второй — 2,3%, в третьей — 5,8% и была представлена развитием РН, катарактой, нистагмом, эндофтальмитом и экзофтальмом. Неофтальмологические СНЯ были отмечены также во всех группах лечения: 32,9% — в первой группе, 31,6% — во второй, 31,9% — в третьей группе.
Список источников:
- Stahl A, Lepore D, Fielder A, et al. Ranibizumab versus laser therapy for the treatment of very low birthweight infants with retinopathy of prematurity (RAINBOW): an open‑label randomised controlled trial. Lancet. 2019 Sep 12. pii: S0140-6736(19)31344-3. doi: 10.1016/S0140-6736(19)31344-3.
- RAINBOW Study: RAnibizumab Compared With Laser Therapy for the Treatment of INfants BOrn Prematurely With Retinopathy of Prematurity (RAINBOW): https://clinicaltrials.gov/ct2/show/NCT02375971?term=RAINBOW&rank=1.
400909/LUX/WEB/03.23/0
