Трансплантация гемопоэтических стволовых клеток (ТГСК) — единственно возможный метод излечения талассемий, миелодиспластического синдрома (МДС), серповидноклеточной болезни, миелофиброза и апластической анемии.
Это вмешательство подразумевает взятие и инфузию гемопоэтических стволовых клеток, полученных из костного мозга или периферической крови. Такие клетки берут непосредственно из костного мозга при помощи многократных процедур аспирации из тазовых костей у находящегося под общим наркозом донора. Другими их источниками являются периферическая или пуповинная кровь1.
Варианты ТГСК
Выделяют следующие варианты ТГСК1:
-
Аллогенная — перенос гемопоэтических стволовых клеток от донора другому человеку.
-
Сингенная — перенос гемопоэтических стволовых клеток от донора к реципиенту, который является генетически идентичным близнецом.
-
Аутологичная — гемопоэтические стволовые клетки берут из костного мозга и/или периферической крови самого пациента.
Аллогенная и сингенная трансплантация стволовых клеток
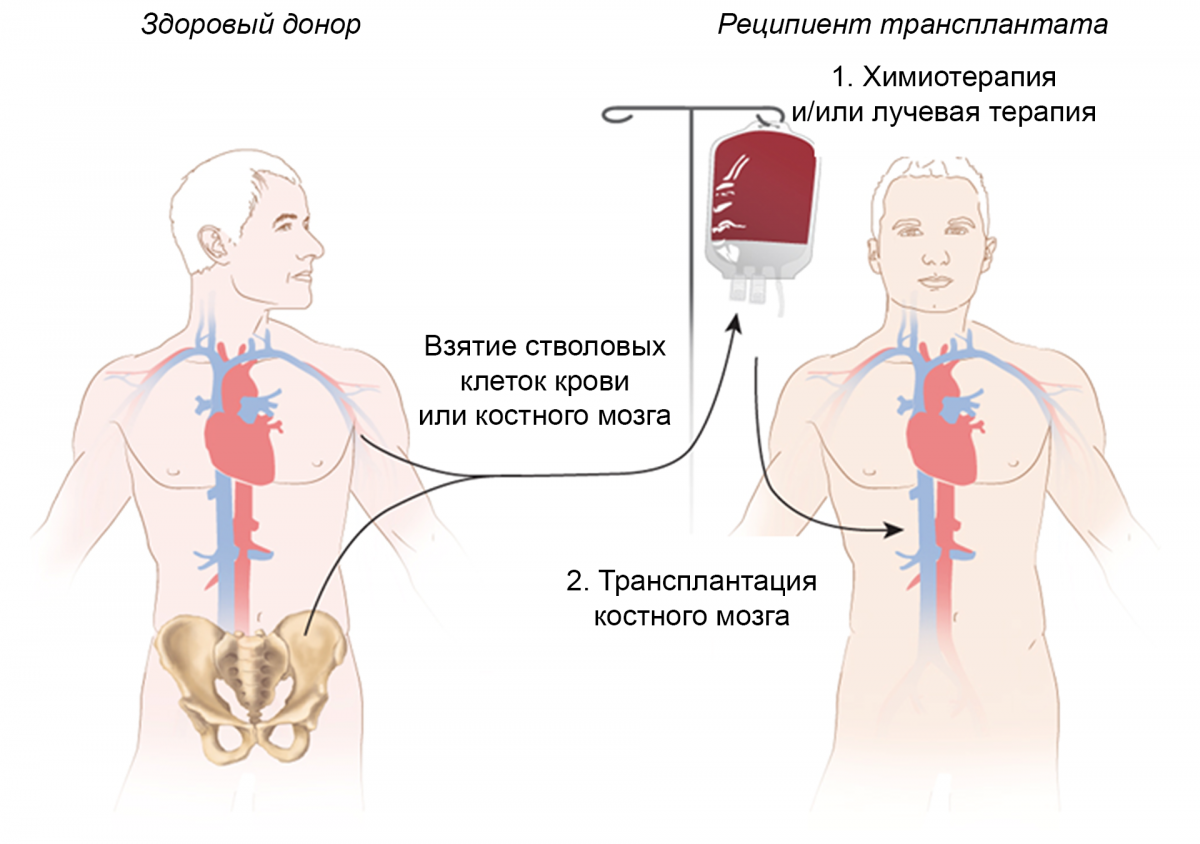
Аллогенная трансплантация стволовых клеток костного мозга или периферической крови — наиболее частый вариант ТГСК (Рисунок 1). В комплексе с миелоаблацией ее применяют обычно у пациентов младше 60 лет. Люди более старшего возраста имеют риск неблагоприятных исходов, в том числе развития болезни «трансплантат против хозяина».
Чтобы минимизировать риск осложнений, был разработан метод аллогенной трансплантации стволовых клеток со сниженной интенсивностью миелоаблации. Эта процедура не вызывает полной аблации костного мозга и более предпочтительна для пациентов старшего возраста и имеющих противопоказания к ТГСК с полной миелоаблацией.
Принимая решение о варианте ТГСК в каждом клиническом случае, врачу необходимо учитывать ряд факторов, включая хронологический и физиологический возраст пациента1.
Рисунок 1. Аллогенная/сингенная трансплантация гемопоэтических стволовых клеток1
Аутологичная трансплантация гемопоэтических стволовых клеток
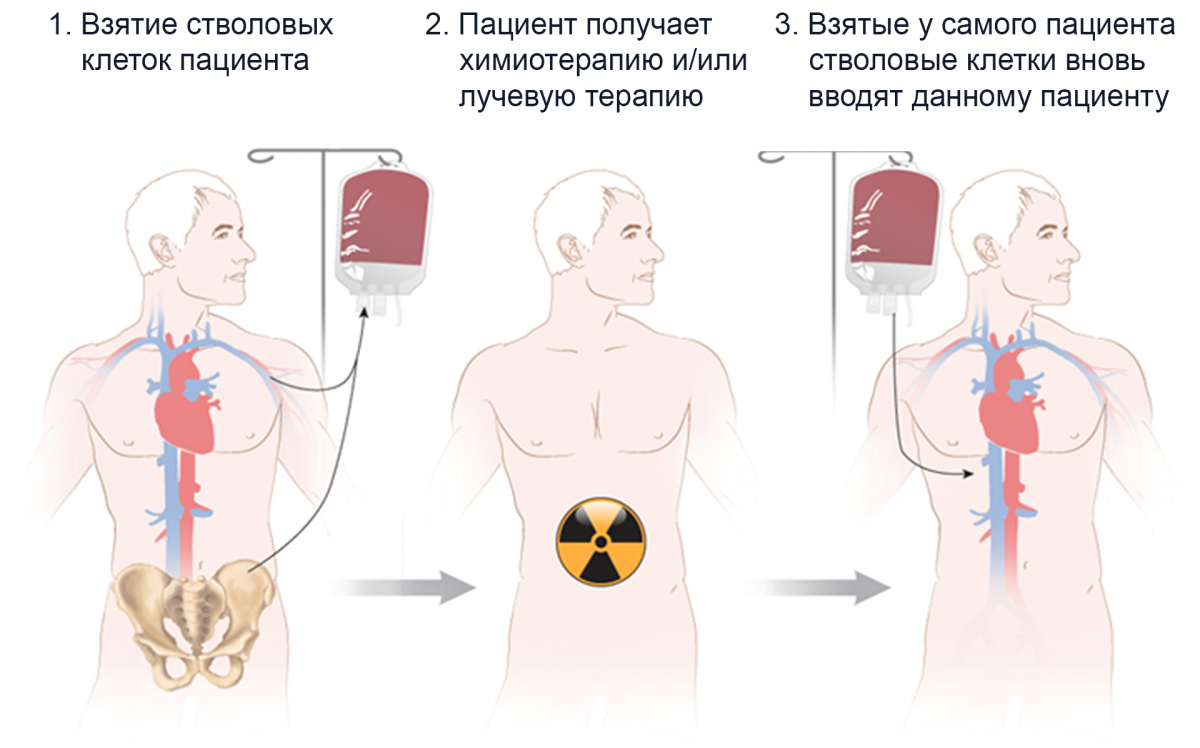
При аутологичной ТГСК собственные гемопоэтические стволовые клетки пациента берут из костного мозга, периферической крови или обоих источников и повторно вводят с целью восстановления функции костного мозга после высокодозной химиотерапии в сочетании с тотальным облучением или без него (Рисунок 2).
Одно из главных преимуществ аутологичной трансплантации — отсутствие болезни «трансплантат против хозяина», поскольку именно это осложнение является основной проблемой у пожилых пациентов. Плюс — не требуется поиск подходящего донора. К недостаткам же процедуры относят риск контаминации гемопоэтических стволовых клеток жизнеспособными опухолевыми клетками и отсутствие эффектов «трансплантат против опухоли». Кроме того, пациенты после аутологичной трансплантации, в отличие от аллогенной, имеют более высокую частоту рецидивов. Однако меньшая частота других осложнений обеспечивает схожие результаты в отдаленной перспективе1.
Рисунок 2. Аутологичная трансплантация гемопоэтических стволовых клеток1
Распространенные осложнения
К наиболее частым осложнениям ТГСК относят инфекции, реакции, связанные с токсичностью, болезнь «трансплантат против хозяина», отторжение трансплантанта, а также перегрузку железом у реципиентов.
Инфекции
Инфекции — основная причина осложнений и смерти пациентов после ТГПК. Это особенно характерно для аллогенной трансплантации из-за продолжительной иммуносупрессии. Иммуносупрессия необходима для профилактики и терапии болезни «трансплантат против хозяина».
Бактериальные инфекции обычно развиваются при использовании центральных венозных катетеров. У пациентов, получающих длительную терапию стероидами в высоких дозах при лечении болезни «трансплантат против хозяина», часто развиваются грибковые инфекции, вызываемые Aspergillus. Вирусные инфекции чаще ассоциированы с цитомегаловирусом, герпесвирусом человека типа 6, вирусом Эпштейна-Барр и сезонными респираторными вирусами1.
Кардиотоксичность
У небольшого количества больных при ТГСК может возникнуть кардиотоксичность. Состояние развивается в острую фазу либо во время процедуры трансплантации, либо позднее. У пациентов с заболеваниями, локализованными рядом с перикардом, или получающих лучевую терапию данной области, возможен перикардиальный выпот. После применения высоких доз циклофосфамида не исключено развитие идиосинкратической или вирусной кардиомиопатии1.
Легочная токсичность
Бактериальная, грибковая или вирусная инфекции после ТГСК способствуют развитию легочной токсичности у данной категории больных. При лечении химиотерапевтическими средствами, например кармустином, возможно развитие индуцированного химиотерапией поражения легких. Для лечения этого состояния используют стероиды.
Пациенты, проходящие аллогенную ТГСК, имеют повышенный риск острого респираторного дистресс-синдрома взрослых, интерстициального пневмонита неизвестной этиологии и пневмонии, обусловленной цитомегаловирусной или грибковой инфекцией. Хроническая болезнь «трансплантат против хозяина» в легких может проявляться в форме облитерирующего бронхиолита с обструктивной пневмонией или без нее1.
Печеночная токсичность и веноокклюзионная болезнь
Веноокклюзионная болезнь печени (синдром синусоидальной обструкции) — наиболее распространенное осложнение со стороны печени. Синдром обусловлен поражением синусоидов печени часто с окклюзией венул печени. Его развитие наблюдают на фоне проведения химиотерапии и тотальной лучевой терапии, используемой в ходе режимов кондиционирования. Симптомы веноокклюзионной болезни печени включают желтуху, болезненную гепатомегалию, асцит и увеличение массы тела. Несмотря на возможное развитие прогрессирующей печеночной недостаточности и полиорганной системной недостаточности, по крайней мере у 70% пациентов наступает спонтанное выздоровление1.
Почечная токсичность
Болезнь «трансплантат против хозяина» может развиваться после аллогенной ТГСК, проявляясь симптомами со стороны кожи, печени и желудочно-кишечного тракта в течение первых 100 дней после трансплантации. Кожная симптоматика варьирует от макулопапулезной сыпи до генерализованной эритродермии или десквамации. Тяжесть поражения печени связана с повышением уровня билирубина, в то время как тяжесть нарушений со стороны желудочно-кишечного тракта определяют на основании количества эпизодов диареи в сутки.
У пациентов после трансплантации от неродственных доноров наблюдается повышение риска заболевания. Прочие факторы риска включают донора женского пола (в особенности многократно рожавшие женщины), пожилой возраст реципиента и серопозитивность донора или пациента по цитомегаловирусу1.
Отторжение трансплантата
Отторжение трансплантата возникает в том случае, когда иммунные клетки организма-хозяина атакуют и уничтожают трансплантированные клетки донора. Осложнение редко возникает после ТГСК с тщательным подбором родственного донора. Более часто можно наблюдать у пациентов после трансплантации от альтернативных доноров или после использования трансплантатов с объединением T-клеток. Менее вероятно отторжение трансплантата у не получавших трансфузии пациентов с апластической анемией1.
Перегрузка железом у реципиентов трансплантации гемопоэтических стволовых клеток
Перегрузка железом — распространенное осложнение реципиентов ТГСК. Трансфузия эритроцитарной массы по поводу хронической анемии является основной причиной перегрузки железом у этих больных. Кроме того, у пациентов с МДС и талассемиями неэффективный эритропоэз может приводить к избыточной абсорбции железа из кишечника2.
Повышение уровня ферритина сыворотки (наиболее часто применяемого суррогатного маркера запасов железа) может неблагоприятно влиять на общую выживаемость и осложнения у пациентов после трансплантации гемопоэтических стволовых клеток2.
Ранние осложнения перегрузки железом у реципиентов трансплантации гемопоэтических стволовых клеток включают инфекции и синдром синусоидальной обструкции. В долгосрочной перспективе перегрузка железом повышает риск развития фиброза печени и кардиомиопатии у выживших после трансплантации педиатрических пациентов с талассемиями, у которых после трансплантации гемопоэтических стволовых клеток была достигнута независимость от трансфузий, однако сохранились значительные запасы железа в организме. Были доказаны безопасность и эффективность деферазирокса у выживших пациентов после аллогенной трансплантации гемопоэтических стволовых клеток с хронической перегрузкой железом3.
Резюме
-
ТГСК включает в себя взятие и инфузию гемопоэтических стволовых клеток из костного мозга или периферической крови.
-
Трансплантация гемопоэтических стволовых клеток может быть аллогенной (перенос гемопоэтических стволовых клеток от донора другому лицу), сингенной (перенос гемопоэтических стволовых клеток от донора к реципиенту, который является генетически идентичным близнецом) или аутологичной (гемопоэтические стволовые клетки получают из костного мозга и/или периферической крови самого пациента).
-
Аллогенная трансплантация гемопоэтических стволовых клеток костного мозга или периферической крови является наиболее распространенным типом вмешательства.
-
Сингенная трансплантация гемопоэтических стволовых клеток между идентичными близнецами выполняется только примерно в 1% случаев.
-
Преимущество аутологичной трансплантации гемопоэтических стволовых клеток включает отсутствие болезни «трансплантат против хозяина», которая является основной проблемой у более пожилых пациентов, кроме того, не требуется искать подходящего донора.
-
Распространенные осложнения трансплантации гемопоэтических стволовых клеток включают инфекции, кардиотоксичность, легочную токсичность, токсичность в отношении печени и веноокклюзионную болезнь, почечную токсичность, болезнь «трансплантат против хозяина» и отторжение трансплантата.
-
У реципиентов трансплантации гемопоэтических стволовых клеток часто встречается перегрузка железом, основной причиной которой служат трансфузии эритроцитарной массы по поводу хронической анемии.
Литературные источники:
- Novartis Oncology. The Hidden Danger of Iron Overload Wireframe. IOE-1056818. Novartis Pharmaceuticals Corporation. 2013:1-79.
- Jakavi Summary of Product Characteristics. West Sussex, UK: Novartis Europharm Limited; October, 2012.
- Hoffman R, Rondelli D. Biology and treatment of primary myelofibrosis. Hematology Am Soc Hematol Educ Program. 2007;1:346-354.
667443/HEMA/DIG/06.2023/0
