Диабетический макулярный отек (ДМО) — утолщение сетчатки, связанное с накоплением жидкости в межклеточном пространстве нейроэпителия вследствие нарушения гематоретинальных барьеров и несоответствия между транссудацией жидкости и способностью к ее реабсорбции клетками пигментного эпителия. Заболевают преимущественно люди трудоспособного возраста (средний возраст — 50 лет) [1].
ДМО поражает около 7% пациентов с диабетом (до 24,6 млн чел.) по всему миру. У 2,8% пациентов ДМО приводит к снижению зрения (~ 10 млн чел. по всему миру) [1]. В России зарегистрировано 250 тыс. пациентов с ДМО [1].
1. International Diabetes Federation. Diabetes Atlas 10th Edition, 2021.
Патогенез
Основные причины развития и прогрессирования ДМО — это длительность течения, высокий уровень гликемии, повышенное АД и нарушение липидного обмена. Среди других факторов риска: возраст пациента, тип СД, состояние свертывающей системы крови, нефропатия, а также низкая физическая активность.
Ведущий патогенетический механизм ДМО — это неоваскуляризация под воздействием VEGF (vascular endothelial growth factor — фактор роста эндотелия сосудов). Новообразованные сосуды ломкие, что приводит к просачиванию жидкости в сетчатку и макулярному отеку. Все это ведет к выраженному нарушению зрения и потенциально может привести к слепоте [5].
Клинические симптомы
Пациенты могут жаловаться на затуманивание зрения, появление в центральном поле пятна и искажений.
Клинически при ДМО развиваются [3]:
- утолщение сетчатки;
- кистозный макулярный отек;
- серозная отслойка сетчатки;
- витреомакулярные тракции;
- твердые интраретинальные экссудаты.
Диагностика ДМО
Диагностика ДМО включает обязательные и дополнительные методы [4].
Обязательные методы
- Определение остроты зрения (визометрия);
- Измерение внутриглазного давления (тонометрия);
- Биомикроскопия переднего отрезка глаза;
- Офтальмоскопия при расширенном зрачке (рис. 1).
Дополнительные методы
- Фотографирование глазного дна;
- Флюоресцентная ангиография глазного дна;
- УЗИ при помутнении стекловидного тела и хрусталика;
- Электрофизиологические методы исследования функционального состояния зрительного нерва и нейронов сетчатки;
- Осмотр угла передней камеры глаза (гониоскопия);
- Исследование поля зрения (периметрия);
- Оптическая когерентная томография (ОКТ) сетчатки.
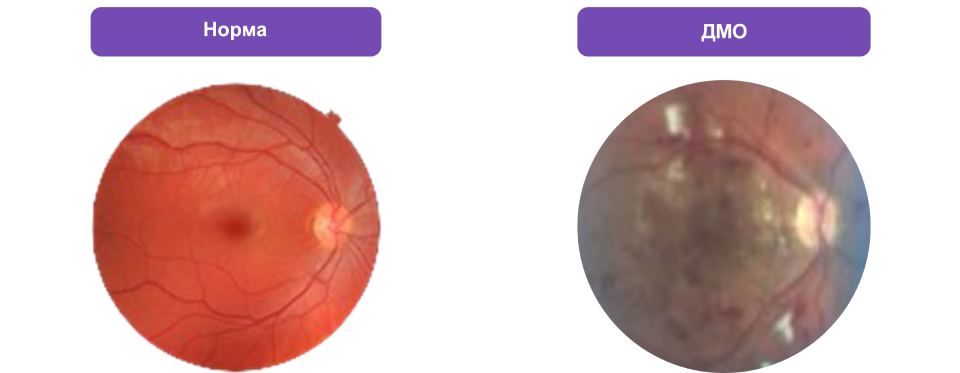
Рисунок 1. Исследование глазного дна при офтальмоскопии (норма и ДМО)
Классификация и определение степени тяжести
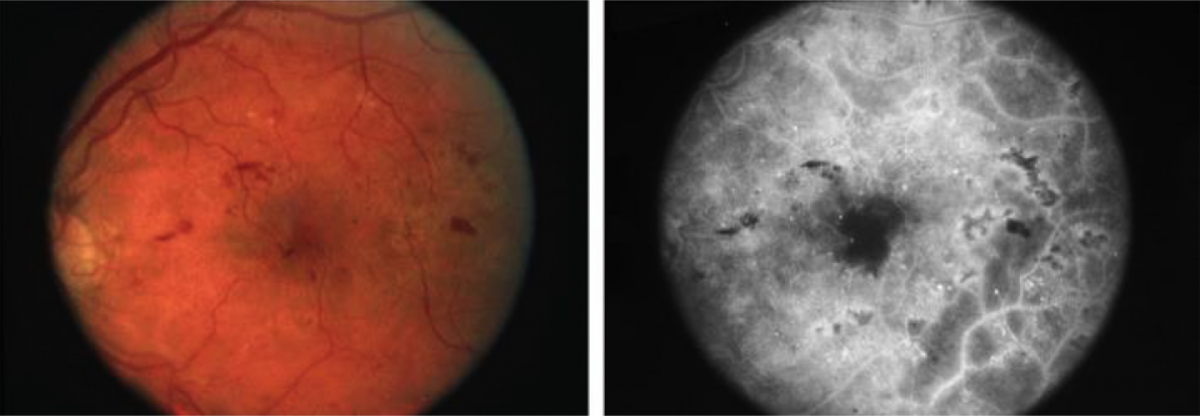
Выделяют два типа ДМО — фокальный и диффузный (рис. 2) [5].
Фокальный
Диффузный
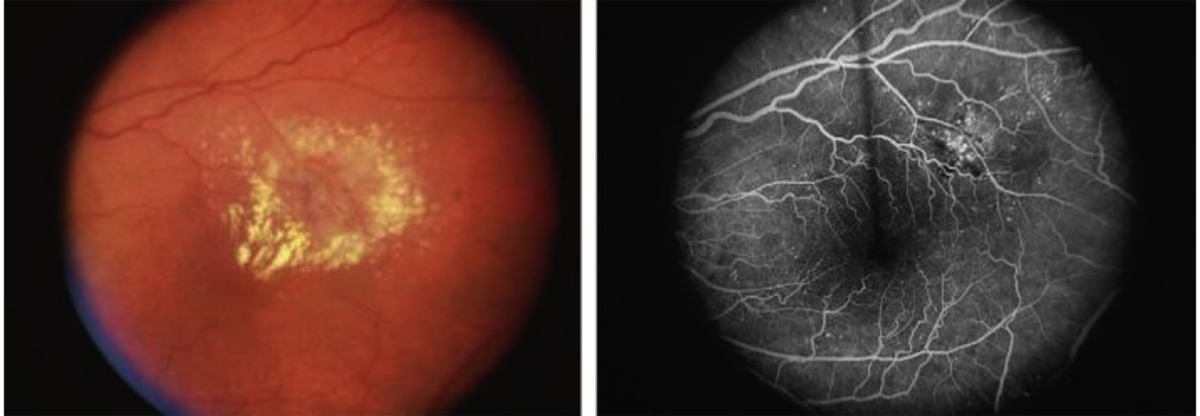
Рисунок 2. Картина фокального и диффузного типов ДМО при офтальмоскопии
Также выделяют губчатый и кистозный макулярный отек, субфовеолярную серозную и фовеолярную тракционную отслойку сетчатки.
Исследовательской группой по изучению раннего лечения ДР (ETDRS) введено понятие клинически значимого ДМО, критериями которого являются [15]:
- утолщение сетчатки и/или твердые экссудаты, захватывающие центр макулы;
- утолщение сетчатки и/или твердые экссудаты, расположенные ближе 500 мкм от центра макулы, но на него не распространяющиеся;
- утолщение сетчатки площадью 1 ДЗН или более, расположенное (хотя бы частично) ближе 1 диаметра диска от центра макулы. Кроме этого, принято выделять ДМО с вовлечением или без вовлечения центра. Макулярный отек с вовлечением центра определяется как утолщение сетчатки (ретинальный отек), затрагивающее центральную зону диаметром в 1000 мкм.
Общие принципы лечения
Для лечения ДМО используют медикаментозную терапию (анти-VEGF), лазерную коагуляцию и витрэктомию.
Рекомендуется междисциплинарное ведение пациента на всех стадиях ДР и ДМО с целью компенсации системных нарушений (нормализация уровня гликемии, артериального давления и показателей липидного обмена).
Не рекомендуется консервативное лечение пациентам с ДР и ДМО.
На всех стадиях ДР и ДМО должно проводиться лечение основного заболевания — СД, направленное на коррекцию метаболических нарушений.
Международный совет по офтальмологии рекомендует лечить ДМО следующим образом [7]:
Оптимизация медикаментозной терапии
Улучшение контроля гликемии при уровне HbA1c > 7,5%, а также сопутствующей системной гипертензии или дислипидемии.
Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. – 9-й выпуск. – М.: УП ПРИНТ; 2019.
ДМО без поражения центральной зоны
Возможно наблюдение до развития поражения центральной зоны или проведение фокальной ЛК микроаневризм с ликиджем, если утолщение центральной зоны «угрожает» фовеа.
При наличии ДМО наибольший эффект от лазерного лечения ожидается в случае исходной центральной толщины сетчатки не более 350 мкм.
В остальных случаях лазерное лечение ДМО существенно уступает по функциональному результату лечению ингибиторами ангиогенеза.
ДМО с поражением центральной зоны и хорошей ОЗ (выше 6/9 или 20/30)
В проводимых в настоящее время клинических исследованиях изучается 3 опции:
- тщательное наблюдение с анти-VEGF-терапией только в случае ухудшения ДМО;
- интравитреальные инъекции анти-VEGF-препаратов;
- ЛК с анти-VEGF при необходимости.
ДМО с поражением центральной зоны в сочетании со снижением зрения (6/9 или 20/30 и хуже)
Интравитреальная анти-VEGF-терапия:
- ранибизумаб — 0,5 мг;
- афлиберцепт — 2 мг;
- бролуцизумаб — 6 мг.
ДМО в сочетании с пролиферативной ДР
- Монотерапия интравитреальными анти-VEGF-препаратами с последующей оценкой необходимости проведения панретинальной ЛК.
- Продолжение анти-VEGF-терапии после разрешения ДМО.
Витреомакулярные тракции или эпиретинальная мембрана по ОКТ
Может быть показана pars plana витрэктомия.
Европейское общество специалистов по сетчатке также дает свои рекомендации [8]:
- Более благоприятно раннее начало лечения пациентов с ДМО.
- В качестве первой линии терапии предпочтительно выбирать анти-VEGF-терапию.
- ЛК — больше не «стандарт лечения».
- Стероиды преимущественно рассматриваются как терапия второй линии.
Пациентов целесообразно переводить на стероиды, если они не отвечают на анти-VEGF-препараты после 3–6 инъекций. Ориентироваться следует на индивидуальный ответ каждого пациента.
В качестве первой линии терапии стероиды можно применять:
- у пациентов с тяжелыми сердечно-сосудистыми событиями в анамнезе;
- у пациентов, не желающих получать ежемесячные инъекции и/или проходить мониторинг в первые 6 месяцев терапии.
В обоих случаях применения стероидов необходимо контролировать внутриглазное давление.
Лечение ДМО анти-VEGF-препаратами
При анти-VEGF-терапии важно выбирать препараты, которые селективно воздействуют на сетчатку и не оказывают эффект на системный VEGF.
В настоящее время основные анти-VEGF-препараты — это ранибизумаб, афлиберцепт и бролуцизумаб. При этом у ранибизумаба в отличие от афлиберцепта отсутствует Fc-фрагмент, который отвечает за выведение препарата из глаза в системный кровоток. Концентрация ранибизумаба в стекловидном теле приблизительно в 90 тыс. раз выше, чем в плазме крови.
Ранибизумаб селективно действует на сетчатку и быстрее других ингибиторов ангиогенеза выводится из системного кровотока — за 2 часа. Это минимизирует его воздействие на системный VEGF [9].
Эффективность терапии ранибизумабом была доказана в различных клинических исследованиях: RISE & RIDE [10,11], PROTOCOL I [12–15], RESTORE [16], REVEAL [17], REFINE [18], RETAIN [19]. Они показали, что в течение 5 лет терапии у пациентов устойчиво улучшалась острота зрения (ОЗ) и снижалась потребность в ежемесячном введении препарата, то есть уменьшалось количество вводимых инъекций. При этом улучшение ОЗ достигалось даже у пациентов с исходно низкой ОЗ (20/50 и ниже).
В реальной клинической практике [20] терапия ранибизумабом приводила к повышению средней ОЗ к 12 месяцу до 61,3 буквы, почти 76% пациентов достигли остроты зрения ≥ 69 букв, среднее увеличение МКОЗ составило 3,5 буквы. При этом в среднем пациенты получали 4,5 инъекции.
Результаты по ОЗ были более благоприятными у пациентов, получивших загрузочные инъекции ранибизумаба [20]. Лучшие результаты показали пациенты, получавшие более 4 инъекций в течение года. При этом позднее начало и недостаточное количество инъекций определяло менее благоприятные результаты лечения.
Терапия бролуцизумабом
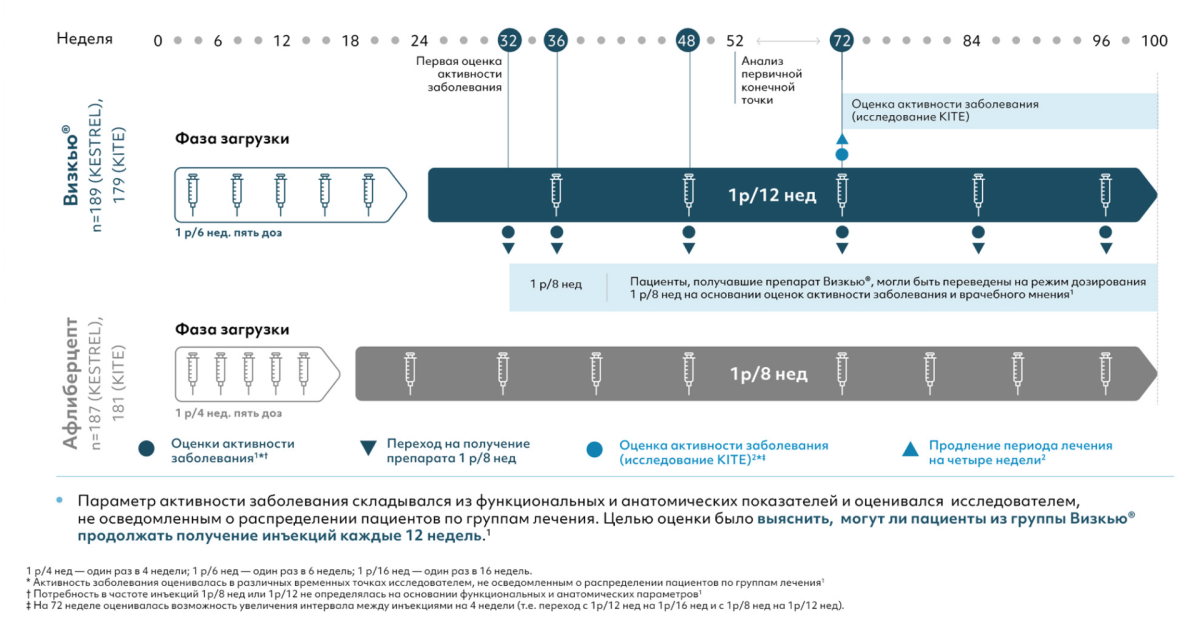
KESTREL и KITE представляют собой международные рандомизированные двойные слепые многоцентровые исследования III фазы продолжительностью 2 года, направленные на подтверждение эффективности и безопасности бролуцизумаба по сравнению с афлиберцептом у взрослых пациентов с нарушением зрения вследствие ДМО. Это крупные международные исследования, имеющие обширную географию. Исследования проводились в 36 странах мира в 197 центрах.
Количество загрузочных инъекций составило 5 инъекций во всех группах терапии, в группе бролуцизумаба — с интервалом 6 недель. Далее пациенты получали бролуцизумаб с интервалом 1 раз в 8 или 12 недель в зависимости от активности заболевания, со второго года было возможным удлинение интервала до 1 раза в 16 недель (в исследовании KITE).
Первичная конечная точка исследования: подтверждение не меньшей эффективности (non-inferiority) по сравнению с афлиберцептом, оцененной по изменению показателя МКОЗ от исходного значения к 52-й неделе у взрослых пациентов с нарушением зрения вследствие ДМО.
Помимо этого, в исследованиях был задан ряд важных вторичных конечных точек, которые касаются функциональных и анатомических параметров, качества жизни, безопасности.
Также имеется специфическая для исследования KITE конечная точка: оценка возможности удлинения интервалов между инъекциями бролуцизумаба на втором году лечения. Достижение этой точки поможет в перспективе дать возможность увеличения интервала между инъекциями с 8 до 12 недель и с 12 недель до 16, что дополнительно поможет снизить инъекционную нагрузку на пациентов с ДМО.
В исследовании KESTREL пациентам проводилось 5 загрузочных инъекций с интервалом 1 р/6 нед. Затем в поддерживающей фазе, начиная с 24-й недели, пациенты получали лечение 1 р/12 нед.
Однако при обнаружении АЗ на заранее запланированных визитах для ОАЗ (выделены на схеме желтым цветом) — пациентам назначали лечение 1 р/8 нед.
Пациентам из группы афлиберцепта 2 мг проводилось 5 загрузочных инъекций с интервалом 1 р/4 нед, затем в поддерживающую фазу 1 р/8 нед в соответствии с зарегистрированной инструкцией по применению.
Дизайн исследования KITE аналогичен дизайну исследования KESTREL.
В то же время в исследовании KITE, как мы говорили ранее, имеются специфические вторичные конечные точки. Так, на втором году терапии появляется возможность увеличения интервала между инъекциями до 16 недель при отсутствии АЗ.
Увеличенные интервалы между инъекциями бролуцизумаба, как в загрузочную фазу, так и в поддерживающую, приводят к уменьшению инъекционной нагрузки на пациентов с ДМО.
Первичная конечная точка была достигнута. Бролуцизумаб 6 мг обладал не меньшей эффективностью по сравнению с афлиберцептом в отношении среднего изменения МКОЗ к 52-й неделе по сравнению с исходной с меньшим количеством инъекций. Бролуцизумаб 6 мг обеспечивал стойкое повышение МКОЗ на 52-й неделе по сравнению с исходной в исследованиях KESTREL (+ 9,2 буквы) и KITE (+ 10,6 буквы). В обоих исследованиях после начала лечения наблюдалось устойчивое снижение толщины ТЦЗС. При этом в группе бролуцизумаба 6 мг в обоих исследованиях наблюдалось численно большее уменьшение ТЦЗС.
При терапии бролуцизумабом 6 мг достигалось значимое снижение ТЦЗС по сравнению с исходной.
В исследовании KITE при применении бролуцизумаба 6 мг достигалось более выраженное снижение ТЦЗС по сравнению с афлиберцептом 2 мг за период с 40-й по 52-ю неделю.
Больше пациентов, получавших бролуцизумаб 6 мг, по сравнению с афлиберцептом 2 мг, достигли разрешения ИРЖ/СРЖ как на 32-й (первая оценка активности заболевания), так и на 52-й неделе при меньшем количестве инъекций.
Таким образом, у меньшего числа пациентов, получавших бролуцизумаб, наблюдалась СРЖ и/или ИРЖ на 32-й и 52-й неделе.
Больше пациентов, получавших бролуцизумаб 6 мг, по сравнению с афлиберцептом 2 мг, достигли разрешения ИРЖ/СРЖ как на 32-й (первая оценка активности заболевания), так и на 52-й неделе при меньшем количестве инъекций.
У меньшего числа пациентов, получавших бролуцизумаб, присутствовала ИРЖ и/или СРЖ на 52-й и 100-й неделе при меньшем количестве инъекций
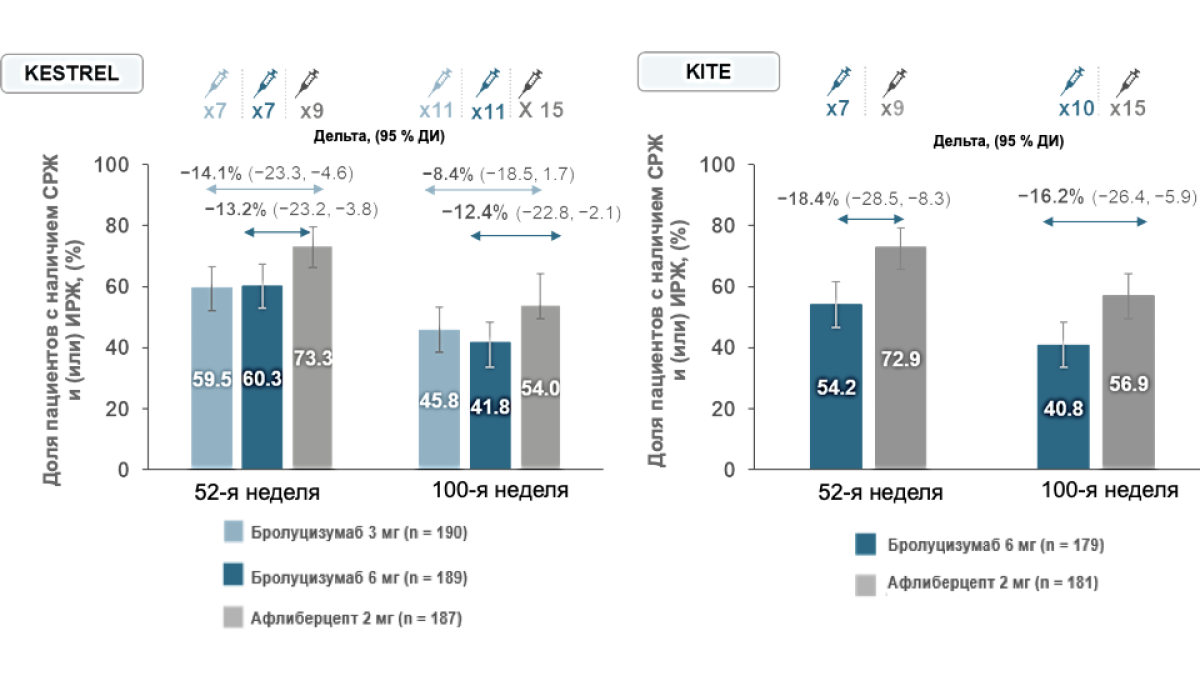
Полный набор для анализа LOCF. Статистическая модель с использованием логистической регрессии с поправкой на базовый уровень жидкости (СРЖ и/или ИРЖ), возрастные категории (<65, ≥65 лет) и лечение как факторы с фиксированным эффектом. 95% ДИ рассчитан с использованием метода начальной загрузки. Сообщается среднее количество инъекций на 52-й и 100-й неделе.
ИРЖ — интраретинальная жидкость; LOCF — метод замены пропущенных значений предшествующими; СРЖ — субретинальная жидкость.
Regillo C, et al. Angiogenesis 2022 [Oral presentation]
Как в KESTREL, так и в KITE, в соответствии с результатами первого года:
- Улучшение ОЗ, достигнутое при применении бролуцизумаба 6 мг, было сравнимо с таковым при применении афлиберцепта 2 мг по состоянию к 100-й неделе, несмотря на меньшее количество инъекций (медиана инъекций — 11 против 15 [KESTREL] и 10 против 15 [KITE]).
- Значительные улучшения анатомических параметров, достигнутые при применении бролуцизумаба 6 мг:
- устойчивое снижение ТЦЗС до 100-й недели;
- сохранение ИРЖ и/или СРЖ было выявлено у меньшего количества пациентов по сравнению с афлиберцептом на 52-й и 100-й неделях.
- Почти 70% пациентов, получавших бролуцизумаб 6 мг, успешно завершивших первый цикл 1 р/12 нед сразу после фазы загрузки, продолжали оставаться на интервале 1 р/12 нед (KESTREL) и 1 р/12 нед / 1 р/16 нед (KITE) до 100-й недели:
- в исследовании KITE примерно 25% пациентов, получавших бролуцизумаб 6 мг, достигли интервала 1 р/16 нед к исходу 100-й недели.
- Устойчивое клинически значимое улучшение оценки DRSS (≥ 2 ступеней) от исходного уровня к 100-й неделе.
- В целом профиль безопасности бролуцизумаба в дозе 6 мг оставался неизменным. В KITE не было зарегистрировано ни одного случая РВ в течение всего исследования, а в KESTREL новых случаев РВ не было в течение 2-го года. В KITE в течение 2-го года не было зарегистрировано новых ОСС; три новых ОСС, зарегистрированных на 2-м году в группе бролуцизумаба 6 мг в KESTREL, не имели связи с ВГВ или РВ.
Терапия ранибизумабом
Режимы терапии ранибизумабом делятся на:
- «Лечение и продление» (Treat and Extend — T&E) — изначально требуются 3 последовательные инъекции или более. После достижения максимальной ОЗ можно поэтапно увеличивать интервалы введения.
- «По потребности» (Pro re nata — PRN).
Лечение в режиме Т&Е демонстрирует результат, сопоставимый с режимом PRN, и снижает нагрузку на пациентов [19,21].
При лечении в режиме T&E терапевтический интервал следует увеличивать не более чем на 1 месяц и максимум до 3 месяцев. При возобновлении активности ДМО интервалы нужно укорачивать — вплоть до возврата к ежемесячному введению [22].
Ранибизумаб + лазерная коагуляция
Существует два режима комбинированного лечения ранибизумабом в сочетании с ЛК:
- Ранибизумаб + немедленная ЛК;
- Ранибизумаб + отсроченная ЛК.
Отсроченная ЛК ассоциирована с большим приростом ОЗ в течение 5 лет [15].
По данным исследования PROTOCOL I [15], в группе пациентов с исходно более низкой ОЗ ее прирост к концу 5-го года терапии был выше в группе с отсроченной ЛК. В итоге 56% пациентов из группы с отсроченной ЛК не потребовался ни один сеанс лазера. Более 50% пациентов группы отсроченной ЛК не нуждались в лазеротерапии в течение 5 лет.
Оценка эффективности анти-VEGF-терапии при ДМО
Сколько нужно инъекций, чтобы оценить ответ на терапию?
Улучшение зрения при ДМО — это постепенный процесс. Пик ОЗ достигается только через 6–9 месяцев (или дольше) после начала лечения [23].
Рекомендуемый срок оценки «субоптимального» ответа — 12-й месяц лечения (рис. 3).
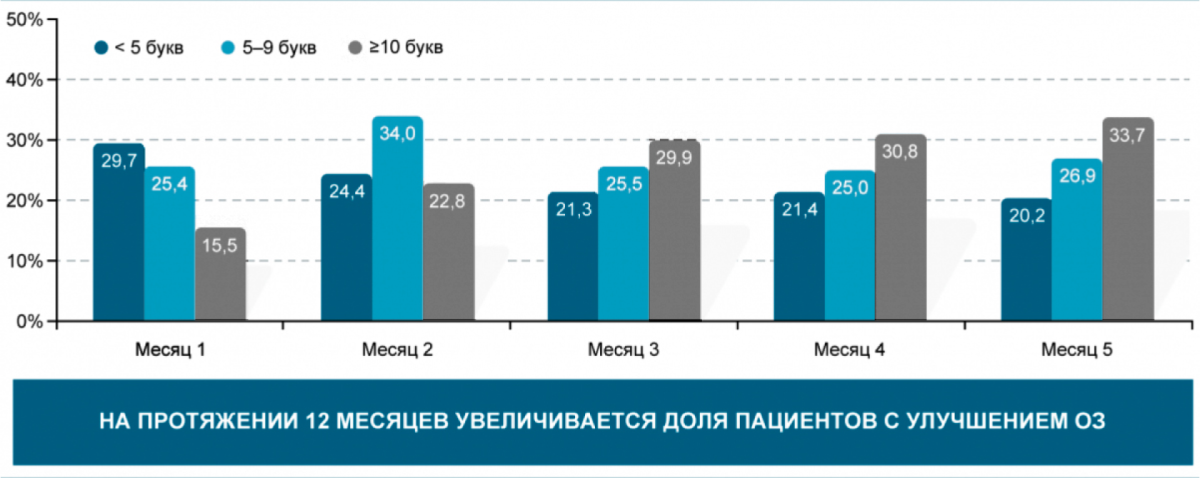
Рисунок 3. Динамика улучшения ОЗ на фоне анти-VEGF-терапии [23]
Когда пора переключаться на другое лечение?
Убедительных данных в пользу эффективности и целесообразности переключения на другое лечение при терапии ДМО нет. Такое переключение не приводит к улучшению ОЗ. Более целесообразно длительное лечение — на протяжении 1–2 лет и более [24].
Если после 3 и более инъекций ранибизумаба ДМО сохраняется, следует продолжить терапию. В этой ситуации при переключении на другой препарат улучшение будет более вероятно связано с продолжительностью терапии, а не со сменой лекарства [25].
Улучшение комплаенса может влиять на исходы больше, чем изменение терапии [26].
На какое лечение переключать пациента в случае неэффективности анти-VEGF-препарата?
Если вы решили, что лечение ранибизумабом не эффективно, терапию можно переключить на другой анти-VEGF-препарат, либо добавить другой вид терапии (ЛК), либо перейти на хирургическое лечение (витрэктомия).
После переключения на другой анти-VEGF-препарат оцените, действительно ли улучшение произошло благодаря переключению. Возможно ли, что исходное ухудшение было связано не с неэффективностью анти-VEGF, а с системными факторами (АГ, HbА1c и др.) и другими сопутствующими офтальмологическими заболеваниями (катаракта, глаукома и др.).
Чем объясняется повышение эффективности лечения после переключения с ранибизумаба на другой анти-VEGF-препарат?
Эффективность переключения объясняется различиями в механизмах действия анти-VEGF-агентов. У пациента может быть врожденная генетическая резистентность к определенному анти-VEGF-агенту: определенные полиморфизмы гена VEGF-A могут приводить к плохому ответу на конкретный анти-VEGF-препарат [27].
Часто бывает так, что улучшение не связано с препаратом «переключения». Оно может быть связано с тем, что после переключения за пациентом начинается проспективное наблюдение, когда врач более тщательно следит за состоянием пациента. Также улучшение может быть связано с увеличением количества инъекций после переключения.
Если после переключения частота инъекций снижается, это не всегда связано с препаратом «переключения». Более вероятно, что это связано с длительностью терапии, когда потребность в инъекциях закономерно снижается. Таким образом, снизить частоту инъекций было бы возможно и без перехода на другой препарат.
Что произойдет, если не переключаться на другой анти-VEGF, а продолжить лечение ранибизумабом?
По данным исследований [28], у пациентов, которые продолжили лечение ранибизумабом без переключения на другой анти-VEGF, ОЗ улучшалась сопоставимо с теми пациентами, которые перешли на другой анти-VEGF-агент.
К примеру, у пациента, который был кандидатом на переключение к 3-му месяцу лечения ранибизумабом, но продолжил терапию этим препаратом, выраженное уменьшение толщины сетчатки наступило ко 2-му году лечения.
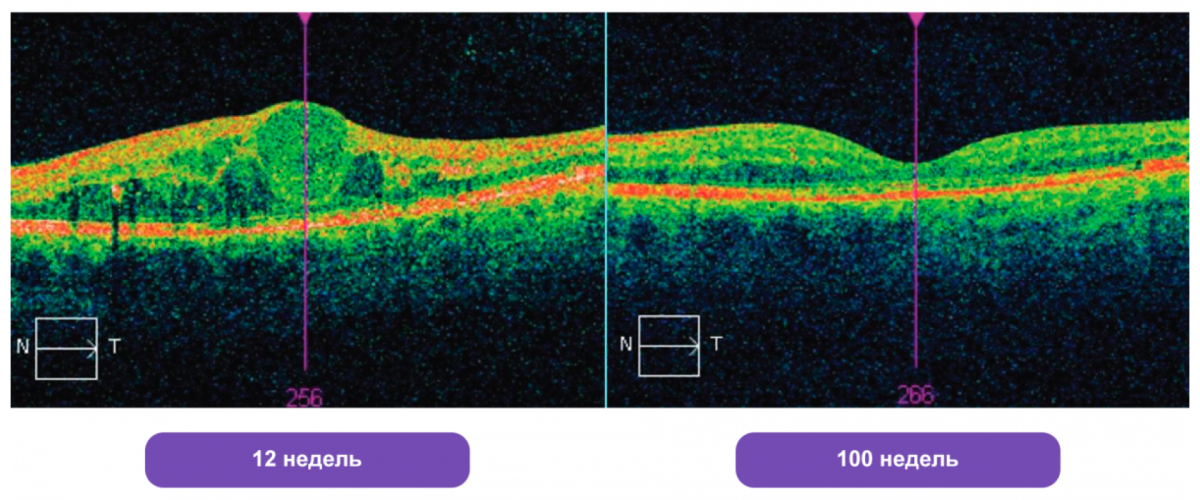
Другое исследование [29] показало, что при переключении с ранибизумаба на афлиберцепт у пациентов не наблюдалось стойкое улучшение ОЗ. Через 3 месяца между пациентами, которые «переключились» и которые продолжили лечение ранибизумабом, не было значимых различий (р = 0,02).
Можно ли вернуться к предыдущему анти-VEGF после переключения?
Если переключение с одного анти-VEGF на другой неэффективно, можно провести «обратное переключение» на первый препарат [30].
Источники:
- Petrella RJ, et al. J Ophthalmol. 2012: 159167.
- Minassian et al. Br J Ophthalmol 2012; 96: 345-349.
- Gundogan FC, Pak J Med Sci. 2016; 32(2): 505–510.
- Дедов И.И./Dedov, I., Шестакова М.В./Shestakova M., & Майоров А.Ю./Mayorov A. «Алгоритмы специализированной медицинской помощи больным сахарным диабетом»/Standards of Specialized Diabetes CARE 8th Edition. (2017). doi:10.14341/DM20151S1-112.
- Bhagat N. et al. Survey of Ophthalmology 2009; 54: 1-32.
- Wilkinson CP, et al. Ophthalmology 2003; 110: 1677–82.
- ICO Guidelines for Diabetic Eye Care.
- Schmidt-Erfurth U. et al. Ophthalmologica. 2017; 237(4): 185-222. doi: 10.1159/000458539.
- Kim H, et al. Mol Vision 2009; 15: 2803-12 Eylea. SmPC. 2014.
- Brown DM, et al. Ophthalmology 2013; 120: 2013–22.
- Boyer et al. Ophthalmology 2015; 122: 2504–13.
- Elman et al. Ophthalmology 2010; 117: 1064–77.
- Elman MJ et al. Ophthalmology 2011 Apr; 118(4): 609-14.
- Elman et al. Ophthalmology 2012; 119: 2312–8.
- Elman et al. Ophthalmology 2015; 122: 375–81.
- Schmidt-Erfurth U, et al. Ophthalmology 2014; 121: 1045–53.
- Ishibashi et al. Ophthalmology 2015; 122: 1402–159.
- Li X et al. Graefes Arch Clin Exp Ophthalmol. 2019 Mar; 257(3): 529-541.
- Prünte C, et al. Br J Ophthalmol 2016; 100: 787–795.
- Mitchell P, et al. Results presented at EURETINA, 2017.
- Galvez ML, et al. Symposium presentation at World Ophthalmology congress, 2018. Spain.
- Инструкция по медицинскому применению лекарственного препарата Луцентис® (изменение от 05.11.2019), регистрационное удостоверение ЛСР-004567/08 от 16.06.2008.
- Chatziralli I. et al. Identification of time point to best define ‘sub-optimal response’ following intravitrealranibizumab therapy for diabetic macular edema based on reallife data. Eye (2017), 1–6.
- Bressler NM. AAO 2018 Oral presentation. Session #RET20 Can we confidently predict 2-year outcomes in a patient following three anti-VEGF injections for DME?
- Bressler NM, et al. JAMA Ophthalmol. 2018; 136(3): 257-269.
- Brown TM et al. Mayo Clin Proc. 2011; 86(4): 304-314.
- Mantel I, Gillies MC, Souied EH. Surv Ophthalmol. 2018; 63(5): 638-645.
- Ferris FL, et al. JAMA Ophthalmol 2017; 135(2).
- Lee CS, et al. Visual acuity improvement when switching from ranibizumab to aflibercept is not sustained. Retina 2017; 0: 1–6.
- Despreaux R, et al. Graefes Arch Clin ExpOphthalmol 2016 Apr; 254(4): 639-44.
- Дедов И.И., Шестакова М.В., Викулова О.К. Эпидемиология сахарного диабета в Российской Федерации: клинико- статистический анализ по данным Федерального регистра сахарного диабета // Сахарный диабет. – 2017. – T. 20. – №1. – C. 13-41/
449217/VSI/WEB/052024/1

