BYLieve: открытое несравнительное исследование II фазы по применению комбинации алпелисиба с фулвестрантом для лечения положительного по гормональным рецепторам и HER2-отрицательного распространенного РМЖ с мутацией гена PIK3CA у пациентов, ранее получавших терапию ингибиторами CDK4/61.
Дизайн исследования BYLieve: открытое несравнительное исследование II фазы, проводимое в трех когортах, в которые включали пациентов с мутацией гена PIK3CA в опухолевой ткани в зависимости от типа предшествующей терапии (рис. 1):
-
Когорта А включала пациентов с прогрессированием на фоне терапии ингибитором CDK в комбинации с ингибитором ароматазы (n = 112). В исследовании BYLieve такие пациенты получали алпелисиб в комбинации с фулвестрантом.
-
Когорта В включала пациентов с прогрессированием на фоне терапии ингибитором CDK в комбинации с фулвестрантом (n = 112). В исследовании BYLieve такие пациенты получали алпелисиб в комбинации с летрозолом.
-
Когорта С включала пациентов с прогрессированием на фоне химиотерапии или эндокринной терапии (n = 112). В исследовании BYLieve такие пациенты получали алпелисиб в комбинации с фулвестрантом.
Цель: оценить эффективность алпелисиба + ГТ у пациентов с мутацией гена PIK3CA, ранее получавших ингибиторы CDK4/6.
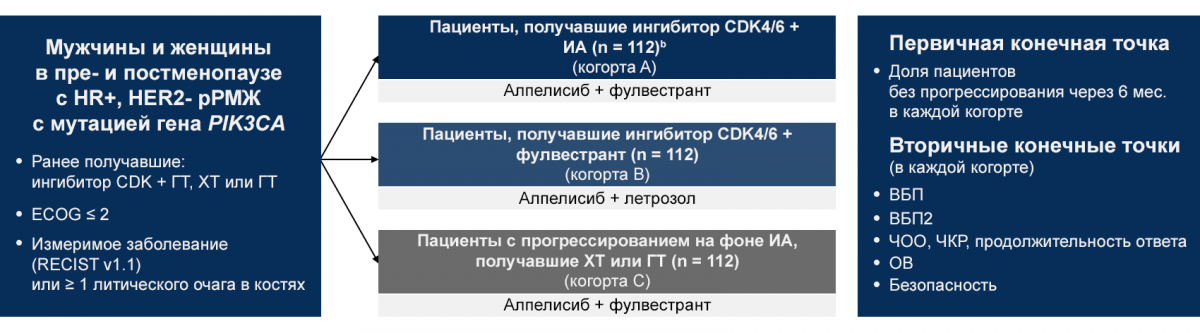
Рисунок 1 — BYLieve: открытое исследование 2 фазы
Примечание.
а Мужчины в когорте летрозола и женщины в пременопаузе также получали гозерелин 3,6 мг SC каждые 28 дней или лейпролид 7,5 мг в/м каждые 28 дней для адекватного подавления гонад. b Зачисление в каждую когорту продолжалось до достижения 112 пациентов с централизованно подтвержденной мутацией PIK3CA. c IM на D1 и D15 цикла 1 и D1 для всех последующих циклов. HR+ — гормоноположительный; HER2- — не экспрессирующий рецептор эпидермального фактора роста человека 2‑го типа; рРМЖ — распространенный рак молочной железы; PIK3CA — каталитическая субъединица альфа фосфатидилинозитол‑4,5-бисфосфат 3‑киназы; CDK — циклинзависимая киназа; ГТ — гормонотерапия; ХТ — химиотерапия; ECOG — балл по шкале оценки общего состояния онкологического больного; RECIST — набор критериев для оценки ответа опухоли на терапию; ИА — ингибитор ароматазы; ВБП — выживаемость без прогрессирования; ЧОО — частичный опухолевый ответ; ЧКР — частичный клинический ответ; ОВ — общая выживаемость.
Результаты оценки эффективности в когорте А. В настоящее время исследование BYLieve продолжается; результаты оценки эффективности доступны для пациентов из когорты А (рис. 2):
-
Достигнута основная конечная точка исследования: доля пациентов без прогрессирования заболевания через 6 мес. составила 50,4% (95% ДИ, 41,2–59,6).
-
Медиана выживаемости без прогрессирования составила 7,3 мес. (количество событий 72 (59,5%); 95% ДИ, 5,6–8,3).
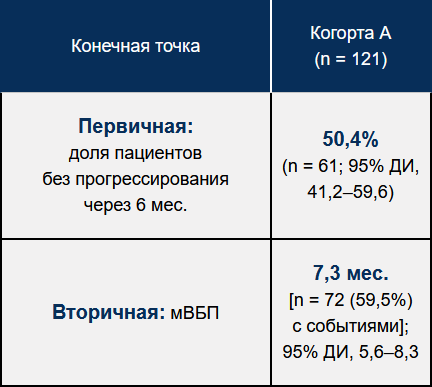
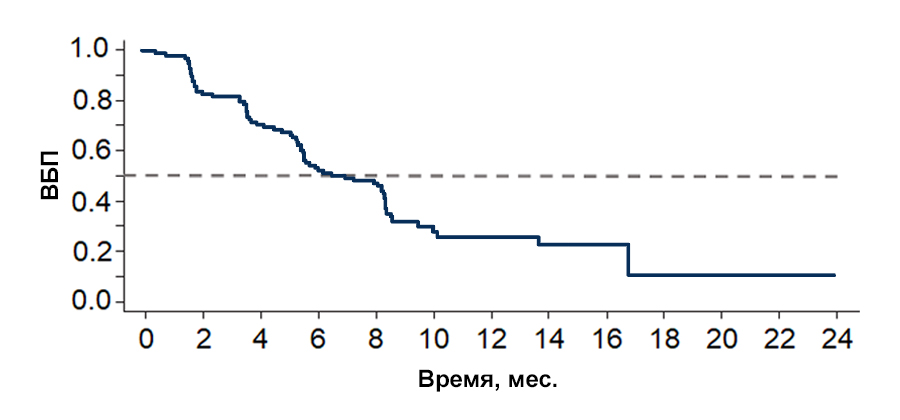
Рисунок 2 — Выживаемость без прогрессирования в когорте А
Примечание.
мВБП — медиана выживаемости без прогрессирования; ДИ — доверительный интервал.
Первичная конечная точка в когорте А достигнута (нижняя граница 95% ДИ > 30%): 50,4% пациентов без прогрессирования через 6 мес.
В SOLAR-1 44,4% пациентов с мутацией PIK3CA, ранее получавших ингибиторы CDK, были живы и не имели признаков прогрессирования через 6 мес. терапии алпелисибом2.
Выводы:
Доказана клинически значимая эффективность и подтвержден управляемый профиль переносимости комбинации алпелисиба с фулвестрантом у пациентов с HR+ HER2- рРМЖ с мутацией PIK3CA после прогрессирования на фоне терапии ингибитором CDK4/6 + ИА.
-
Достигнута первичная конечная точка исследования в когорте А (доля пациентов без прогрессирования заболевания через 6 мес. составила 50,4%).
-
мВБП составила 7,3 мес.
-
Для сравнения: в исследовании SOLAR-1 в подгруппе пациентов, ранее получавших ингибиторы CDK4/6 (n = 20), доля пациентов без прогрессирования заболевания через 6 мес. составила 44,4%, а мВБП — 5,5 мес.2
-
Сравнение с данными реальной клинической практики показало существенное увеличение мВБП при применении алпелисиба по сравнению с другими видами существующей терапии в данной подгруппе пациентов (7,3 мес. vs 3,6 мес.):
-
алпелисиб обладает предсказуемым и управляемым профилем переносимости;
-
отмена терапии из-за НЯ потребовалась 20,5% пациентов (в исследовании SOLAR-1 — 25%)2;
-
снизился уровень отмены из-за гипергликемии по сравнению с исследованием SOLAR-1 (1,6% vs 6,3%).
-
Исследование BYLieve подтверждает целесообразность применения комбинации алпелисиба с фулвестрантом для лечения HR+ HER2- распространенного РМЖ с мутацией гена PIK3CA.
Литературные источники:
- Rugo H.S., FLerebours F., Ciruelos E. et al. BYLieve study results. Presented at: 2020 ASCO Virtual Scientific Program; May 29–31, 2020. Abstract 1006. Rugo H. et al. J Clin Oncol 38: 2020 (suppl; abstr 1006).
- Andre F. et al. Alpelisib for PIK3CA-Mutated, Hormone Receptor–Positive Advanced Breast Cancer. N Engl J Med 2019;380:1929-40. DOI: 10.1056/NEJMoa1813904.
790570/WEB/GEN/04.24/1
