Активное внедрение системной адъювантной терапии (АТ) является одним из главных векторов развития лекарственного лечения злокачественных новообразований1.
C биологической точки зрения любое онкологическое заболевание, даже на ранних стадиях, является диссеминированным процессом3. К сожалению, резекция опухоли не всегда гарантирует излечение от заболевания и не защищает от развития местного рецидива и отдаленных метастазов4. В случае меланомы кожи (МК) ситуация усугубляется тем, что при данном заболевании существует два вида метастазирования: лимфогенный и гематогенный.
Без адъювантной терапии после резекции меланомы III стадии в течение 5 лет у пациентов наблюдается5:


Адъювантная терапия необходима для подавления всех оставшихся микрометастазов и профилактики рецидива.

Согласно действующим международным и национальным рекомендациям (NCCN, ESMO и RUSSCO), всем пациентам с резектабельной МК III стадии, в том числе BRAF+, необходимо проведение адъювантной терапии6,7,8,12.
Доступные опции адъювантной терапии меланомы кожи
Существующие подходы к адъювантной терапии при меланоме кожи III стадии5,6
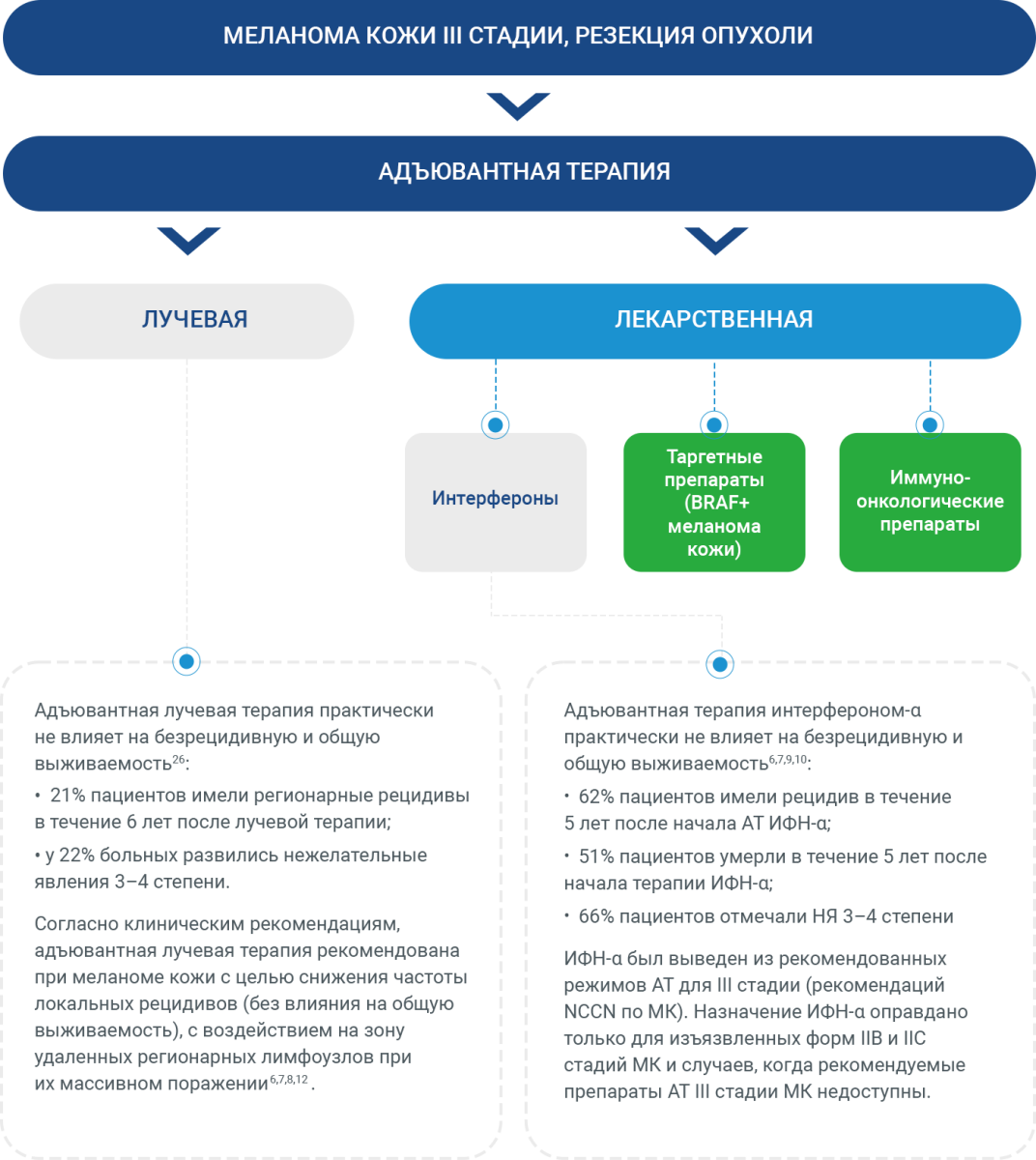
Адъювантная терапия комбинацией ингибиторов BRAF/MEK или препаратами anti-PD1 является предпочтительным вариантом лечения резектабельной МК III стадии6,7,8,12.
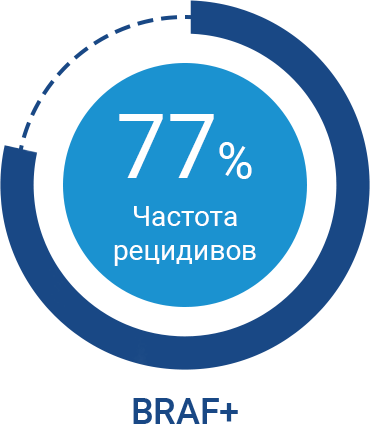
На окончательный выбор тактики АТ меланомы кожи III стадии влияет наличие или отсутствие мутации гена BRAF у пациента. Онкогенные мутации в гене BRAF встречаются в 60,6% случаев меланомы кожи в РФ21. Наличие у пациента мутации в гене BRAF является фактором неблагоприятного прогноза20,24,25 из-за постоянной активации внутриклеточного MAPK-пути, который формирует молекулярные сигналы для дальнейшего роста опухолевой клетки22,23. И, как следствие, у пациентов с мутацией в гене BRAF гораздо чаще возникают рецидивы меланомы кожи после проведенной резекции20.
Частота рецидивов меланомы кожи в течение 3 лет после проведенной резекции без адъювантной терапии20

Наличие мутации в гене BRAF открывает дополнительную возможность АТ резектабельной меланомы кожи III стадии в виде комбинации ингибиторов BRAF/MEK6,7,8,12. При этом монотерапия ингибитором BRAF-киназ не рекомендована в связи с недостаточной эффективностью по результатам исследования13.
Сравнение эффективности и безопасности рекомендуемых вариантов адъювантной терапии меланомы кожи
В настоящее время нет данных прямых сравнительных клинических исследований различных опций АТ МК.
Непрямое сравнение результатов ключевых исследований адъювантной терапии меланомы кожи (ноябрь 2021)14–17,27
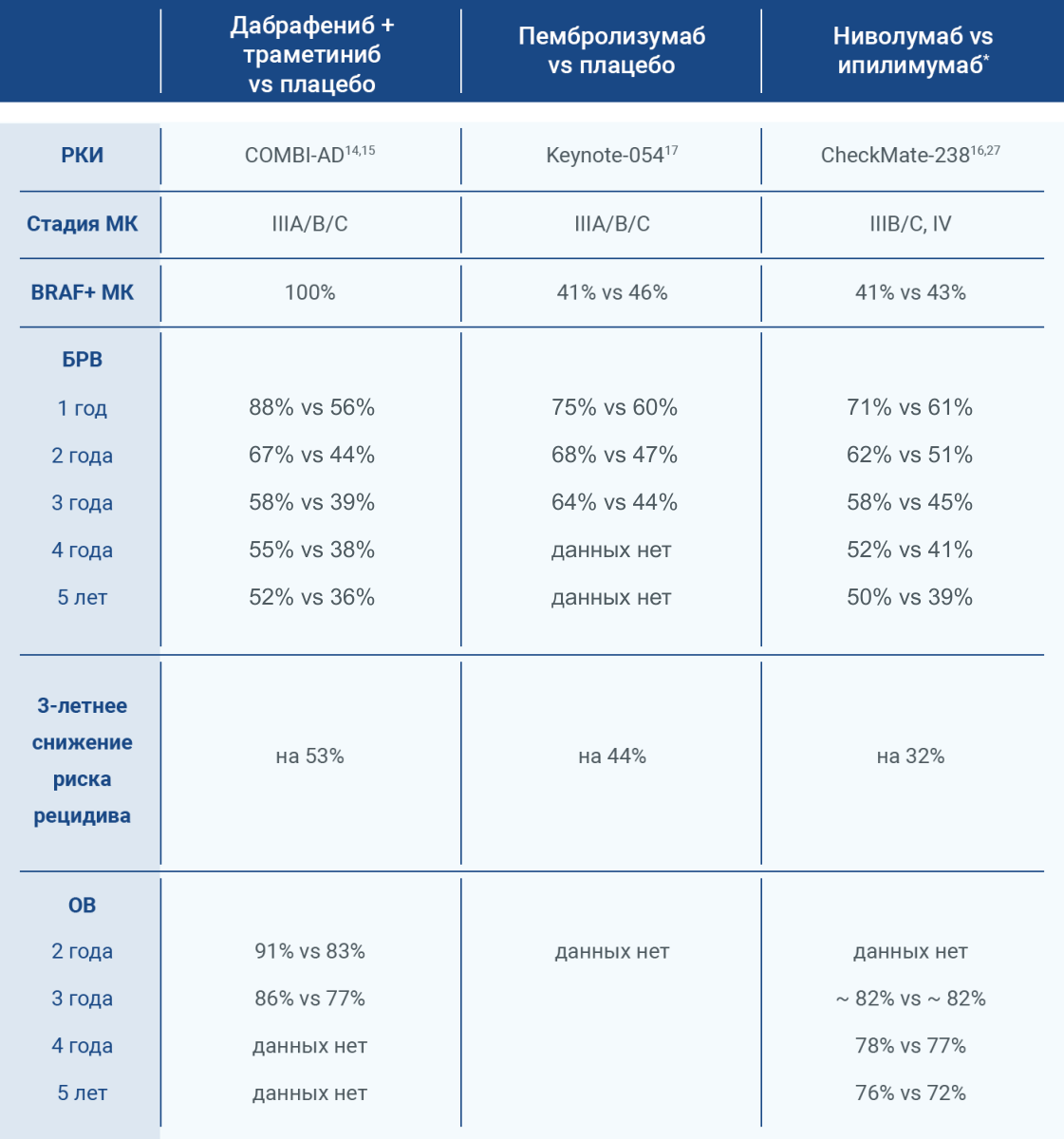
* Ипилимумаб не зарегистрирован в РФ в качестве АТ МК.
В рандомизированном двойном слепом плацебо-контролируемом исследовании третьей фазы COMBI-AD (медиана наблюдения в экспериментальной группе — 60 месяцев), сравнившем комбинацию дабрафениба и траметиниба против плацебо, было достигнуто большее снижение 3-летнего риска рецидива после полной резекции МК по сравнению с сопоставимым исследованием пембролизумаба Keynote-054. COMBI-AD показало значительное улучшение 3-летней БРВ и преимущество в 3-летней ОВ в экспериментальной группе по сравнению с плацебо. Данные по ОВ в группе пембролизумаба в Keynote-054 в настоящее время недоступны14,15,17.
Одним из наиболее значимых результатов является показатель досрочного завершения АТ из-за рецидива МК14–17.
Досрочное прекращение адъювантной терапии из-за рецидива меланомы кожи
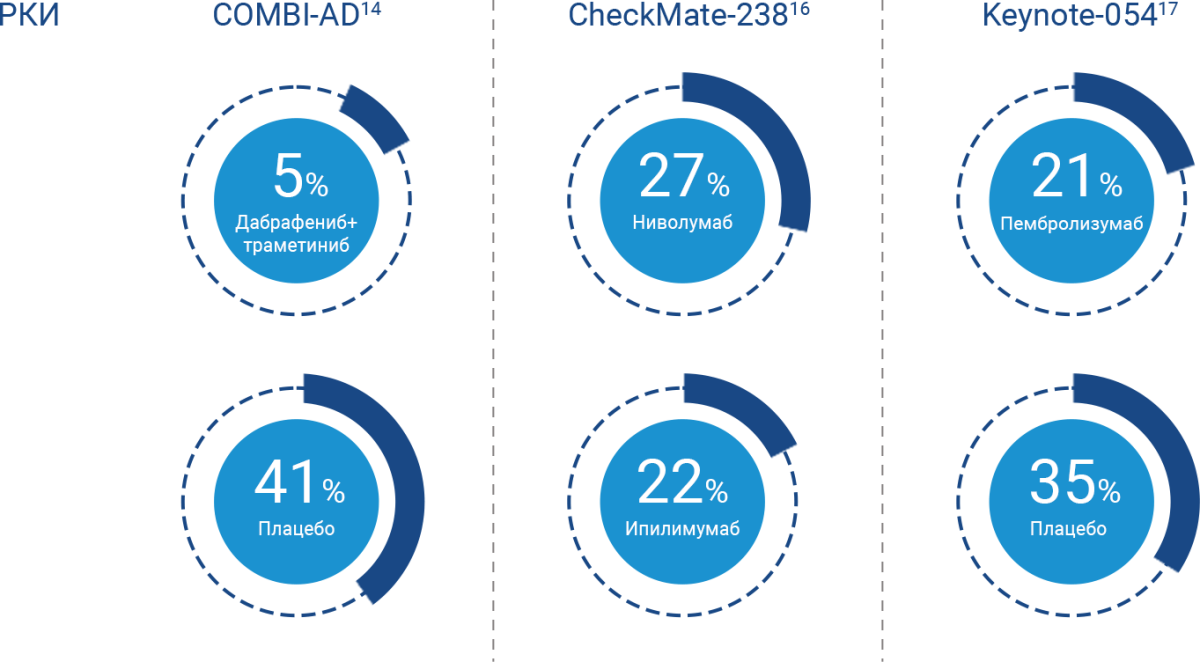
Всего 5% пациентов прекращали адъювантную терапию дабрафенибом и траметинибом в связи с возникновением рецидива14.

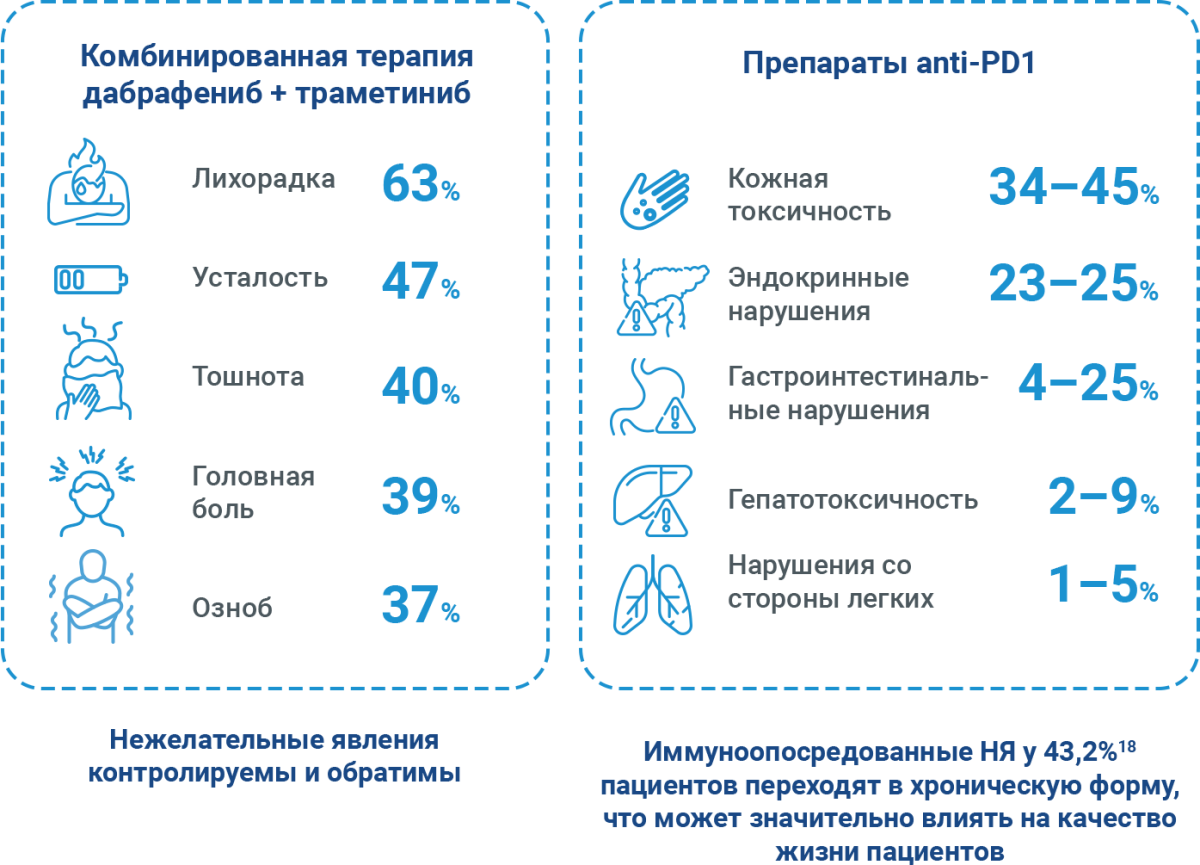
При назначении АТ важным аспектом является профиль безопасности, особенно в долгосрочном периоде.
Частота встречаемости характерных нежелательных явлений при разных видах терапии15–17
Источники
- Cohen J.V., Buchbinder E.I. The Evolution of Adjuvant Therapy for Melanoma. Curr Oncol Rep. 2019;21(12):106. doi:10.1007/s11912-019-0858-3
- Практические рекомендации по лечению злокачественных опухолей Российского общества клинической онкологии. Интернет-портал Российского общества клинической онкологии. Электронный ресурс https://rosoncoweb.ru/standarts/RUSSCO/, дата последнего доступа 15.11.2021.
- Schuitevoerder D., Vining C.C., Tseng J. Adjuvant Therapy for Cutaneous Melanoma. Surg Oncol Clin N Am. 2020;29(3):455-465. doi:10.1016/j.soc.2020.02.009
- Демидов Л.В., Харкевич Г.Ю. Меланома кожи: стадирование, диагностика и лечение. РМЖ. 2003;11:658.
- Gershenwald J.E., Scolyer R.A., Hess K.R. et al. Melanoma staging: evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin 2017; 67(6): 472–492.
- Строяковский Д.Л., Абрамов М.Е., Демидов Л.В., Жукова Н.В., Новик А.В., Орлова К.В. и соавт. Практические рекомендации по лекарственному лечению меланомы кожи. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2020;10:16.
- Практические рекомендации АОР, МЗ РФ, 2020.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Melanoma. Version 2.2021.
- Natalie J. Ives. Adjuvant interferon-a for the treatment of high-risk melanoma: An individual patient data meta-analysis. European Journal of Cancer. 2017;82: 171-183.
- Trinh V.A., Zobniw C., Hwu W.J. The efficacy and safety of adjuvant interferon-alfa therapy in the evolving treatment landscape for resected high-risk melanoma //Expert opinion on drug safety. 2017;16(8): 933-940.
- Eggermont A.M.M., Chiarion-Sileni V., Grob J.-J. et al. Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial. Lancet Oncol 2015; 16(5): 522–530.
- Michielin O., van Akkooi A.C.J., Ascierto P.A., Dummer R., Keilholz U. ESMO Guidelines Committee. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019;30(12):1884-1901. doi:10.1093/annonc/mdz411
- Maio M., Lewis K., Demidov L. et al. Adjuvant vemurafenib in resected, BRAFV600 mutation-positive melanoma (BRIM8): a randomised, double-blind, placebo-controlled, multicentre, phase 3 trial. Lancet Oncol 2018; 19(4): 510–520.
- Dummer R. et al. Five-Year Analysis of Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. N Engl J Med. 2020 Sep 17;383(12):1139-1148.
- Long G.V. Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med. 2017 Nov 9;377(19):1813-1823.
- Ascierto P.A. et al. Adjuvant nivolumab versus ipilimumab in resected stage IIIB-C and stage IV melanoma (CheckMate 238): 4-year results from a multicentre, double-blind, randomised, controlled, phase 3 trial. Lancet Oncol. 2020 Nov;21(11):1465-1477.
- Eggermont A.M.M. et al. Longer Follow-Up Confirms Recurrence-Free Survival Benefit of Adjuvant Pembrolizumab in High-Risk Stage III Melanoma: Updated Results From the EORTC 1325-MG/KEYNOTE-054 Trial. J Clin Oncol. 2020 Nov 20;38(33):3925-3936.
- Patrinely J.R. Jr., Johnson R., Lawless A.R. et al. Chronic Immune-Related Adverse Events Following Adjuvant Anti-PD-1 Therapy for High-risk Resected Melanoma. JAMA Oncol. 2021;7(5):744-748. doi:10.1001/jamaoncol.2021.0051
- Ghisoni E., Wicky A., Bouchaab H. et al. Late-onset and long-lasting immune-related adverse events from immune checkpoint-inhibitors: An overlooked aspect in immunotherapy. Eur J Cancer. 2021;149:153-164.
- Barbour A.P. et al. BRAF mutation status is an independent prognostic factor for resected stage IIIB and IIIC melanoma: implications for melanoma staging and adjuvant therapy. Eur J Cancer. 2014;50(15):2668-2676. Первое Всероссийское молекулярно-эпидемиологическое исследование меланомы: результаты анализа мутаций в гене BRAF. Архив патологии. 2014;76(3):65-73.
- Франк Г.А., Завалишина Л.Э., Кекеева Т.В., Алексахина C.Н., Гарифуллина Т.Р., Иванцов О.А., Митюшкина Н.В., Пфайфер В., Стрелкова Т.Н., Имянитов Е.Н. Первое Всероссийское молекулярно-эпидемиологическое исследование меланомы: результаты анализа мутаций в гене BRAF. Архив патологии. 2014;76(3):65-73.
- Sullivan R., LoRusso P., Boerner S., Dummer R. Achievements and challenges of molecular targeted therapy in melanoma. Am Soc Clin Oncol Educ Book. 2015;177-186.
- Czarnecka A.M., Bartnik E., Fiedorowicz M., Rutkowski P. Targeted Therapy in Melanoma and Mechanisms of Resistance. Int J Mol Sci. 2020;21(13):4576.
- Ekedahl H., Cirenajwis H., Harbst K. et al. The clinical significance of BRAF and NRAS mutations in a clinic-based metastatic melanoma cohort. Br J Dermatol. 2013;169(5):1049-1055.
- Ny L., Hernberg M., Nyakas M. et al. BRAF mutational status as a prognostic marker for survival in malignant melanoma: a systematic review and meta-analysis. Acta Oncol. 2020;59(7):833-844.
- Henderson M.A. et al. Adjuvant lymph-node field radiotherapy versus observation only in patients with melanoma at high risk of further lymph-node field relapse after lymphadenectomy (ANZMTG 01.02/TROG 02.01): 6-year follow-up of a phase 3, randomised controlled trial //The Lancet Oncology. 2015;16(9): 1049-1060.
- Webber J. et al. Five-year outcomes with adjuvant nivolumab versus ipilimumab in resected stage III B-C or IV melanoma (CheckMate 238). Presented at SMR 2021.
642814/ONCO/DIG/05.23/0




