Элтромбопаг в 1 линии терапии ТАА: исследование NIH (США)1

Примечание.
лАТГ — лошадиный антитимоцитарный глобулин.
Первичная конечная точка:
-
Полный ответ (ПО) через 6 месяцев, определяемый как:
-
нейтрофилы ≥ 1 × 109/л
-
Hb ≥ 10 г/дл
-
тромбоциты ≥ 100 × 109/л
-
Вторичные конечные точки:
-
Общий ответ (ОО)
-
Частичный ответ (ЧО), определяемый при:
-
показателях крови, не соответствующих критериям ТАА или ПО
-
-
Выживаемость
-
Клональная эволюция
-
Рецидив
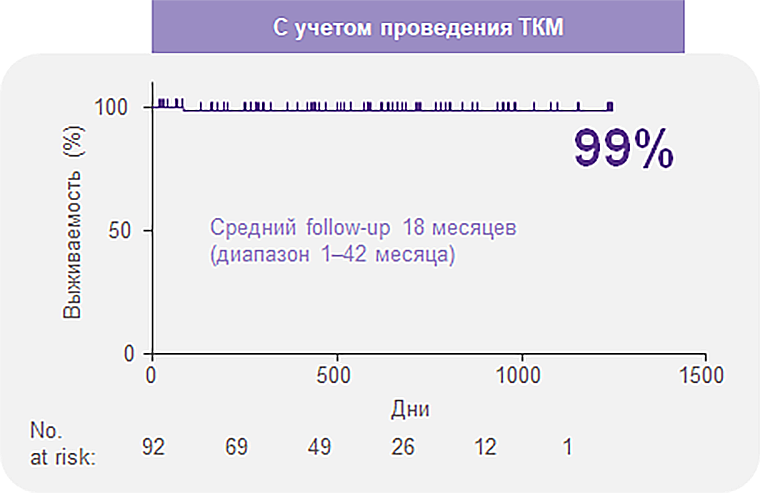
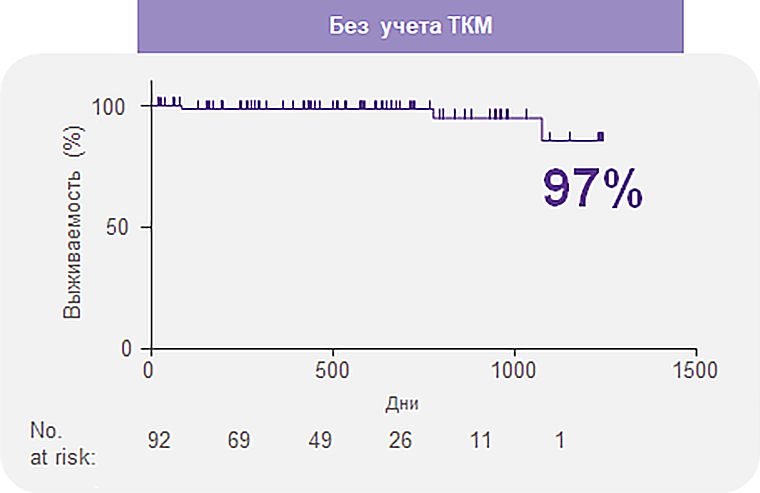
Элтромбопаг в комбинации с ИСТ позволяет достичь высоких показателей выживаемости1
Общая выживаемость через 2 года составила 97% и 99% после учета проведения ТКМ1.
Элтромбопаг в комбинации с ИСТ улучшает гематологический ответ1
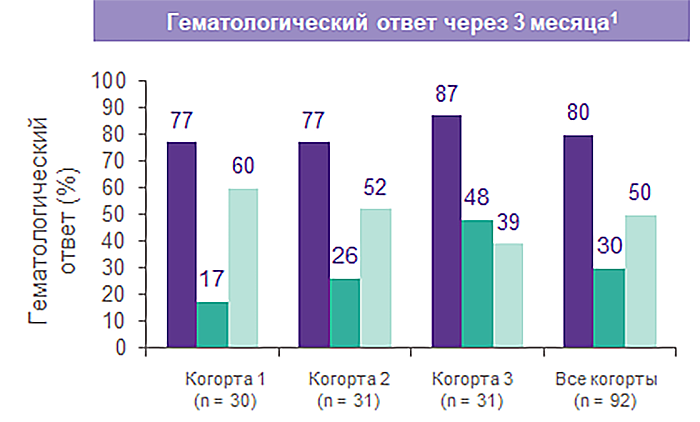
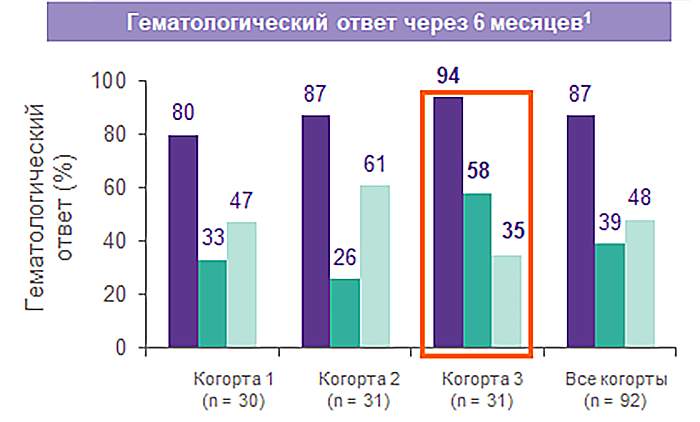

Исторические данные ответа на ИСТ2,3:
-
Общий ответ ~ 60–70%;
-
Полный ответ ~ 10%
Чем раньше начата терапия элтромбопагом, тем выше частота полных ответов1
| Когорта | Режим терапии препаратом Револейд | Количество пациентов | Полные ответы через 6 месяцев | P* |
| 1 | С дня 14 по 6 месяцев | 30 | 33% | 0,01 |
| 2 | С дня 14 по 3 месяца | 31 | 26% | 0,06 |
| 3 | С дня 1 по 6 месяцев | 31 | 58% | < 0,001 |
Примечание.
* Значение P относится к оценке нуль-гипотезы, согласно которой частота полных ответов за 6 месяцев должна была составить не ниже 30%.
Частота полных ответов в исторической когорте — 10%2,3.
Частота клональной эволюции на фоне терапии элтромбопаг + ИСТ была сопоставима с таковой при применении стандартной ИСТ1,4
Клональная эволюция произошла у 7/92 пациентов (8%).
| Возраст | Ответ | Время до эволюции (месяцы) | Цитогенетика | Дисплазия КМ | Исход | МДС/ОМЛ somatic gene mutations (VAF) |
| 68 | ПО | 3 | 46, XX, del(13)(q12q22)[cp3]/ 46,XX[17] | Нет | Цитогенетика нормализовалась | none detected |
| 39 | ПО | 30 | 48,XX +6 +15 [2]/ 46,XX[18] | Нет | Стабильно | DNMT3A (3%) |
| 64 | ЧО | 3 | 45,XX,t(3;3)(q21;q26),-7[3]/ 46, XX[17] | Да | AML/HSCT, death (RTEL1) | none detected |
| 72 | ЧО/ Рецидив | 30 | 45, XY,-7[20] | Да | Стабильно |
ASXL1 (24%) RUNX1 (12%) |
| 48 | ЧО/ Рецидив | 6 | 46,XX,del (7)(p13p15)[3]/ 46,XX[19] | Нет | HSCT | DNMT3A (15%) |
| 61 | ЧО | 6 | 45,XX,‑7[7]/ 46,XX[16] | Да | Proceeding to HSCT | none detected |
| 16 | Нет | 3 | 45,XY,‑7[6]/ 46,XY[14] | Нет | HSCT (RTEL1) | none detected |
Примечание.
VAF — вариантная частота аллелей.
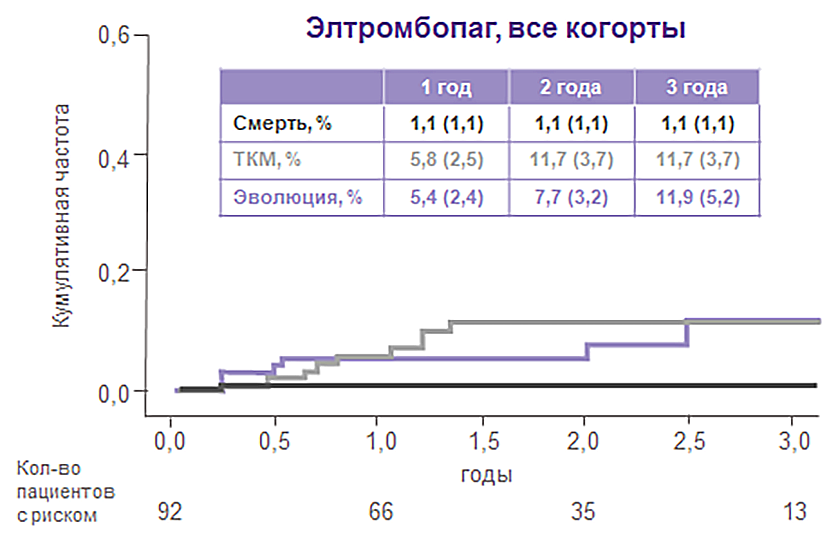
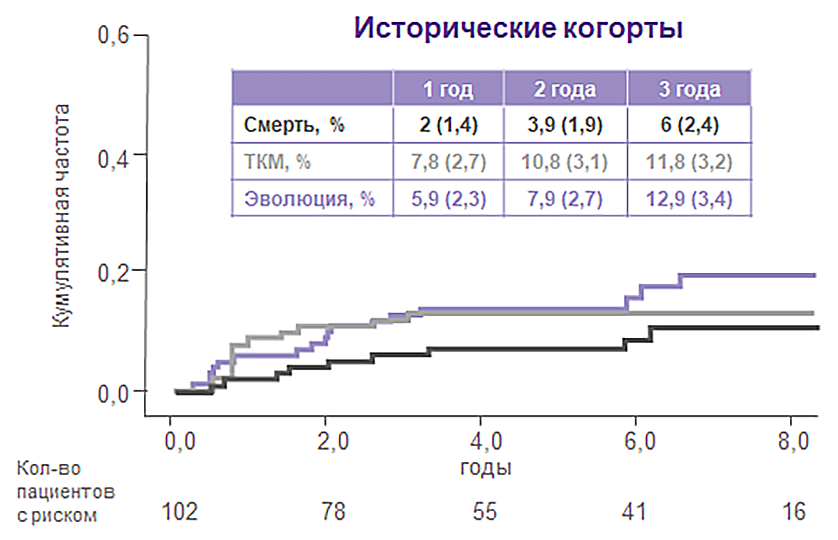
Через 2 года применения элтромбопага частота клональной эволюции составила 7,7%1,4.
В исторической когорте у пациентов, не принимавших элтромбопаг, этот показатель — 7,9%.
Нарушения функции печени были транзиторными и не приводили к отмене препарата элтромбопаг1
| НЯ 3 степени или выше или СНЯ, относящиеся к элтромбопагу, n (%) | Пациенты, n = 92 |
| Макулопапулезная сыпь | 0,01 |
| Зуд | 1 (1) |
| Боль в животе | 2 (2) |
| Лабораторное нарушение функции печени | 17 (18) |
| Увеличение АЛТ | 9 (10) |
| Увеличение АСТ | 3 (3) |
| Увеличение Бр | 12 (13) |
Два тяжелых НЯ в виде сыпи на коже привели к временной отмене элтромбопага.
Доли пациентов с соматической мутацией после лечения ИСТ и ИСТ + элтромбопаг5,6
22% vs 35% пациентов развивают соматические мутации после терапии ИСТ + элтромбопаг vs ИСТ моно.
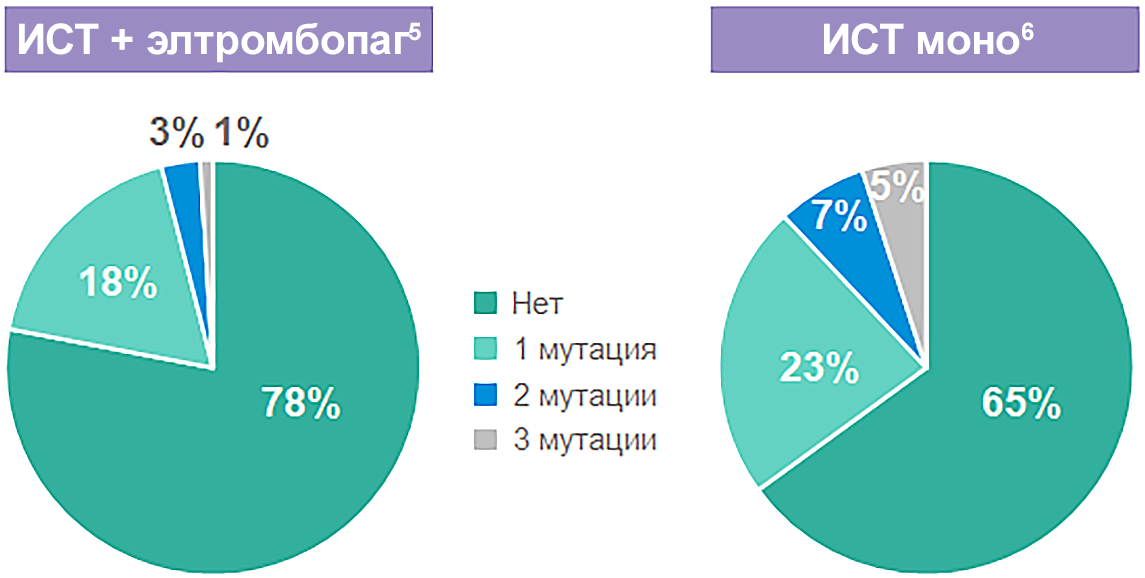
Общая частота мутаций при применении препарата элтромбопаг и без сопоставимы5–7
Частота выявления четырех наиболее частых мутаций при АА.
| Гены | Kulasekararaj7* | Yoshizato6† | NIH study5 |
| DNMT3A | 8,3% | 8,4% | 4% |
| ASXL1 | 8% | 6,2% | 8% |
| BCOR/BCORL1 | 4% | 9,3% | 7% |
| PIGA | N/A | 7,5% | N/A |
| Median VAF | 20% | 9,3% | 13% |
Примечание.
* 71% предварительно получали ИСТ, 29% — нет.
† Все ранее получали ИСТ.
VAF — вариантная частота аллелей.
Все пациенты, развившие соматические мутации, достигали гематологического ответа на элтромбопаг + ИСТ в 1 линии5
| Мутация «+», n = 20 (%) | Мутация «–», n = 70 (%) | |
| Общий ответ | 20 (100) | 60 (86) |
| Полный ответ | 13 (65) | 23 (33) |
| Клональная эволюция | 3 (15) | 4 (6) |
| Рецидив | 5 (25) | 20 (29) |
| Смерть | — | 3 (4) |
Показатели переносимости и безопасности терапии элтромбопаг + ИСТ сопоставимы с таковыми при стандартной ИСТ1
Серьезные нежелательные явления, связанные с препаратом элтромбопаг1.
| Явления |
Пациенты (n = 92)* Количество (%) |
|
| Кожа | ||
| Макулопапулезная сыпь† | 2 | (2) |
| Зуд | 1 | (1) |
| Боль в животе | 2 | (2) |
| Отклонения в результатах биохимических показателей функции печени | 17 | (18) |
| Повышение уровней АЛТ | 9 | (10) |
| Повышение уровней АСТ | 3 | (3) |
| Повышение уровней билирубина | 12 | (13) |
Примечание.
* Репрезентативно в отношении когорт 1, 2 и 3.
† У 2 пациентов (1 в когорте 2 и 1 в когорте 3) развилась тяжелая кожная реакция, в связи с которой Револейд был отменен.
ТАА — тяжелая апластическая анемия; АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза.
-
 Нарушения функции печени были транзиторными и не приводили к отмене элтромбопага1.
Нарушения функции печени были транзиторными и не приводили к отмене элтромбопага1. -
 Частота клональной эволюции на фоне терапии элтромбопаг + ИСТ была сопоставима с таковой при применении стандартной ИСТ1.
Частота клональной эволюции на фоне терапии элтромбопаг + ИСТ была сопоставима с таковой при применении стандартной ИСТ1.
-
Профиль безопасности у педиатрических пациентов (n = 37) соответствовал профилю безопасности, наблюдаемому в общей популяции1.
-
У 15 (10%) пациентов по результатам цитогенетических анализов были описаны аберрации, включая 7 пациентов с утратой хромосомы 7 и 1 пациента с признаками дисплазии костного мозга1.
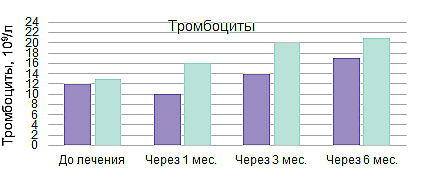
Линейный ответ на элтромбопаг в условиях реальной клинической практики8
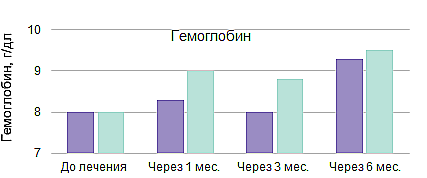
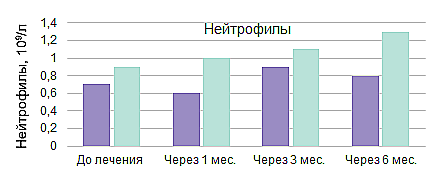
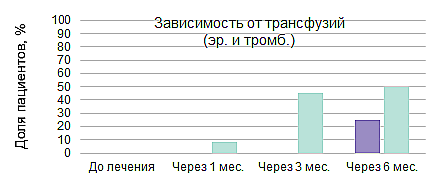
Результаты проспективного рандомизированного многоцентрового исследования EBMT III фазы по изучению применения АТГ и ЦсА в комбинации с элтромбопагом или без в 1-й линии терапии у пациентов с ТАА (RACE)9,10
Методы9,10

Первичная конечная точка:
-
Полный ответ (ПО) через 3 месяца.
-
ПО определен как:
-
Hb > 10 г/дл, АЧН > 1,000/мкл и тромбоциты > 100,000 мкл.
-
Вторичные конечные точки:
-
Общая выживаемость.
-
Гематологический ответ через 6 месяцев.
-
Клональная эволюция и аллельная нагрузка соматических миелоидных мутаций.
Критерии включения пациентов10
-
1.Установленный диагноз ТАА или СТАА, определенный на основании:
-
Как минимум двух из следующих критериев:
-
—абсолютное число нейтрофилов (АЧН) < 0,5 × 109/л (ТАА) или < 0,2 × 109/л (СТАА);
-
—тромбоциты < 20 × 109/л;
-
—ретикулоциты < 60 × 109/л;
-
-
Низкоклеточный костный мозг (< 30% клеточности без признаков фиброза или злокачественных клеток).
-
-
2.Возраст ≥ 15 лет.
Характеристика включенных пациентов11
| Arm A | Arm В | Total | |
| Число пациентов | 101 (51,3%) | 96 (48,7%) | 197 (100%) |
| Возраст (медиана, мин-макс) | 52 (15–81) | 55 (16–77) | 53 (15–81) |
| Возрастные категории (n, %) | |||
| < 18 | 7 (6,9%) | 2 (2,1%) | 9 (4,6%) |
| 18 –< 40 | 29 (28,7%) | 27 (28,1%) | 56 (28,4%) |
| 40 –< 65 | 43 (42,6%) | 43 (44,8%) | 86 (43,7%) |
| > 65 | 22 (21,8) | 24 (25,0%) | 46 (23,4%) |
| Пол (n, %) | |||
| Мужчины | 52 (51,5%) | 56 (58,3%) | 108 (54,8%) |
| Женщины | 49 (48,5%) | 40 (41,7%) | 89 (45,2%) |
| Тяжесть АА (n, %) | |||
| SAA | 67 (66,3%) | 62 (64,6%) | 129 (65,5%) |
| vSAA | 34 (33,7%) | 34 (35,4%) | 68 (34,5%) |
| Тромбоциты × 109/л (медиана, мин-макс) | 18 (1–76) | 15 (1–109) | 17 (1–109) |
| Нейтрофилы × 109/л (медиана, мин-макс) | 0,30 (0,00–1,54) | 0,46 (0,00–4,3) | 0,39 (0,00–4,3) |
| Лимфоциты × 109/л (медиана, мин-макс) | 1,43 (0,64–3,45) | 1,36 (0,14–2,73) | 1,40 (0,14–3,45) |
| Ретикулоциты × 109/л (медиана, мин-макс) | 20,0 (0,0–85,0) | 25,5 (0,0–121,0) | 21,1 (0,0–121,0) |
| Гемоглобин г/л (медиана, мин-макс) | 8,5 (2,3–10,8) | 8,3 (3,3–12,2) | 8,4 (2,3–12,2) |
| Гранулоциты PNH > 0,1% (n, %) | 58 (59,2%) | 42 (45,2%) | 100 (52,4%) |
| Гранулоциты PNH > 1,0% (n, %) | 44 (44,9%) | 33 (35,5%) | 77 (40,3%) |
Результаты9
-
Исходные характеристики были сравнимы в двух группах, включая средний возраст (52 и 55 лет), разбивку по возрасту (< 40 лет 35,6% и 30,2%), тяжесть течения болезни (сверхтяжелая АА 33,7% и 35,4% в группах А и В соответственно), наличие ПНГ-клона (59,2% и 45,2% в группах А и В соответственно).
-
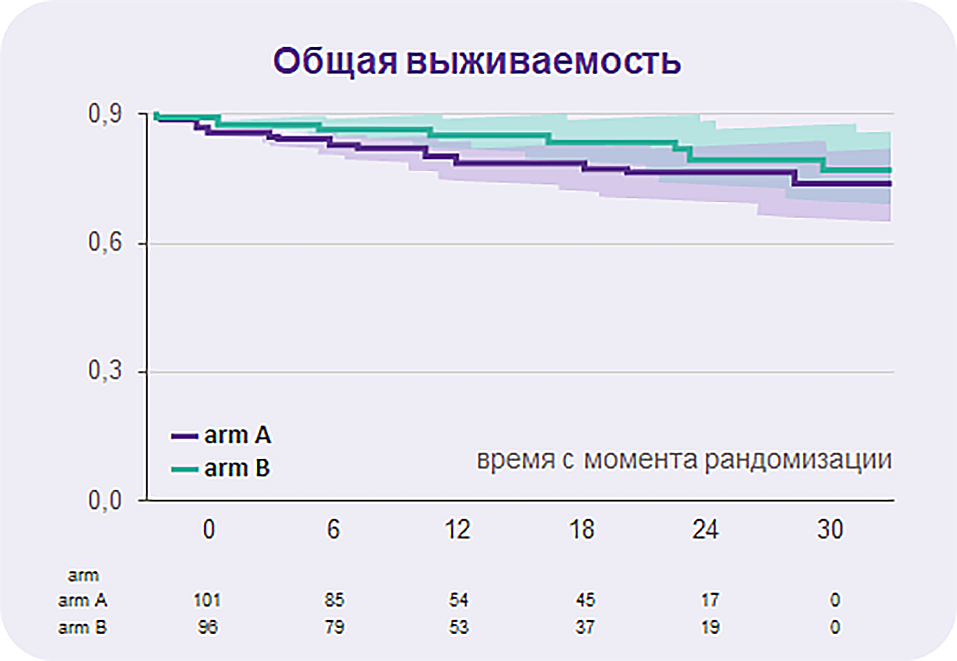
Средний период наблюдения составил 18 месяцев.
-
К моменту проведения анализа ОО через 6 месяцев для выживших пациентов, без трансплантации и клональной эволюции, составил 50,0% в группе A и 76,3% в группе B (OR: 3,8).
-
СНЯ были сопоставимы в обеих группах: 8 и 7 пациентов соответственно выбыли из исследования досрочно вследствие необходимости проведения ТКМ.
-
Клональная эволюция произошла у 1 пациента в группе А (нарушение кариотипа через 6,5 месяцев после рандомизации) и у 3 пациентов в группе B (2 нарушения кариотипа и 1 МДС через 6,2, 6,3 и 12,0 месяца после рандомизации).
-
Был проведен NGS-анализ с использованием молекулярной таргетной панели из 31 гена. К моменту проведения этого анализа были доступны образцы 163 пациентов на старте исследования и 132 пациентов через 6 месяцев, изменений со стороны соматических миелоидных мутаций зафиксировано не было (baseline: VAF > 1% 38,2% в группе A vs 36,6% в группе B).
За время исследования умерло 22 пациента9:
-
14 в группе А, OS 83,2% через 24 месяца.
-
8 в группе B, OS 86,3% через 24 месяца (p = 0,142)
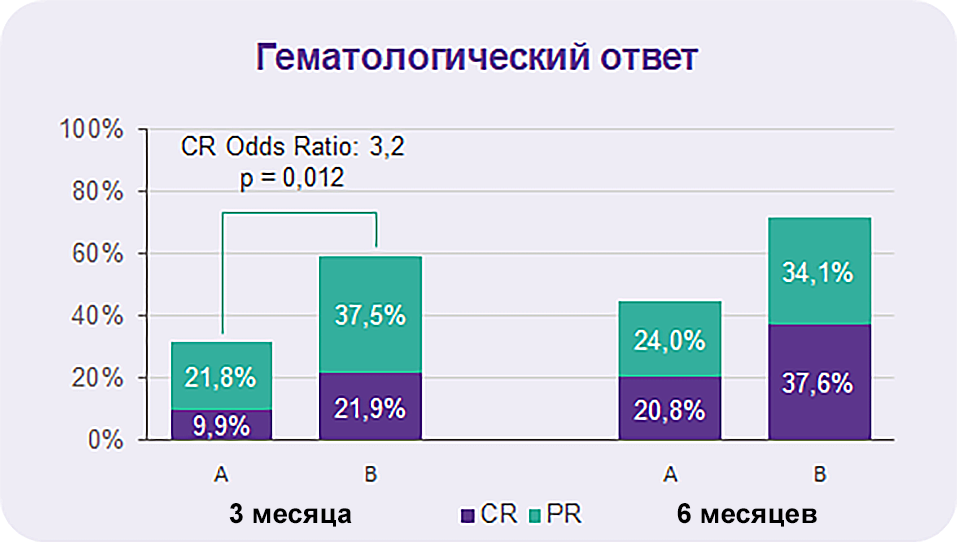
ПКК была достигнута у 9,9% и 21,9% пациентов групп A и B соответственно (OR 3,2, p = 0,012)9.
Частота достижения общего ответа (ОО = ПО + ЧО) составила 31,7% и 59,4% соответственно.
Заключение9
Результаты этого исследования поддерживают применение комбинации лАТГ, ЦсА и элтромбопага в качестве стандарта терапии первой линии для пациентов с ТАА и СТАА, не подлежащих трансплантации.
Литературные источники:
- Townsley D.M. et al. Eltrombopag Added to Standard Immunosuppression for Aplastic Anemia. N Engl J Med. 2017;376(16):1540-1550. doi: 10.1056/NEJMoa1613878
- Scheinberg P. et al. Haematologica 2009;94:348–354.
- Scheinberg P. et al. N Engl J Med 2011;365:430–438.
- Dumitriu B. et al. Blood 2015;125:706–709.
- Townsley D.M. et al. Blood 2016;128:abst 727, oral presentation at ASH 2016.
- Yoshizato T. et al. N Engl J Med 2015;373:35–47.
- Kulasekararaj A.G. et al. Blood 2014;124:2698–2704.
- Lengline E. et al. Nationwide survey on the use of eltrombopag in patients with severe aplastic anemia: a report on behalf of the French Reference Center for Aplastic AnemiaHaematologica 2018, Volume 103(2):212-220.
- Régis Peffault de Latour, Results of the EBMT SAAWP phase III prospective randomized multicenter RACE study of horse ATG and Ciclisporin with or without Eltrombopag in naive SAA patients. EBMT-2020 abstract, available at https://www.professionalabstracts.com/ebmt2020/iPlanner/#/presentation/776
- Régis Peffault de Latour, EBMT-2018 poster, available at https://www.ebmt.org/sites/default/files/2018-04/1.%20EBMT2018_Poster_CTO_Race_FINAL.pdf
- Régis Peffault de Latour, Results of the EBMT SAAWP phase III prospective randomized multicenter RACE study of horse ATG and Ciclisporin with or without Eltrombopag in naive SAA patients. EBMT-2020 RACE trial poster, available at https://www.ebmt.org/sites/default/files/2020-08/RACE%20Trial.pdf
667443/HEMA/DIG/06.2023/0
