Обзор данных по заболеванию
Миелодиспластические синдромы (другое название – миелодисплазии) представляют собой разнородную группу нарушений со стороны гемопоэтических стволовых клеток, которые характеризуются дисморфией костного мозга и неэффективным гемопоэзом, ведущим к цитопении. Цитопения наиболее часто проявляется в форме анемии (уменьшение количества циркулирующих эритроцитов), при этом она может наблюдаться как отдельно, так и в сочетании с нейтропенией, тромбоцитопенией или и тем, и другим. У пациентов с миелодиспластическим синдромом наблюдается повышенный риск развития острого миелолейкоза1,42,43.
Миелодиспластический синдром развивается в результате воздействия токсинов из окружающей седы или радиации, противоопухолевой терапии, генетических мутаций или вирусных инфекций. У некоторых пациентов наблюдается серия молекулярных дефектов, вызванных генетическими факторами или факторами среды. Идиопатический миелодиспластический синдром представляет собой заболевание, наиболее часто наблюдаемое у пожилых людей, в то время как вторичный или связанный с лечением миелодиспластический синдром может развиваться независимо от возраста43,44.
- Гемопоэтический — Касающийся образования и развития клеток крови1.
- Стволовые клетки — любые клетки, способные развиваться в более специфично-дифференцированные «дочерние» клетки; присутствуют в костном мозге, эмбриональных тканях, периферической крови и крови пупочной вены1.
- Дисморфия — неправильная форма1.
- Гемопоэз — образование и развитие клеток крови1.
- Цитопения — снижение количества клеток в крови1.
- Нейтропения — патологически низкое количество нейтрофилов (наиболее распространенный тип лейкоцитов) в крови1.
- Идиопатический — Возникший в результате неясной или в настоящее время неустановленной причины1.
Эпидемиология
Миелодиспластический синдром является наиболее распространенным гемопоэтическим злокачественным новообразованием, наблюдаемым у пациентов старше 80 лет. В любом возрасте этим заболеванием больше страдают мужчины, чем женщины, и частота миелодиспластического синдрома (МДС) значительно повышается после 50 лет. МДС редко встречается у детей, однако в отличие от взрослых у детей максимальный риск наблюдается в наиболее раннем возрасте42,45.
Зафиксированная распространенность МДС в общей популяции в мире варьирует от 35 до свыше 100 на 1 миллион человек. Распространенность выше в популяции взрослых людей старшего возраста (120 - >500 на 1 миллион человек). Распространенность МДС увеличилась с течением времени в результате улучшения идентификации синдромов медицинскими работниками и старения популяции44.
Этиология и патогенез
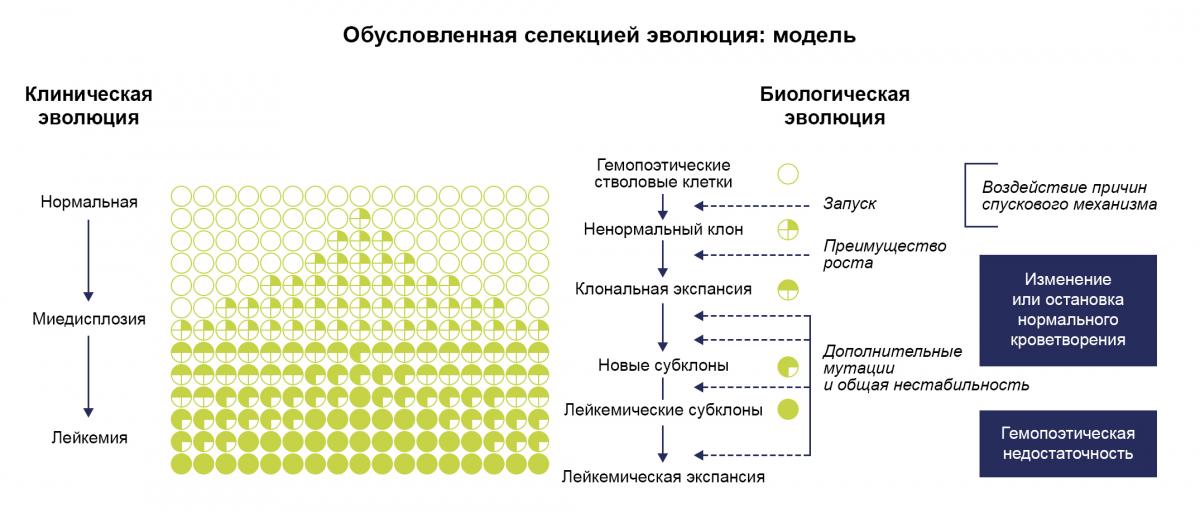
МДС возникает в результате повреждения гемопоэтических стволовых клеток, обусловленного действием радиации и цитотоксических химических соединений (например, бензола). Прочие факторы риска включают курение, воздействие органических растворителей и/или ионизирующего излучения, а также наличие родственников первой степени родства с гемопоэтическими злокачественными новообразованиями. Тем не менее, одинаковых результатов для этих дополнительных факторов риска не зафиксировано. Вторичный МДС возникает после противоопухолевой терапии, включающей лучевую терапию и/или химиотерапию, и его развитие может занять несколько лет. Примерно у 50% пациентов с идиопатическим МДС присутствуют хромосомные аберрации. У пациентов с острым миелолейкозом также наблюдается ряд цитогенетических отклонений, выявляемых при МДС, что подтверждает их общий источник развития. Кроме того, в МДС может эволюционировать апластическая анемия и анемия Фанкони (см. редкие формы анемии)42,45.
МДС представляет собой клональные гематологические расстройства, при которых потомство какой-либо единственной клетки становится доминирующим в костном мозге. Селективное превосходство этих клеток, по-видимому, обусловлено генетическими мутациями, устраняющими ограничения, характерные для нормального роста, и нарушающими полное созревание. Миелодиспластические клоны являются генетически нестабильными, вследствие чего наблюдается предрасположенность к развитию дополнительных мутаций, приводящих к появлению новых субклонов. Прогрессирование миелодиспластического процесса первоначально проявляется в виде дисфункции костного мозга, которая в конечном итоге развивается в острый миелолейкоз (ОМЛ)46.
- Хромосомная аберрация — аномалия хромосом, касающаяся их количества или генетического материала1.
- Клональные — группа клеток, которые произошли от одной общей клетки1.
Клинические симптомы
Клинические симптомы большинства пациентов с сопровождающимся симптоматикой МДС практически всегда представляют собой прямое следствие типа и уровня имеющейся у них цитопении. Клинические симптомы МДС включают43:
-
Анемия — у большинства пациентов с МДС наблюдается различная степень анемии. Более чем у половины пациентов наблюдается значимая анемия с уровнем Hb <10. У пациентов может наблюдаться усталость и одышка, а также бледность. Кроме того, анемия может увеличить тяжесть симптомов сопутствующих заболеваний, например, Ишемической Болезни Сердца или заболеваний легких, которые часто встречаются у пожилых пациентов.
-
Нейтропения — примерно у 40% пациентов с МДС наблюдается нейтропения (снижение количества лейкоцитов). Нейтропения повышает риск инфекций, например, пневмонии или инфекции мочевыводящих путей. Кроме того, у некоторых пациентов наблюдаются рецидивирующие инфекции даже в том случае, если у них еще не развилась нейтропения; несмотря на нормальное количество лейкоцитов у этих больных отмечается нарушение их функционирования.
-
Тромбоцитопения — еще у 40% пациентов с МДС наблюдается тромбоцитопения. У этих больных повышена склонность к образованию кровоподтеков и кровотечениям. У них часто встречаются носовые и десневые кровотечения, в особенности после стоматологических процедур.
Кроме того, примерно у 20% пациентов наблюдается спленомегалия. Возможны также нетипичные кожные очаги44.
Диагноз
Для постановки диагноза МДС требуется тщательное обследование с целью надлежащей оценки риска и подбора подходящего лечения. Обязательным является подробный сбор анамнеза и оценка клинического статуса, поскольку оба этих фактора играют роль в отнесении пациента в подходящую подкатегорию для прогноза и планирования терапии42,43.
Диагностическое обследование должно включать43,47,48:
-
Анализы крови
- Общий клинический анализ крови с количеством ретикулоцитов
- Мазок периферической крови для определения степени дисплазии эритроцитов
-
Измерение уровня следующих веществ в сыворотке
- Эритропоэтин
- Фолат и витамин B12 с целью исключения их дефицита как причины анемии
- Ферритин
- Железо
-
Аспирация / биопсия костного мозга с целью изучения цитопений, исключения других диагнозов и проведения цитогенетической оценки. Анализ костного мозга также требуется для определения процента бластных клеток.
- Ретикулоцит — заключительная незрелая стадия развития эритроцитов; в нормальной крови обычно содержится примерно 1% ретикулоцитов1.
- Дисплазия — патологическое развитие клеток1.
Диагностика МДС у пациентов с бессимптомным течением заболевания. Все большему количеству пациентов ставят диагноз МДС, когда у них все еще отсутствуют какие-либо клинические проявления. У этих больных отклонения со стороны количества клеток крови выявляются во время рутинного обследования43.
Системы классификации
На протяжении последних лет для помощи в диагностике, прогнозировании и подборе лечения пациентов с МДС были разработаны несколько систем классификации. Эти системы, применяемые для диагностики МДС, включают47:
-
Франко-американо-британская система (ФАБ), в которой пациентов классифицируют на основании морфологии клеток и количества бластных клеток в костном мозге.
-
Система Всемирной Организации Здравоохранения (ВОЗ), в рамках которой система классификации ФАБ дополняется цитогенетическими и иммунофенотипическими характеристиками.
- Бластная клетка — Недавно образовавшаяся клетка любого типа1.
Цитогенетические отклонения и прогноз. Цитогенетические отклонения, наблюдающиеся примерно у 50% пациентов с МДС, обладают прогностической ценностью в случае использования совместно с системами классификации ФАБ и ВОЗ наиболее распространенной цитогенетической аномалией является делеция длинного плеча хромосомы 5, известная под названием del(5q). У пациентов с МДС и del(5q) как единственной цитогенетической аномалией обычно наблюдается более благоприятный прогноз по сравнению с пациентами с комплексными аномалиями47.
Системные стратификации риска
После постановки диагноза МДС системы классификации ФАБ и ВОЗ используются в сочетании с тремя распространенными системами прогностической оценки для определения прогноза у пациента и для подготовки рекомендаций по надлежащей программе лечения. Эти системы стратификации риска включают47,48,49:
-
Международная прогностическая система оценки (IPSS)
-
Пересмотренная система IPSS (IPSS-R)
-
Основанная на классификации ВОЗ прогностическая система оценки (WPSS)
IPSS
В системе IPSS пациентов стратифицируют на различные подгруппы на основании оценки, определяемой исходя из следующих факторов47,48:
-
Процент бластных клеток в костном мозге
-
Цитогенетические отклонения
-
Количество цитопений
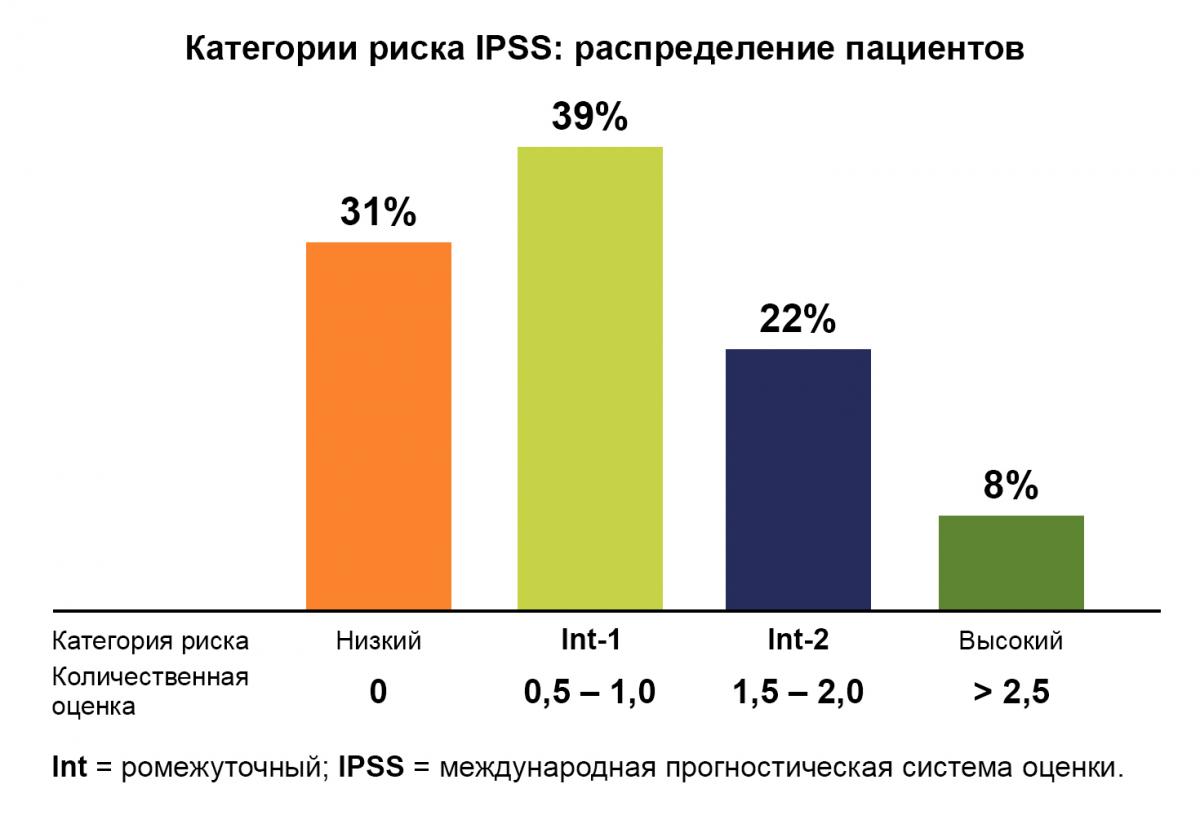
Тем не менее, система IPSS не предназначена для получения прогностических сведений, ее можно использовать только на момент постановки диагноза50,51:
На основании расчетной оценки IPSS пациентов относят к 1 из 4 групп риска, каждый из которых характеризуется различной медианой выживаемости48,51.
| Группа риска IPSS | Оценка IPSS | Расчетная медиана выживаемости (годы) |
| Низкий | 0 | 5,7 |
| Промежуточный-1 | 0,5 – 1,0 | 3,5 |
| Промежуточный-2 | 1,5 – 2,0 | 1,2 |
| Высокий | >2 | 0,4 |
IPSS-R
IPSS недавно была дополнена, и пересмотренная версия называется IPSS-R. В IPSS-R помимо IPSS содержится следующая информация49:
-
Дополнительные цитогенетические подгруппы
-
Тяжесть цитопений
-
Новые категории для процентов бластных клеток в костном мозге
-
Отличительные характеристики, например, возраст, функциональный статус и ферритин сыворотки
На основании расчетной оценки IPSS-R пациентов распределяют в 1 из 5 групп риска, каждый из которых характеризуется различной медианой выживаемости49.
| Группа риска IPSS-R | Оценка IPSS-R | Расчетная медиана общей выживаемости (годы) |
| Очень низкий | 0 – 2 | 8,8 |
| Низкий | >2 – 3,5 | 5,3 |
| Промежуточный | >3,5 – 5 | 3,0 |
| Высокий | >5 – 6 | 1,6 |
| Очень высокий | >6 | 0,8 |
WPSS
WPSS представляет собой динамическую и зависящую от времени систему оценки, которую можно использовать в любое время на протяжении заболевания для прогнозирования выживаемости и вероятности эволюции в острый миелолейкоз. Эта система основана на комбинации следующих факторов47:
-
Классификация подгрупп ВОЗ
-
Цитогенетический риск согласно IPSS
-
Потребность в трансфузиях
-
Функциональный статус и степень цитопений (используется в обновленных версиях WPSS)
На основании WPSS пациентов с МДС подразделяют на 5 групп риска, каждый из которых характеризуется различной общей выживаемостью50.
| Группа риска WPSS | Оценка WPSS | Расчетная медиана общей выживаемости (месяцы) |
| Очень низкий | 0 | 103 |
| Низкий | 1 | 72 |
| Промежуточный | 2 | 40 |
| Высокий | 3 – 4 | 21 |
| Очень высокий | 5 – 6 | 12 |
Клинические исследования по определению прогноза у пациентов с МДС
Malcovati et al, 2007
Malcovati et al использовал систему WPSS в 2 группах пациентов с МДС, при этом были получены следующие результаты:
-
При постановке диагноза у пациентов из 5 групп риска наблюдались статистически значимые различия общей выживаемости, а также статистически значимые различия риска прогрессирования в ОМЛ. Возраст оказывал значимый эффект на общую выживаемость в группах с очень низким и низким риском, при этом у пациентов старшего возраста прогноз был менее благоприятным по сравнению с более молодыми пациентами50.
-
Пациенты из 5 групп риска статистически значимо различались по вероятности прогрессирования в более высокую группу риска WPSS50.
-
Подгруппы ВОЗ, цитогенетические характеристики и потребность в трансфузиях статистически значимо влияли как на общую выживаемость, так и на риск прогрессирования в ОМЛ50.
Sanz et al, 2008
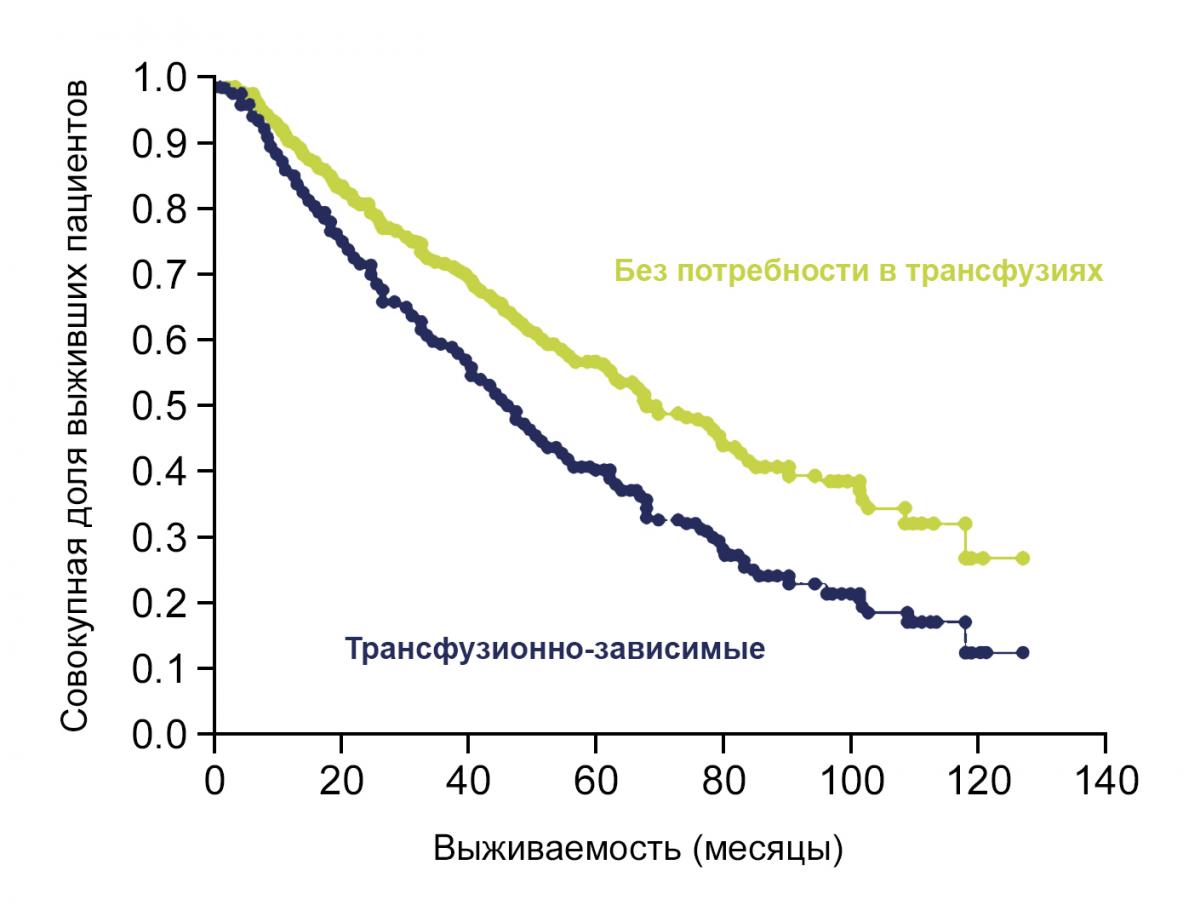
В исследовании, проведенном Sanz с коллегами в большой группе из 2994 пациентов с идиопатическим МДС, оценивалась независимая прогностическая ценность потребности в трансфузиях эритроцитарной массы и развитие перегрузки железом в этой группе пациентов52.
В этом исследовании были получены следующие ключевые результаты52:
-
У пациентов с МДС, у которых при постановке диагноза наблюдалась потребность в трансфузиях, был зафиксирован наихудший прогноз среди групп пациентов. В частности, медиана общей выживаемости и трансфузионно-зависимых пациентов при постановке диагноза, у пациентов, у которых зависимость от трансфузий возникла во время заболевания, и трансфузионно-независимых пациентов была равна 19, 60 и 96 месяцев соответственно (p<0,0001).
-
Развитие перегрузки железом и зависимость от трансфузий были тесно связаны с общей выживаемостью, при этом их использование добавляло значимую независимую прогностическую информацию к IPSS и WPSS.
-
Перегрузка железом и зависимость от трансфузий обладает независимым влиянием на трансформацию в ОМЛ.
-
Предотвращение или уменьшение перегрузки железом в результате надлежащей хелаторной терапии может коррелировать с улучшением общей выживаемости и снижением риска трансформации в ОМЛ у пациентов с МДС.
Варианты лечения
Подбор терапии для пациентов с МДС зависит от нескольких факторов, связанных с пациентами и заболеванием: возраст, симптомы, сопутствующие заболевания, стадия заболевания, категория риска и наличие подходящего донора для трансплантации костного мозга48.
Различные варианты лечения для пациентов с МДС могут использоваться как самостоятельно, так и в составе комбинаций; они включают потенциально радикальные и поддерживающие виды лечения42,48.
| Радикальная терапия | Прочие варианты лечения | Поддерживающая терапия |
|
|
|
- Аллогенный — генетически схожий, но не идентичный1.
Аллогенная трансплантация гемопоэтических стволовых клеток
Аллогенная трансплантация гемопоэтических стволовых клеток является единственным вариантом радикальной терапии для пациентов с МДС. В зависимости от интервала с постановки диагноза до трансплантации, возраста пациента, источника гемопоэтических стволовых клеток и применяемого режима кондиционирования не связанная с рецидивами смертность при трансплантации варьирует в диапазоне от 25 до 65%. Тем не менее, у пациентов старшего возраста наблюдается особенно высокий риск связанных с лечением осложнений и смерти42,44.
Химиотерапия
Для эрадикации патологических бластных клеток может использоваться химиотерапия. Ее рекомендуется проводить пациентам с МДС высокого риска для достижения длительной ремиссии42,48.
Деметилирующие агенты
Деметилирующие агенты (азацитидин и децитабин) действуют за счет ингибирования метилирования ДНК, что приводит к нарушению экспрессии генов44.
Европейское Агентство по Лекарственным Средствам (EMA) одобрило применение азацитидина у пациентов с МДС промежуточного-2 и высокого риска по классификации IPSS, которым не показана аллогенная трансплантация стволовых клеток. Децитабин, напротив, не зарегистрирован для лечения пациентов с МДС53,54.
Иммуномодулирующая терапия
Иммуномодулирующий препарат леналидомид действует путем стимуляции иммунной системы, ингибирования роста новых кровеносных сосудов и стимуляции гибели определенных опухолевых клеток48,55.
Леналидомид характеризуется особенно высокой эффективностью в лечении анемии у пациентов с МДС и мутацией del(5q). Его положительные эффекты заключаются не только в повышении количества нормальных клеток крови, но также и в достижении ремиссии42,44.
EMA не одобрило леналидомид для лечения пациентов с МДС55.
Иммунодепрессанты
Иммунодепрессанты, например, антитимоцитарный глобулин или циклоспорин, способствуют элиминации характеризующихся патологической пролиферацией лейкоцитов под названием T-клетки, которые предположительно нарушают нормальное развитие клеток крови. Иммунодепрессанты рекомендуется применять пациентам с МДС низкого риска42,48.
Гемотрансфузии
Трансфузии эритроцитарной массы используются для коррекции сопровождающейся симптоматикой анемии, которая наблюдается у большинства (примерно 80%) пациентов с МДС. Задачи трансфузионной терапии заключаются в поддержании уровня Hb в крови 90-100 г/л или выше в зависимости от возраста пациента и сопутствующих заболеваний. Кроме того, пациентам со значимой тромбоцитопенией могут потребоваться трансфузии тромбоцитарной массы для профилактики кровотечений42,48.
Поддерживающая терапия с использованием гемотрансфузий может быть очень эффективна у пациентов с МДС и анемией. Анемия сопровождается выраженным нарушением качества жизни и является фактором риска сердечной недостаточности. Пациенты с МДС, которым показаны регулярные гемотрансфузии принадлежат в том числе к следующим категориям42,48.
-
Низкий или промежуточный-1 риск по IPSS с тяжелой анемией (стойкое снижение гематокрита до значений <25% или уровень гемоглобина <10 г/дл)
-
Сидеробластная анемия по классификации ФАБ или ВОЗ; сидеробластная анемия представляет собой состояние, при котором эритроциты не способны включать железо в гемоглобин
Частота гемотрансфузий у пациентов с МДС и сопровождающейся симптоматикой анемией варьирует в зависимости от имеющихся у конкретного пациента симптомов, гематокрита или уровня гемоглобина. Как правило, пациенты с МДС, которым требуются регулярные гемотрансфузии, получают по 2 единицы каждые 2-6 недель48.
У пациентов с МДС, получающих многократные гемотрансфузии, может развиться потенциально опасная перегрузка железом. Для лечения перегрузки железом может использоваться хелаторная терапия48.
- Гематокрит — Процент от общего объема крови, который составляют эритроциты1.
Зависимость от трансфузий и выживаемость. Согласно клиническим данным у пациентов с МДС наблюдается снижение выживаемости после развития у них зависимости от гемотрансфузий. Это может быть обусловлено тяжелой недостаточностью костного мозга у получающих гемотрансфузии пациентов и неадекватной хелаторной терапией56.
Эритропоэтин и другие факторы роста
Гемопоэтические факторы роста действуют на костный мозг с целью увеличения образования клеток крови, в результате этого уменьшается потребность в трансфузиях48.
Анемия является наиболее распространенной формой цитопении у пациентов с МДС. Терапия эритропоэтином улучшает течение анемии у этих больных45.
Пациенты с МДС и низким количеством лейкоцитов, в частности с нейтропенией, часто получают лечение гранулоцитарным колониестимулирующим фактором (G-CSF) и гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF) с целью улучшения количества нейтрофилов. У некоторых пациентов с нейтропенией наблюдается предрасположенность к развитию бактериальных инфекций48.
Антибиотики
Лейкоциты не поддаются коррекции при помощи трансфузий. Таким образом, пациентам с МДС для лечения бактериальных инфекций или профилактики рецидивов может потребоваться антибиотикотерапия48.
Агонисты тромбопоэтина
Агонист тромбопоэтина ромиплостим повышает образование тромбоцитов путем действия на тромбопоэтиновые рецепторы. По результатам клинических исследований ромиплостим повышает количество тромбоцитов у пациентов с тромбоцитопенией. Таким образом, это может применяться для лечения тромбоцитопении и профилактики кровотечений у пациентов с МДС низкого риска57.
Терапия хелаторами железа
У получающих регулярные трансфузии эритроцитарной массы пациентов с МДС существует риск развития связанной с трансфузиями перегрузки железом, которое может негативно влиять на сердце, печень и органы эндокринной системы. У получающих гемотрансфузии пациентов с МДС наблюдалось значимое увеличение частоты кардиологических осложнений и сахарного диабета по сравнению с пациентами без гемотрансфузий. Кроме того, клинические данные позволяют предположить, что перегрузка железом является независимым прогностическим фактором, влияющим на общую выживаемость и прогрессирование в ОМЛ58.
Крометого, частично ретроспективные данные свидетельствуют о том, что у пациентов с МДС низкого и промежуточного-1 риска поIPSS, получающих хелаторы железа, возможно улучшение медианы общей выживаемости по сравнению с пациентами, не получающими хелаторы. У пациентов снизкимрискомпоIPSS, которым проводится хелаторная терапия, медиана общей выживаемости составляет 138 месяцев по сравнению с 70 месяцами у пациентов без хелаторной терапии (p=0,015). У пациентов с МДС промежуточного-1 риска при проведении хелаторной терапии медиана выживаемости составляет 115 месяцев по сравнению с 36 месяцами у пациентов без хелаторной терапии (p=0,003)59.
На основании консенсусного мнения экспертов в большинстве современных руководств по лечению трансфузионно-зависимым пациентам с более низким риском (низкий риск или промежуточный-1 риск поIPSS) и уровнем ферритина в сыворотке >1000 мкг/л в зависимости от частоты трансфузий рекомендуется терапия хелаторами железа58.
Исследование EPIC. В исследовании по оценке хелаторной терапии у пациентов (Evaluation of Patients’ Iron Chelation, EPIC) было проведено проспективное изучение, можно ли достичь клинически приемлемого связывания железа у пациентов с различными трансфузионно-зависимыми анемиями. Деферазирокс применялся в фиксированной начальной дозе в зависимости от поступления железа в ходе продолжающихся гемотрансфузий. Дальнейшая титрация дозы выполнялась на основании тенденций со стороны ферритина сыворотки и маркеров безопасности. В этом исследовании был подтвержден профиль эффективности и безопасности деферазирокса у пациентов с МДС58.
Деферазирокс снижает уровень железа в печени у пациентов с МДС. Терапия деферазироксом привела к статистически значимому снижению концентраций железа в печени, составившему –9,9 мг Fe/г сухого веса, у пациентов с МДС (p<0,001, n=19) в ключевом регистрационном исследовании. Частота эффективного снижения концентраций железа в печени при применении различных доз деферазирокса составила 79%60.
Деферазирокс снижает уровень ферритина в сыворотке у пациентов с МДС. Терапия деферазироксом приводила к снижению уровня ферритина в сыворотке уже через 3 месяца, при этом данный эффект сохранялся при продолжении терапии в клиническом исследовании. Через 3 месяца (n=259) медиана изменений уровня ферритина сыворотки была равна -270 мкг/л по сравнению с исходным уровнем; через 12 месяцев (n=171) медиана изменений уровня ферритина сыворотки была равна –606 мкг/л по сравнению с исходным уровнем60.
Молекулярный генетический анализ
Диагноз талассемии также можно поставить при помощи молекулярных генетических анализов. Они позволяют выявить распространенные мутации глобиновых генов, которые приводят к развитию различных форм талассемий. Генетическое консультирование и пренатальная диагностика также используется у отдельных лиц и у пар из группы риска22.
Дифференциальный диагноз
Поскольку микроцитарная анемия может быть обусловлена и рядом других причин, например, дефицитом железа, отравлением свинцом и видами анемии помимо талассемии, может потребоваться дальнейший анализ крови. Ряд дополнительных тестов могут включать оценку среднего объема эритроцитов (MCV) и ширину распределения эритроцитов по объему (RDW). В сочетании с анамнезом пациентов эти тесты могут позволить исключить некоторые другие потенциальные причины микроцитарной анемии25.
Диагноз трансфузионно-независимой талассемии
| Промежуточная β-талассемия | HbЕ / β-талассемия | Болезнь HbН | |
| Уровни Hb | 7-10 г/дл24 |
|
|
| Анализ ДНК | В случае патологических результатов общего клинического анализа крови проводится генетический анализ для идентификации мутации24 | Для дифференциальной диагностики другими формами малой талассемии28 | Для 7 типичных для α-талассемии делеций разработана Gap-PCR29 |
| ВЭЖХ Электрофорез |
|
|
|
| Мазок крови |
|
|
|
Литературные источники:
- Venes D, Biderman A, Fenton B, et al, eds. Taber's Cyclopedic Medical Dictionary. 21st ed. Philadelphia, PA: F.A. Davis Company; 2009.
- Steiberg MH, Benz EJ, Adewoye AH, et al. Disorders of Iron Metabolism: Iron deficiency and Iron Overload. In: Hoffman R, Benz EJ, Shattil SJ, et al, eds. Hematology: Basic Principles and Practice. 5th ed. Philadelphia, PA: Elsevier; 2009:453-468.
- Anderson GJ. Mechanisms of iron loading and toxicity. Am J Hematol. 2007;82(S12):1128-1131.
- Powell lW. Hemochromatosis. In: Longo DL, Kasper DL, Jameson JL, et al, eds. Harrison's Principles of Internal Medicine. 18th ed. New York, NY: McGraw-Hill Companies, Inc.; 2012:3162-3167.
- Benz EJ. Disorders of Hemoglobin. In: Longo DL, Kasper DL, Jameson JL, et al, eds. Harrison's Principles of Internal Medicine. 18th ed. New York, NY: McGraw-Hill Companies, Inc.; 2012:852-861.
- Giardina PJ, Steiberg MH. Thalassemia Syndromes. In: Hoffman R, Benz EJ, Shattil SJ, et al, eds. Hematology: Basic Principles and Practice. 5th ed. Philadelphia, PA: Elsevier; 2009:535-563.
- Tortora GJ, Derrickson B. The cardiovascular system: the blood. In: Roesch B, Berry M, Muriello L, et al, eds. Principles of Anatomy & Physiology. 13th ed. Hoboken, NJ: John Wiley & Sons, Inc.; 2012:728-756.
- Cappellini MD. The Thalassemias. In: Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, PA: Elsevier; 2012:1060-1066.
- Kumar V, Abbas AK, Fausto N, et al. Red blood cell and bleeding disorders. In: Kumar V, Abbas AK, Fausto N, et al, eds. Robbin and Cotran Pathologic Basis of Disease. 8th ed. Philadelphia,PA: Saunders Elsevier; 2010:639-675.
- Kumar V, Abbas AK, Fausto N, et al. Red blood cell and bleeding disorders. In: Kumar V, Abbas AK, Fausto N, et al, eds. Robbin and Cotran Pathologic Basis of Disease. 8th ed. Philadelphia,PA: Saunders Elsevier; 2010:639-675.
- Thalassaemia International Foundation. Guidelines for the Clinical Management of Thalassaemia. 2nd revised edition. 2008. Available at: httр://thаlassaemia.org.cy/publications.html. Accessed February 14, 2012.
- Shawky RM, Kamal TM. Thalassemia intermedia: An overview. The Egyptian Journal of Medical Human Genetics. 2012;13:245-255.
- Forget BG, Olivieri NF. Hemoglobin synthesis and the thalassemias. In: Handin RI, Lux SE, Stossel TP, eds. Blood: Principles and Practice of Hematology. 2nd ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2003:1503-1596.
- Cotran RS, Kumar V, Collins T. Red cells and bleeding disorders. In: Robbins Pathologic Basis of Disease. 6th ed. Philadelphia, USA: W.B. Saunders Company; 1999:601-643.
- Taher AT, Musallam KM, Cappellini MD, et al. Optimal management of beta thalassaemia intermedia. Br J Haematol. 2011;152(5):512-523.
- Fucharoen S, Ketvichit P, Pootrakul P, et al. Clinical manifestation of beta-thalassemia/hemoglobin E disease. J Pediatr Hematol Oncol. 2000;22(6):552-557.
- Taher AT, Porter J, Viprakasit V, et al. Deferasirox reduces iron overload significantly in nontransfusion-dependent thalassemia: 1-year results from a prospective, randomized, double-blind, placebo-controlled study. Blood. 2012;120(5):970-977.
- HiggsDR, EngelJD, StamatoyannopoulosG. Thalassaemia. Lancet. 2012;379(9813):373-383. Taher AT, Cappellini MD, Musallam KM. Recent advances and treatment challenges in patients with non-transfusion-dependent thalassemia. Blood Rev. 2012;26 Suppl 1:S1-S2.
- HiggsDR, EngelJD, StamatoyannopoulosG. Thalassaemia. Lancet. 2012;379(9813):373-383. Taher AT, Cappellini MD, Musallam KM. Recent advances and treatment challenges in patients with non-transfusion-dependent thalassemia. Blood Rev. 2012;26 Suppl 1:S1-S2.
- Benz EJ. Disorders of hemoglobin. In: Longo DL, Kasper DL, Jameson JL, et al, eds. Harrison's Principles of Internal Medicine. 18th ed. New York, NY: McGraw-Hill Companies, Inc.; 2012:852-861.
- Weatherall DJ. The definition and epidemiology of non-transfusion-dependent thalassemia. Blood Rev. 2012;26 Suppl 1:S3-S6.
- Musallam KM, Cappellini MD, Wood JC, et al. Iron overload in non-transfusion-dependent thalassemia: a clinical perspective. Blood Rev. 2012;26 Suppl 1:S16-S19.
- Galanello R, Origa R. Beta-thalassemia. Orphanet J Rare Dis. 2010;5:11.
- Hoffbrand AV, Taher A, Cappellini MD. How I treat transfusional iron overload. Blood. 2012;120(18):3657-3669.
- Galanello R, Origa R. Beta-thalassemia. Orphanet J Rare Dis. 2010;5:11.
- Muncie HL, Jr., Campbell J. Alpha and beta thalassemia. Am Fam Physician. 2009;80(4):339-344.
- Shander A, Berth U, Betta J, et al. Iron overload and toxicity: implications for anesthesiologists. J Clin Anesth. 2012;24(5):419-425.
- Fucharoen S, Viprakasit V. Hb H disease: clinical course and disease modifiers. Hematology Am Soc Hematol Educ Program. 2009:26-34.
- Vichinsky E. Hemoglobin e syndromes. Hematology Am Soc Hematol Educ Program. 2007;2007:79-83.
- Harteveld CL, Higgs DR. Alpha-thalassaemia. Orphanet J Rare Dis. 2010;5:13.
- Taher A, Vichinsky E, Musallam K et al. Guidelines for the Management of Non Transfusion Dependent Thalassemia (NTDT). Nicosia, Cyprus: Thalassaemia International Federation; 2013.
- Benz EJ. Disorders of hemoglobin. In: Fauci AS, Braunwald E, Kasper DL, et al, eds. Harrison's Principles of Internal Medicine. 17th ed. New York, USA: McGraw-Hill Medical; 2008:635-643.
- Rund D, Rachmilewitz E. Beta-thalassemia. N Engl J Med. 2005;353(11):1135-1146.
- Modell B, Khan M, Darlison M, et al. Improved survival of thalassaemia major in the UK and relation to T2* cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2008;10:42.
- Brittenham GM. Iron-chelating therapy for transfusional iron overload. N Engl J Med. 2011;364(2):146-156.
- Taher AT, Musallam KM, Inati A. Iron overload: consequences, assessment, and monitoring. Hemoglobin. 2009;33 Suppl 1:S46-S57.
- Andrews NC. Disorders of iron metabolism. In: Handin RI, Lux SE, Stossel TP, eds. Blood: Principles and Practice of Hematology. 2nd ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2003:1399-1433.
- Noetzli LJ, Carson SM, Nord AS, et al. Longitudinal analysis of heart and liver iron in thalassemia major. Blood. 2008;112(7):2973-2978.
- Novartis Oncology. LaunchPad Exjade in Thalassemia Wireframe. G-EXJ-1044944. Novartis Pharmaceuticals Corporation. 6-1-2012.
- Wood JC. Diagnosis and management of transfusion iron overload: The role of imaging. Am J Hematol. 2007;82(S12):1132-1135.
- Wood JC. Impact of iron assessment by MRI. Hematology Am Soc Hematol Educ Program. 2011;2011:443-450.
- Pennell DJ, Porter JB, Cappellini MD, et al. Deferasirox for up to 3 years leads to continued improvement of myocardial T2* in patients with betathalassemia major. Haematologica. 2012;97(6):842-848.
- Somani N. Myelodysplastic syndromes: a challenging disease for patients and physicians. J Assoc Physicians India. 2012;60:107-8, 113.
- Coutre S. Myelodysplastic syndromes: disease overview and therapy options.
- Manag Care. 2008;17(7 Suppl 6):3-8.
- Young NS. Aplastic Anemia, Myelodysplasia, and Related Bone Marrow Failure Syndromes. In: Longo DL, Kasper DL, Jameson JL, et al, eds. Harrison's Principles of Internal Medicine. 18th ed. New York, NY: McGraw-Hill Companies, Inc.; 2012:887-897.
- List AF Gore SD. Myelodysplastic Syndromes: Diagnosis and emerging therapies. Charlottesville, VA: Carden Jennings Publishing Co., Ltd.;2004.
- Gilliland DG, Dunbar CE. Myelodysplastic syndromes. In: Handin RI, Lux SE, Stossel TP, eds. Blood: Principles and Practice of Hematology. 2nd ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2003:335-377.
- Foran JM, Shammo JM. Clinical presentation, diagnosis, and prognosis of myelodysplastic syndromes. Am J Med. 2012;125(7 Suppl):S6-13.
- Kouides PA Bennett JM. Understanding myelodysplastic syndromes: A patient handbook. 5th ed. Crosswicks, NJ: Myelodysplastic Syndromes Foundation;2007.
- Greenberg PL, Tuechler H, Schanz J, et al. Revised international prognostic scoring system for myelodysplastic syndromes. Blood. 2012;120(12):24542465. Malcovati L, Germing U, Kuendgen A, et al. Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol. 2007;25(23):3503-3510.
- Greenberg P, Cox C, LeBeau MM, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood. 1997;89(6):2079-2088.
- Sanz G, Nomdedeu B, Such E, et al. Independent Impact of Iron Overload and Transfusion Dependency on Survival and Leukemic Evolution in Patients with Myelodysplastic Syndrome. Presented at: 50th ASH Annual Meeting and Exposition. San Francisco, CA. December 8, 2008:Abstract 640.
- Vidaza (azacitidine) 25 mg/ml powder for suspension for injection Summary of Product Characteristics. Uxbridge, UK: Celgene Europe Ltd; July, 2012.
- Dacogen (decitabine) 50 mg powder for concentrate for solution for infusion Summary of Product Characteristics. Beerse, Belgium: Janssen-Cilag International NV; February, 2013.
- Revlimid (lenalidomide) 2.5 mg, 5 mg, 7.5 mg, 10 mg, 15 mg, 25 mg hard capsules Summary of Product Characteristics. Uxbridge, UK: Celgene Europe LTD; January, 2013.
- Revlimid (lenalidomide) 2.5 mg, 5 mg, 7.5 mg, 10 mg, 15 mg, 25 mg hard capsules Summary of Product Characteristics. Uxbridge, UK: Celgene Europe LTD; January, 2013.
- Cazzola M, Malcovati L. Myelodysplastic syndromes--coping with ineffective hematopoiesis. N Engl J Med. 2005;352(6):536-538.
- Kantarjian H, Fenaux P, Sekeres MA, et al. Safety and efficacy of romiplostim in patients with lower-risk myelodysplastic syndrome and thrombocytopenia. J Clin Oncol. 2010;28(3):437-444.
- Gattermann N, Finelli C, Porta MD, et al. Deferasirox in iron-overloaded patients with transfusion-dependent myelodysplastic syndromes: Results from the large 1-year EPIC study. Leuk Res. 2010;34(9):1143-1150.
- Rose C, Brechignac S, Vassilief D, et al. Does iron chelation therapy improve survival in regularly transfused lower risk MDS patients? A multicenter study by the GFM (Groupe Francophone des Myelodysplasies). Leuk Res. 2010;34(7):1-7.
- Novartis Oncology. LaunchPad Exjade in MDS Wireframe. G-EXJ-1044928. Novartis Pharmaceuticals Corporation. 6-1-2012.
- Steinberg MH. Sickle Cell Disease and Other Hemoglobinopathies. In:
- Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, PA: Elsevier; 2012:1066-1075.
- Saunthararajah Y, Vichinsky EP. Sickle Cell Disease-Clinical Features and Management. In: Hoffman R, Benz EJ, Shattil SJ, et al, eds. Hematology: Basic Principles and Practice. 5th ed. Philadelphia, PA: Elsevier; 2009:577-601.
- Saunthararajah Y, Vichinsky EP. Sickle Cell Disease-Clinical Features and Management. In: Hoffman R, Benz EJ, Shattil SJ, et al, eds. Hematology: Basic Principles and Practice. 5th ed. Philadelphia, PA: Elsevier; 2009:577-601.
- World Health Organization (WHO). Sickle cell disease prevention and control.
- World Health Organization (WHO). 2012 Available at: httр://www.аfro.who.int.
- World Health Organization (WHO). 2012 Available at: httр://www.аfro.who.int.
- Aygun B, Odame I. A global perspective on sickle cell disease. Pediatr Blood Cancer. 2012;59(2):386-390.
- Steinberg MH. Sickle cell anemia, the first molecular disease: overview of molecular etiology, pathophysiology, and therapeutic approaches. ScientificWorldJournal. 2008;8:1295-1324.
- AdamsRJ, McKieVC, HsuL, etal. Prevention of a first stroke by transfusions in children with sickle cell anemia and abnormal results on transcranial Doppler ultrasonography. N Engl J Med. 1998;339(1):5-11.
- Novartis Oncology. LaunchPad Exjade in SCD Wireframe. G-EXJ-1045422. Novartis Pharmaceuticals Corporation. 6-1-2012.
- Bernaudin F, Verlhac S, Arnaud C, et al. Impact of early transcranial Doppler screening and intensive therapy on cerebral vasculopathy outcome in a newborn sickle cell anemia cohort. Blood. 2011;117(4):1130-1140.
- Wanko SO, Telen MJ. Transfusion management in sickle cell disease.
- Hematol Oncol Clin North Am. 2005;19(5):803-8vi.
- Lee MT, Piomelli S, Granger S, et al. Stroke Prevention Trial in Sickle Cell Anemia (STOP): extended follow-up and final results. Blood. 2006;108(3):847-852.
- Adams RJ, Brambilla D. Discontinuing prophylactic transfusions used to prevent stroke in sickle cell disease. N Engl J Med. 2005;353(26):27692778.
- Hydrea 500 mg Hard Capsules Summary of Product Characteristics. Middlesex, UK: E. R. Squibb & Sons Limited; November, 2011.
- Jeffrey S. Stroke Prevention Trial in Children With Sickle Cell Disease and Iron Overload Halted. 2013. Available at: httр://www.mеdscape.com/viewarticle/723291. Accessed March 7, 2012.
- Jeffrey S. Stroke Prevention Trial in Children With Sickle Cell Disease and Iron Overload Halted. 2013. Available at: httр://www.mеdscape.com/viewarticle/723291. Accessed March 7, 2012.
- Ware RE, Helms RW. Stroke With Transfusions Changing to Hydroxyurea (SWiTCH). Blood. 2012;119(17):1-29.
- Tefferi A. Polycythemias, Essential Thrombocytopenia, and PrimaryMyelofibrosis. In: Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, PA: Elsevier; 2012:1090-1098.
- Tefferi A. Polycythemias, Essential Thrombocytopenia, and PrimaryMyelofibrosis. In: Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, PA: Elsevier; 2012:1090-1098.
- Spivak JL. Polycythemia Vera and Other Myeloproliferative Diseases. In: Longo DL, Kasper DL, Jameson JL, et al, eds. Harrison's Principles of Internal Medicine. 18th ed. New York, NY: McGraw-Hill Companies, Inc.; 2012:898904.
- Cervantes F, Dupriez B, Pereira A, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment. Blood. 2009;113(13):2895-2901.
- Hoffman R, Xu M, Barosi G. Primary Myelofibrosis. In: Hoffman R, Benz EJ, Shattil SJ, et al, eds. Hoffman Hematology Basic Principles and Practice. 5th ed. Philadelphia, PA: Churchill Livingstone, Elsevier Ins.; 2009:1-62.
- Mesa RA, Silverstein MN, Jacobsen SJ, et al. Population-based incidence and survival figures in essential thrombocythemia and agnogenic myeloid metaplasia: an Olmsted County Study, 1976-1995. Am J Hematol. 1999;61(1):10-15.
- Abdel-Wahab OI, Levine RL. Primary myelofibrosis: update on definition, pathogenesis, and treatment. Annu Rev Med. 2009;60:233-245.
- DelhommeauF, JeziorowskaD, MarzacC, etal. Molecular aspects of myeloproliferative neoplasms. Int J Hematol. 2010;91(2):165-173.
- Mesa RA, Barosi G, Cervantes F, et al. Myelofibrosis with myeloid metaplasia: disease overview and non-transplant treatment options. Best Pract Res Clin Haematol. 2006;19(3):495-517.
- Mesa RA, Barosi G, Cervantes F, et al. Myelofibrosis with myeloid metaplasia: disease overview and non-transplant treatment options. Best Pract Res Clin Haematol. 2006;19(3):495-517.
- Understanding Lab and Imaging Tests. 2010. American Cancer Society. Available at: httр://www.cаncer.org/Treatment/TreatmentsandSideEffects/PhysicalSideEff ects/Anemia/anemia-in-people-with-cancer. Accessed August 2, 2011.
- Understanding Lab and Imaging Tests. 2010. American Cancer Society. Available at: httр://www.cаncer.org/Treatment/TreatmentsandSideEffects/PhysicalSideEff ects/Anemia/anemia-in-people-with-cancer. Accessed August 2, 2011.
- Mesa RA. How I treat symptomatic splenomegaly in patients with myelofibrosis. Blood. 2009;113(22):5394-5400.
- Verstovsek S. Therapeutic potential of Janus-activated kinase-2 inhibitors for the management of myelofibrosis. Clin Cancer Res. 2010;16(7):1988-1996.
- Tefferi A, Vainchenker W. Myeloproliferative neoplasms: molecular pathophysiology, essential clinical understanding, and treatment strategies. J Clin Oncol. 2011;29(5):573-582.
- Passamonti F, Cervantes F, Vannucchi AM, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: a study by the IWG-MRT (International Working Group for Myeloproliferative Neoplasms Research and Treatment). Blood. 2010;115(9):1703-1708.
- Novartis Oncology. The Hidden Danger of Iron Overload Wireframe. IOE-1056818. Novartis Pharmaceuticals Corporation. 2013:1-79.
- Barbui T, Barosi G, Birgegard G, et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J Clin Oncol. 2011;29(6):110.
- Jakavi Summary of Product Characteristics. West Sussex, UK: Novartis Europharm Limited; October, 2012.
- Hoffman R, Rondelli D. Biology and treatment of primary myelofibrosis. Hematology Am Soc Hematol Educ Program. 2007;1:346-354.
- Gangat N, Caramazza D, Vaidya R, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol. 2011;29(4):392-397.
- Leitch HA, Chase JM, Goodman TA, et al. Improved survival in red blood cell transfusion dependent patients with primary myelofibrosis (PMF) receiving iron chelation therapy. Hematol Oncol. 2010;28(1):40-48.
- Bagby GC. Aplastic Anemia and Related Bone Marrow Failure States. In: Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, PA: Elsevier; 2012:1083-1090.
- Bagby GC. Aplastic Anemia and Related Bone Marrow Failure States. In: Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, PA: Elsevier; 2012:1083-1090.
- Lee JW, Yoon SS, Shen ZX, et al. Iron chelation therapy with deferasirox in patients with aplastic anemia: a subgroup analysis of 116 patients from the EPIC trial. Blood. 2010;116(14):2448-2454.
- Adams PC, Reboussin DM, Barton JC, et al. Hemochromatosis and iron-overload screening in a racially diverse population. N Engl J Med. 2005;352(17):1769-1778.
- Brissot P, de BF. Current approaches to the management of hemochromatosis. Hematology Am Soc Hematol Educ Program. 2006;2006(1):36-41.
- Exjade® (deferasirox) Summary of Product Characteristics. West Sussex, UK: Novartis Europharm Limited; February, 2013.
- Vose JM. Hematopoietic Stem Cell Transplantation. In: Goldman L, Schafer AI, eds. Cecil Medicine. 24th ed. Philadelphia, PA: Elsevier; 2012:1158-1162.
- Gill S, Porter DL. Reduced-Intensity Hematopoietic Stem Cell Transplants for Malignancies: Harnessing the Graft-Versus-Tumor Effect. Annu Rev Med. 2012;1:1-17.
- Pullarkat V. Iron overload in patients undergoing hematopoietic stem cell transplantation. Adv Hematol. 2010;2010:1-12.
- Majhail NS, Lazarus HM, Burns LJ. A prospective study of iron overload management in allogeneic hematopoietic cell transplantation survivors. Biol Blood Marrow Transplant. 2010;16(6):832-837.
667430/HEMA/DIG/06.2023/0
